Hp感染對糖尿病腎病患者尿蛋白及炎癥指標的影響
周飛,鐘曉琴,劉麗秋
(1淄博市臨淄區人民醫院,山東淄博255400;2青島大學醫學院附屬醫院)
糖尿病腎病(DKD)已成為終末期腎病的主要病因,其發病機制是近年來研究的熱點,但具體的機制仍未闡明[1]。最近炎癥學說備受關注,認為炎癥反應是DKD各階段進展的危險因素之一[2]。幽門螺旋桿菌(Hp)作為一種需氧革蘭陰性桿菌微生物,雖然本身不能進入血液循環,但其長期定植于胃黏膜后,可以導致胃上皮細胞表達IL-6、IL-8、TNF-α和IL-18等多種炎癥因子入血[3],在多種胃腸外疾病發病中發揮作用[4]。最近研究發現,糖尿病患者Hp感染率高于對照人群,而且DKD患者的Hp感染率高于非DKD人群,但目前對于Hp感染對DKD的影響及其參與DKD發病的機制尚不明確,相關研究較少。2013年6月~2016年9月,我們觀察了Hp感染對不同階段DKD患者尿蛋白水平、炎癥介質水平的影響,探討Hp感染在DKD發病中的作用及機制。
1 材料與方法
1.1 臨床資料 選擇在淄博市臨淄區人民醫院腎內科、內分泌科就診的伴消化不良癥狀[11]的DKD患者133例,男59例、女74例,年齡(50.2±9.6)歲,病程(8.9±2.5)個月。納入標準:年齡>35歲;有消化不良、腹部不適癥狀;有2型糖尿病病史,符合美國糖尿病協會(ADA)1997年提出的糖尿病診斷標準;DKD診斷標準符合2012年KDIGO指南定義[5],尿白蛋白排泄率(UAE)>30 mg/24 h,eGFR >60 mL/(min·1.73 m2);14C呼氣試驗和血清Hp IgG抗體檢測結果呈雙陽性或雙陰性;UAE、eGFR資料齊全。排除標準:14C呼氣試驗和血清Hp IgG抗體檢測結果只有一項陽性;血清Hp IgG抗體呈弱陽性且拒絕復測;過去的4個月曾應用抗菌藥物;合并需要藥物治療的活動性感染;合并自身免疫性疾病;不同意參加本研究。所有納入患者按照UAE水平分為DKD1組(微量白蛋白尿組,UAE 30~300 mg/24 h)72例、DKD2組(臨床蛋白尿組,UAE>300 mg/24 h)53例。兩組性別、年齡、BMI、空腹血糖、糖化血紅蛋白、血壓、血脂差異無統計學意義。
1.2 Hp感染情況檢測
1.2.114C呼氣試驗 患者禁食4 h以上。吞服14C尿素膠囊(1 μCi)1粒,靜坐20 min。向呼氣卡吹氣5~10 min,直到指示片的顏色由藍變白。將卡插入14C檢測儀,儀器自動進行放射劑量檢測。如果第一次檢測結果不確定時,重復檢測一次。
1.2.2 血清Hp IgG抗體檢測 所有患者空腹12 h抽早晨靜脈血,以ELISA法檢測血清IgG anti-Hp水平,嚴格按說明書的步驟進行操作。抗體指數陽性對照孔平均值≥1.1者為Hp陽性,陰性對照平均值<0.9者為Hp陰性,臨界值0.9~1.1為弱陽性,弱陽性建議復測1次,仍陽性者確定為Hp陽性。
1.2.3 Hp感染評價標準 Hp陽性定義為血清Hp IgG抗體和14C呼氣試驗結果雙陽性,陰性標準為血清Hp IgG抗體和14C呼氣試驗結果雙陰性。
1.3 血清炎癥介質C反應蛋白(CRP)、IL-8、TNF-α水平檢測 取患者空腹靜脈血,應用CRP檢測試劑盒(膠乳增強免疫比濁法)檢測CRP水平,ELISA法檢測IL-8、TNF-α水平。
2 結果
2.1 Hp感染情況 DKD1組Hp陽性45例、Hp陰性27例,DKD2組Hp陽性34例、Hp陰性19例。DKD1組、DKD2組Hp感染率分別為62.5%、53.9%,兩組Hp感染率差異無統計學意義(P>0.05)。
2.2 兩組Hp陽性、陰性者UAE、eGFR比較 DKD1組、DKD2組中,Hp陽性者UAE均高于Hp陰性者(P均<0.05);兩組中Hp陽性與陰性患者eGFR差異均無統計學意義(P>0.05)。見表1。
2.3 兩組Hp陽性、陰性者炎癥介質水平比較 DKD1組、DKD2組中,Hp陽性者CRP、IL-8、TNF-α 水平均高于Hp陰性者(P<0.05或0.01)。見表2。
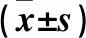
表1 兩組Hp陽性和Hp陰性者UAE、eGFR比較
注:與同組Hp陰性者比較,*P<0.05。
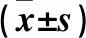
表2 兩組Hp陽性和Hp陰性者炎癥介質水平比較
注:與同組Hp陰性者比較,﹟P<0.01,*P<0.05。
3 討論
DKD發病機制復雜,炎癥反應在其中的作用逐漸得到關注和重視[6]。很多感染性疾病可以通過增加炎癥反應引起血管內皮損傷,從而參與DKD的進展,如乙型肝炎病毒、丙型肝炎病毒、衣原體、巨細胞病毒、EB病毒等[7]。Hp是消化系統最常見的感染病菌,平均感染率能達到50%左右。研究表明,持續的Hp感染能誘發慢性炎癥和免疫反應,進一步導致原位和其他器官的損害,如冠心病、動脈粥樣硬化、糖尿病等[8]。近年研究發現,DKD患者的Hp感染率高于非DKD人群,Hp感染可能通過影響血糖代謝、血脂水平,促進DKD進展。但目前,對Hp感染對DKD的影響及其參與DKD發病的機制尚不明確[9]。
內皮功能受損及炎癥反應導致的微量白蛋白排泄增加,是糖尿病患者最早出現腎臟損害的信號[5]。研究發現,Hp感染也可以導致系統性的炎癥反應和血管內皮損傷[10],因此,有可能通過損傷腎小球微血管導致UAE增加。目前,針對Hp感染與DKD患者UAE的關系研究很少。Tanriverd[11]研究發現,Hp陽性的糖尿病患者較Hp陰性患者有更高的尿微量白蛋白水平。Lin等[12]研究顯示,同時伴有糖尿病和Hp感染的人群,其發生終末期腎衰竭的風險較正常人群高20.5倍,認為Hp感染是腎功能下降的因素之一。但Alimadadi等[13]研究發現,根除Hp對肌酐清除率變化的影響無統計學差異。因此,Hp感染是否作為DKD的危險因素,影響尿蛋白水平、進而導致腎功能的惡化還不確定。本研究發現,DKD1組、DKD2組中Hp陽性者UAE均高于Hp陰性者,提示Hp感染可能增加了DKD患者尿蛋白排泄,而尿蛋白水平增加是糖尿病腎病進展的重要標志之一,表明Hp感染可能促進了DKD疾病的進展,是DKD進展的危險因素之一,但是通過何種途徑尚不清楚;兩組中Hp陽性與陰性患者eGFR差異均無統計學意義,提示Hp感染可能對腎功能影響輕微。考慮本研究對eGFR的觀察只限于慢性腎臟病1期和2期的患者[eGFR>60 mL/(min·1.73 m2)],沒有納入大多數腎衰竭的患者,可能是得出Hp陽性與陰性患者eGFR差異均無統計學意義的原因。
Hp感染的胃黏膜的病理組織及血清中發現多達35種炎癥因子水平增高,多種炎癥介質之間存在相互作用。糖尿病與Hp導致的胃腸道疾病發病機制中存在相同的炎癥因子,如CRP、IL-8、IL-6、TNF-α等[4]。Schram等[22]研究發現,炎癥因子CRP、IL-6、TNF-α與糖尿病微血管患者UAE增加和血管內皮損傷有關。也有研究發現,炎癥因子CRP、VCAM-1與DKD患者白蛋白尿異常密切相關。CRP是血清中較易檢測的蛋白質,反映機體的炎癥狀態,可以使ICAM-1和單核細胞化學誘導蛋白1(MCP-1)水平增加,而后兩者參與血管動脈硬化,是內皮功能損傷的重要標志。血清CRP可能作為聯系細胞因子的激活和炎癥反應的物質之一,參與糖尿病并發癥的發生[14]。IL-8是由多種類型的細胞包括單核細胞、淋巴細胞、纖維細胞、內皮細胞、系膜細胞等產生的炎癥因子。TNF-α是IL-8的趨化因子。本研究發現,DKD1、DKD2組內Hp陽性者的CRP、IL-8、TNF-α水平均高于Hp陰性者,提示無論DKD1、DKD2患者,Hp陽性患者的炎癥因子CRP、IL-8和TNF-α水平均較Hp陰性組高,表明Hp感染導致的慢性炎癥反應可能增加了DKD尿蛋白排泄率,從而影響DKD進展。
綜上所述,感染Hp的DKD患者較Hp陰性患者有更高的UAE和炎癥因子水平,Hp感染可能是導致DKD進展的機制之一。由于本研究樣本量小、研究區域比較局限,Hp感染是否是DKD進展的獨立危險因素之一還有待于進一步研究證實。

