黃體期添加短效GnRH-a在IVF新鮮周期中的應用
李惠敏,李紅,孟慶霞,鄒琴燕,王瑋,許詠樂
(南京醫科大學附屬蘇州醫院,蘇州市立醫院生殖中心,蘇州 215002)
隨著體外受精-胚胎移植(IVF-ET)在臨床上的廣泛開展,IVF-ET周期中普遍存在的黃體功能不全(LPD)逐漸引起關注,LPD臨床上主要表現為子宮內膜與胚胎發育的不同步,子宮內膜容受性降低,導致種植率下降,流產率增加。因此,在IVF-ET周期中,為了提高臨床成功率,黃體支持尤為必要。目前黃體支持藥物主要包括:黃體酮類、雌激素、人絨毛膜促性腺激素(HCG)。1993年Wilshire等[1]發現,在孕早期使用促性腺激素釋放激素激動劑(GnRH-a)并不影響輔助生殖技術臨床妊娠結局。之后越來越多的學者開始探究GnRH-a是否可以作為改善妊娠結局的黃體支持用藥。近些年GnRH-a在IVF-ET周期中也被應用,部分顯示有積極的作用,可以改善臨床結局。2010年的一篇Meta分析認為行拮抗劑方案的患者,在黃體期(取卵后第5或6天)單次使用GnRH-a,其著床率、臨床妊娠率、持續妊娠率均較對照組顯著升高[2]。2011年Cochrane綜述顯示,黃體支持用孕激素+GnRH-a和單用孕激素相比,臨床妊娠率、繼續妊娠率和活產率均明顯提高[3]。
但目前關于短效GnRH-a應用于IVF-ET周期對妊娠結局的影響仍存在爭議。黃體期添加短效GnRH-a仍然是一種選擇性治療,關于其有效性和安全性以及如何選擇合適的患者可以獲益最大,相關的研究較少。本研究旨在探討黃體期添加短效GnRH-a在IVF新鮮胚胎移植周期中是否可以改善妊娠結局以及可能的作用機制。
資料和方法
一、研究對象及分組
回顧性分析2015年1月至2018年1月我中心第1次行IVF-ET的新鮮周期胚胎移植患者618例。納入標準:(1)年齡≤38歲;(2)基礎FSH<15 U/L,抗苗勒管激素(AMH)>1.0 ng/ml;(3)移植日子宮內膜厚度≥7 mm;(4)至少有1個可移植胚胎。排除標準:(1)子宮內膜異位癥患者;(2)子宮畸形、宮腔粘連或子宮肌瘤多發患者;(3)未處理的明顯輸卵管積水患者;(4)疤痕子宮。
所納入患者根據促排卵方案不同,分為長方案組(437例)和拮抗劑方案組(181例);又以黃體期是否添加短效GnRH-a分為對照組(402例)和達必佳組(216例)。長方案組和拮抗劑方案組中又根據是否添加短效GnRH-a,分別分為4個亞組:長方案-達必佳組(A組)、長方案-對照組(B組)和拮抗劑-達必佳組(C組)、拮抗劑-對照組(D組)。比較不同組間和不同亞組間的妊娠結局及并發癥發生情況。
二、研究方法
行長方案治療的患者,月經周期規則者于上一個周期的黃體中期進行降調節;月經周期不規則者于IVF/ICSI治療的前一周期使用達英-35,停藥前5~7 d開始降調節,降調節藥物為短效曲普瑞林(達必佳,輝凌,瑞士)0.05 mg/d皮下注射[4]。降調節后第10~14天檢測FSH、LH、E2水平及基礎竇卵泡數(AFC),當竇卵泡直徑<8 mm、血清E2<183.5 pmol/L、FSH和LH均<5 U/L時,開始給予重組FSH(果納芬,默克-雪蘭諾,德國)啟動促排卵治療。行拮抗劑方案治療的患者,于月經第2~3天啟用重組FSH(果納芬,默克-雪蘭諾,德國)促排卵,根據血清激素水平和卵泡大小適時加用GnRH拮抗劑。兩種方案中Gn起始劑量根據患者的年齡、體重指數(BMI)、血清AMH水平、AFC數確定,當直徑≥18 mm的卵泡大于2~3個時,當晚注射重組HCG(艾澤,默克-雪蘭諾,德國) 250 μg,36 h后取卵。取卵后第3天選取1~2枚優質胚胎進行移植。以下情況患者移植1個胚胎:(1)患者夫妻雙方要求單胚胎移植并簽署知情同意書;(2)僅有1個可移植胚胎;(3)女方身高<155 cm。其余情況均移植2枚胚胎。移植后14 d檢測血HCG水平,并于移植后4~5周B超見到孕囊者確定為臨床妊娠。妊娠時間≥20周定義為繼續妊娠。
對照組行常規方案黃體支持:取卵后第1天開始陰道給藥雪諾同(默克-雪蘭諾,德國)90 mg/d+口服地屈孕酮(達芙通,雅培,荷蘭)10 mg/次,tid。達必佳組為常規黃體支持方案+取卵后第6天予達必佳0.1 mg皮下注射。
三、觀察指標
記錄各組患者的一般情況、促排卵情況、臨床妊娠指標及并發癥發生情況。胚胎種植率=孕囊數/移植胚胎數×100%;臨床妊娠率=臨床妊娠周期數/移植周期數×100%;流產率=流產周期數/臨床妊娠周期數×100%。
四、統計學方法

結 果
一、達必佳組和對照組患者基礎情況比較
本研究共納入618例患者,達必佳組和對照組患者的基本情況,包括年齡、不孕年限、BMI、基礎FSH、AMH、AFC、Gn天數、Gn總量以及移植日內膜厚度等,組間比較均無顯著性差異(P>0.05)(表1)。

表1 達必佳組和對照組患者基礎情況比較 (±s)
二、達必佳組和對照組妊娠結局及并發癥發生情況比較
兩組患者的獲卵數及2PN數比較無顯著性差異(P>0.05)。達必佳組移植胚胎數顯著少于對照組(P<0.05),胚胎種植率及臨床妊娠率有高于對照組的趨勢,但尚無顯著性差異(P>0.05)(表2)。兩組的早期流產率、異位妊娠率及卵巢過度刺激綜合征(OHSS)發生率比較均無顯著性差異(P>0.05)(表3)。
三、不同亞組患者妊娠結局及并發癥發生情況比較
長方案組437例患者中,A、B組間胚胎種植率、臨床妊娠率、持續妊娠率、早期流產率、異位妊娠率及OHSS發生率比較均無顯著性差異(P>0.05)(表4)。拮抗劑方案組181例患者中,C組的胚胎種植率及臨床妊娠率均顯著高于D組(P<0.05)。兩組的早期流產率、異位妊娠率及OHSS發生率均無統計學差異(P>0.05)(表5)。

表2 達必佳組和對照組患者妊娠結局比較 [(±s),%]
注:與對照組比較,*P<0.05

表3 達必佳組和對照組患者不良妊娠結局及并發癥的比較(%)

表4 長方案組中兩亞組的妊娠結局及并發癥發生情況比較(%)
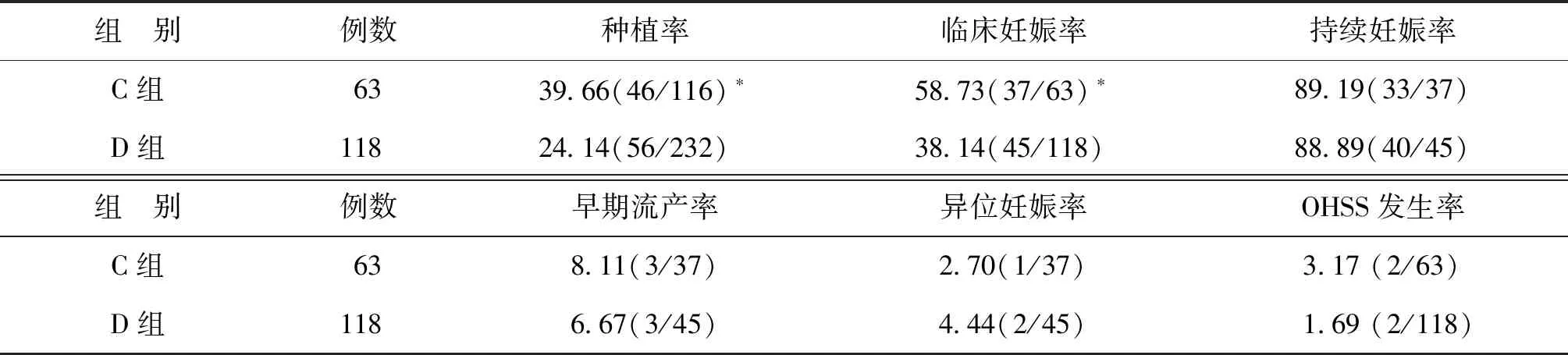
表5 拮抗劑組中兩亞組的妊娠結局及并發癥發生情況比較(%)
注:與D組比較,*P<0.05
討 論
一、黃體期添加短效GnRH-a改善妊娠結局的可能機制
1.GnRH-a促進雌孕激素分泌:GnRH主要由下丘腦分泌,與GnRH受體結合后,促使垂體前葉分泌LH和FSH作用于黃體,從而促進大量雌孕激素的分泌。與GnRH相比,GnRH-a半衰期較長,與相應受體的結合能力顯著增加[5]。
2.GnRH-a改善子宮內膜容受性:Raga等[6]的研究證明,在子宮內膜基質細胞培養液中添加GnRH-a后,白細胞介素(IL)-1受體激動因子顯著升高,而IL-1的高表達可以促進胚胎著床。2004年Tesarik等[7]的研究指出,在黃體期添加GnRH-a后胚胎著床率和出生率均顯著升高,提示GnRH-a改善妊娠結局不僅與改善黃體功能有關,還可能與提高胚胎發育潛能及子宮內膜容受性有關。本研究中,達必佳組的移植胚胎數是顯著降低的,而種植率和臨床妊娠率是有升高趨勢的。提示GnRH-a在增加子宮內膜容受性,提高胚胎種植率方面有可能起重要作用。
3. GnRH-a促進胚胎發育:有研究顯示,在黃體期添加GnRH-a后血清HCG水平升高,提示GnRH-a可以刺激早期著床的胚胎合成HCG[8]。
二、IVF中黃體期添加GnRH-a的臨床效果
長方案中使用GnRH-a進行黃體支持的研究結論不一。2008年有研究顯示,在取卵日、移植日(取卵后第3天)及取卵后第6天分別注射GnRH-a 0.1 mg,胚胎著床率、臨床妊娠率明顯升高[9]。而另一項研究在ICSI后第6天添加GnRH-a 0.1 mg,妊娠結局并沒有明顯改善[10]。另外,Aboulghar等[11]自移植日起每天添加GnRH-a 0.1 mg至移植后14 d,妊娠結局亦沒有明顯改善。本研究長方案組中,A組與B組比較妊娠結局無顯著性差異。原因可能與垂體降調節過程和促排卵期GnRH受體被持續激活,導致脫敏有關。
拮抗劑方案中使用GnRH-a進行黃體支持目前也存在爭議。Ata等[12]在取卵后第6天單次添加GnRH-a 0.1 mg,結果著床率和繼續妊娠率顯著下降,不推薦在黃體期常規添加GnRH-a。Isik等[13]在ICSI后第6天添加GnRH-a(亮丙瑞林)0.5 mg,胚胎著床率、繼續妊娠率及活產率有顯著升高。2015年一項研究選擇拮抗劑方案的ICSI患者,ICSI后第6天添加GnRH-a 0.1 mg,發現妊娠率及著床率有顯著升高[14]。
2016年的Meta分析共納入3 406例患者,分析發現無論是長方案或拮抗劑方案,黃體期添加GnRH-a均可增加出生率或繼續妊娠率、臨床妊娠率、多胎率,尤其是在使用拮抗劑方案時[15]。本研究中拮抗劑方案組患者C組的種植率及臨床妊娠率均較D組顯著提高,提示GnRH-a在增加子宮內膜容受性、提高胚胎種植率及促進胚胎發育等方面可能有重要作用。
目前,對于關于如何選擇合適的患者添加GnRH-a進行黃體支持治療可以獲益最大,相關的研究較少,Kung等[16]研究認為,在≤38歲的ICSI患者中,基礎FSH>8 U/L或者獲卵數<3個時,取卵后第6天添加GnRH-a 0.1 mg,妊娠結局明顯改善。
三、黃體期添加GnRH-a的安全性
研究顯示,孕早期使用GnRH-a并不會增加胎兒畸形率[17]。Kung等[16]研究顯示,無論是長方案或拮抗劑方案,取卵后第6天添加GnRH-a 0.1 mg,OHSS風險并未增加。Fusi等[18]選擇行拮抗劑方案的高反應患者,與HCG扳機相比,GnRH-a扳機并在胚胎移植后開始隔日添加GnRH-a 0.1 mg,早發型OHSS的發生率顯著降低,而且妊娠結局不受影響。本研究中,無論長方案或拮抗劑方案,添加達必佳的患者OHSS率與對照組均無顯著性差異(P>0.05)。由于隨訪時間的局限性,胎兒安全性數據尚不完善。
綜上所述,鮮胚移植IVF周期中黃體中期添加短效GnRH-a對妊娠結局是有積極意義的,特別是在拮抗劑方案中,GnRH-a可能通過增加子宮內膜容受性及提高胚胎發育潛能提高胚胎種植率。但由于本研究是回顧性研究,受諸多因素影響,還需要擴大臨床數據進一步驗證其臨床效果,而且在眾多的研究中,GnRH-a的最佳使用劑型、劑量、時間、給藥途徑并沒有統一的標準,還需要進一步大樣本的臨床研究為其提供證據,并進一步明確GnRH-a的作用機制,以便更好地指導臨床。

