TAF1蛋白及其抑制劑研究進展
陳海芳,陳亞東,唐偉方
(中國藥科大學理學院,江蘇 南京 211198)
表觀遺傳(epigenetics)是指DNA序列未發(fā)生變化,但基因表達卻發(fā)生了可遺傳的改變。表觀遺傳調(diào)控機制涉及組蛋白修飾、組蛋白變體、DNA甲基化、非編碼RNA修飾及染色質(zhì)重塑等[1-2],其失調(diào)會導致MYC致癌基因過度表達,激活促炎細胞因子,誘導癌癥和炎癥性疾病進一步惡化[3],是當前生命科學研究中的一個熱點。蛋白質(zhì)的翻譯后修飾(post-translational modification,PTM)是表觀遺傳的重要內(nèi)容,它建立并維持基因表達的順序[4-5]。賴氨酸殘基的ε-N-乙酰化是蛋白質(zhì)中最常發(fā)生的翻譯后修飾之一,常以單個或與其他多種染色質(zhì)修飾共存的方式,存在于多種核蛋白中,主要是組蛋白[6]。組蛋白的乙酰化修飾通過中和ε-氨基上的正電荷,減弱DNA與組蛋白的相互作用,使本身纏繞緊密的染色質(zhì)處于松弛狀態(tài),從而有助于DNA聚合酶和RNA聚合酶的結合及其他轉(zhuǎn)錄因子的招募,促進DNA修復、復制以及基因轉(zhuǎn)錄等過程[5,7-8]。組蛋白的乙酰化水平由組蛋白乙酰基轉(zhuǎn)移酶(HATs)、“閱讀器”蛋白(reader)和組蛋白去乙酰化酶(HADCs)共同調(diào)控[7,9],而這一過程的關鍵是“reader”蛋白識別能最終決定表型改變的特定PTM。
目前,人們已發(fā)現(xiàn)3種組蛋白乙酰化賴氨酸的“reader”蛋白:bromodomain(BRD)[10]、雙PHD指蛋白[11]和普列克底物蛋白同源結構域[12]。較長時間內(nèi), BRD是唯一的一個為人所知的乙酰化組蛋白“reader”[7]。BRD結構域大約有110個氨基酸組成,在染色質(zhì)結構變化和轉(zhuǎn)錄調(diào)節(jié)中發(fā)揮重要作用。至今,已在人體46種蛋白中發(fā)現(xiàn)了61種BRDs,根據(jù)其結構和序列相似性分為八大家族[13-14](見圖1)。盡管序列變化很大,但所有BRDs共享一個高度保守的二級折疊結構,其由4個反向平行的α-螺旋束(αZ、αA、αB、αC)組成,通過稱為ZA環(huán)和BC環(huán)的柔性環(huán)區(qū)域連接,它們在序列和電荷上是可變的,并且形成了一個深疏水口袋即乙酰結合位點。盡管各種溴結構域的環(huán)區(qū)域存在差異,但負責識別乙酰化賴氨酸(Kac)的氨基酸殘基是高度保守的。在大多數(shù)BRDs中,Kac通過氫鍵與疏水口袋附近的天冬酰胺(Asn)和酪氨酸(Tyr)殘基形成關鍵的相互作用[15]。

圖1 人bromodomain家族樹
BRDs作為特異性識別組蛋白乙酰化賴氨酸的結構域,通過募集不同的分子伴侶來調(diào)節(jié)基因轉(zhuǎn)錄[16]。近年來,人們越來越關注開發(fā)能夠靶向特定BRD的小分子,這不僅有助于闡明含BRD蛋白的生物學功能,還不斷開辟了治療疾病的新領域。TAF1是第VII bromodomain蛋白家族中的重要一員,參與細胞凋亡誘導和細胞周期調(diào)控等多種重要的生理過程[17]。TAF1作為轉(zhuǎn)錄因子ⅡD(transcription factor ⅡD,TFⅡD)中的重要亞單位[18],通過其串聯(lián)的bromodomain結構域[分別命名為TAF1(1)和TAF1(2)]識別組蛋白H4雙乙酰化的賴氨酸尾部(K8ac/K16ac、K5ac/K12ac、K5ac/K8ac/K12ac/K16ac)[19],結合到核心啟動子序列上,啟動轉(zhuǎn)錄[20](見圖2)。TAF1擁有乙酰轉(zhuǎn)移酶活性、泛素激活酶或結合酶活性,在基因轉(zhuǎn)錄過程中發(fā)揮關鍵調(diào)控作用[17]。TAF1也是組蛋白乙酰轉(zhuǎn)移酶復合物STAGA的組分,可與多種介導復合物協(xié)調(diào)配合激活轉(zhuǎn)錄[21]。而且,作為TFⅡD復合體中的最大組成單位,TAF1還可通過其激酶結構域參與p53的磷酸化,導致p53降解和調(diào)控細胞周期G1期進展。此外,TAF1的失活可觸發(fā)DNA損傷響應[22]。TAF1也是雄激素受體(AR)的一個共激活子,通過其N-末端激酶和泛素激活/綴合酶不同程度地增強雄激素受體轉(zhuǎn)錄活性[23]。
雖然TAF1在細胞生長和細胞周期的調(diào)節(jié)中發(fā)揮關鍵作用,但其與疾病的關系卻知之甚少。已知在腫瘤方面,TAF1易受到MYC的致癌活化,導致癌細胞增殖[24]。胃癌和結直腸癌中也發(fā)現(xiàn)了TAF1基因的移碼突變[17]。TAF1也可作為肝纖維化的標記物,與肝纖維化、肝癌的發(fā)生發(fā)展關系密切[25-26]。在神經(jīng)系統(tǒng)疾病方面,TAF1基因突變與一些綜合征的發(fā)生有關,如X連鎖肌張力障礙-帕金森病[XDP(MIM:314250)][27]、RykDax 綜合征[28],其主要表現(xiàn)為智力障礙、臉部畸形和神經(jīng)系統(tǒng)異常[29]。最近有多項研究進一步闡明了TAF1參與XDP的病理過程[30-31],使得TAF1有望成為治療XDP的新靶點。

圖2 TFⅡD復合體中各結構組成單位與DNA的相互識別作用
TAF1在基因轉(zhuǎn)錄過程中是必需的,通過其bromodomain結構域特異性的識別乙酰化的組蛋白,將正轉(zhuǎn)錄伸長因子b復合物(positive transcription elongation factor b,p-TEFb)募集至核小體,由此使RNA聚合酶Ⅱ(RNA PolⅡ)的C末端磷酸化且增加鄰近基因的轉(zhuǎn)錄延伸,介導靶基因的轉(zhuǎn)錄激活(見圖2)[32]。近期研究進一步表明在轉(zhuǎn)錄過程中TAF1可直接與BRD4(BET bromodomain家族成員之一[33])相互作用,協(xié)同介導基因的轉(zhuǎn)錄控制(見圖3A)[21]。在TAF1和BRD4的靶向之間,還存在有強烈的協(xié)同作用,使得靶向作用于TAF1 bromodomain結構域的小分子可阻斷癌細胞中BRD4介導的MYC轉(zhuǎn)錄,從而讓TAF1小分子抑制劑對BRD4依賴性癌細胞產(chǎn)生強烈的抑制作用(見圖3B),同時,TAF1基因敲除可增加BRD4對癌細胞抑制的敏感性[34]。TAF1與BRD4協(xié)同控制癌細胞的增殖,使得TAF1成為一個在由MYC驅(qū)動的癌癥中具有吸引力的表觀遺傳學新靶點。
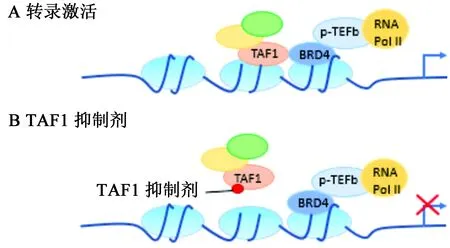
圖3 A.TAF1與BRD4基因轉(zhuǎn)錄協(xié)同調(diào)控示意圖;B.TAF1抑制對基因轉(zhuǎn)錄的影響
在TAF1 bromodomain家族中,TAF1(2)bromodomain因其具有較高的成藥性[35],已逐漸成為研究者關注的一個新靶標,目前已報道了多種TAF1(2)bromodomain抑制劑,大致可分為六類:3,5-二甲基異噁唑類、三氮唑類、異喹啉酮類、吡咯并吡啶酮類、苯并異喹啉二酮類和二價TAF1抑制劑。
1 3,5-二甲基異噁唑類
UMB-32(1)[36]是該類母核的一個代表性化合物(見圖4)。Bradner課題組使用含氟標記的多組分反應來開發(fā)含有3,5-二甲基異噁唑結構的bromodomain抑制劑庫。隨后對化合物骨架的優(yōu)化得到了化合物UMB-32,其除了對BRD4有強結合(解離常數(shù)Kd:80 nmol·L-1)之外,同時也顯示出對TAF1(2)(Kd:560 nmol·L-1)的有效結合。盡管UMB-32與TAF1(2)的結合相對較弱,但這一觀察結果表明了一個開發(fā)選擇性TAF1 bromodomain化學探針的開始。

圖4 化合物1的結構及其與TAF1(2)bromodomain的對接(PDB: 5MG2)
2 三氮唑類
Bromosporine(BSP,2)[37]是較早發(fā)現(xiàn)的含有三氮唑結構的廣譜BRDs抑制劑(見圖5),作用于TAF1(2)、BRD2、BRD4、BRD9和CECR2的IC50分別為52、410、290、122和17 nmol·L-1。BSP與TAF1(2)bromodomain的對接顯示,其能很好地占據(jù)Kac結合口袋。BSP對乳腺癌、白血病、中樞神經(jīng)系統(tǒng)癌癥、前列腺癌、結腸癌等60多種細胞株都有較強抑制,尤其是白血病細胞株。BSP有和泛BET抑制劑(+)-JQ1相似的細胞增殖影響,但抑制活性稍差于(+)-JQ1。
3 異喹啉酮類
Sdelci等[34]在篩選能調(diào)節(jié)BRD4活性而不直接與BRD4蛋白相互作用的小分子化合物時,發(fā)現(xiàn)化合物CeMMEC1(3,見圖6)在轉(zhuǎn)錄、細胞周期和細胞凋亡中具有與(+)-JQ1相似的細胞效應,且對TAF1(2)顯示出一定的親和力(IC50:900 nmol·L-1)。依托于化合物CeMMEC1與TAF1(2)bromodomain的對接結果,他們繼續(xù)優(yōu)化得到了更具選擇性的化合物CeMMEC13(4)。CeMMEC13在細胞活力測定中顯示出與(+)-JQ1有協(xié)同作用。而酰胺連接子反接得到的CeMMEC14(5)卻使活性下降很多。這些化合物證明了TAF1(2)bromodomain的成藥性,開辟了專門針對MYC誘導的癌癥中TAF1(2)bromodomain的新研究思路。
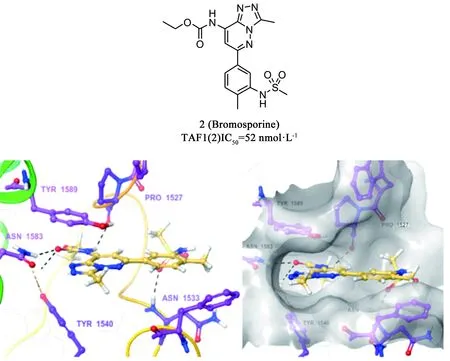
圖5 化合物2的結構及其與TAF1(2)bromodomain的對接(PDB: 5MG2)
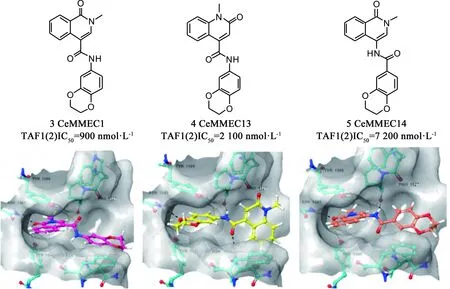
圖6 化合物3/4/5的結構及其與TAF1(2)bromodomain的對接(PDB: 5MG2)
4 吡咯并吡啶酮類
2016年,Crawford等[38]發(fā)現(xiàn)N-甲基吡咯并吡啶酮結構是一個對BRD家族成員具有強結合效應的片段分子,其對所測試的8個BRD的配體效率(LE)都大于0.54。后續(xù)對該片段分子改造得到了化合物6,其作用于TAF1(2)、BRD4(1)、BRD4(2)、BRD9和CECR2的IC50分別為59、92、65、230和240 nmol·L-1,選擇性較差。而以1-丁烯基取代甲基的化合物9對TAF1(2)、BRD4(1)、BRD4(2)、BRD9和CECR2的IC50分別為46、2 500、5 500、1 400和4 800 nmol·L-1,選擇性較好。化合物9與TAF1(2)(PDB 5I29)的共晶顯示(見圖7B),吡啶酮的羰基氧及吡咯的氮氫與天冬酰胺1583(N1583)形成二齒的關鍵氫鍵,此外吡啶酮的羰基氧還可通過一個水分子與酪氨酸1540(Y1540)形成間接氫鍵,這很好地模擬了乙酰化賴氨酸和TAF1(2)bromodomain的結合,是該化合物產(chǎn)生活性的主要原因。化合物中的丁烯基相比甲基,能更好地深入附近的空腔,置換空腔內(nèi)的水分子,誘導形成更穩(wěn)定的水分子網(wǎng)絡,提高了其對TAF1(2)的選擇性。此外苯甲酰胺的羰基氧與1533位的天冬酰胺(N1533)的主鏈氮氫形成直接氫鍵。

圖7 化合物6/9/10的結構及其分別與TAF1(2)bromodomain的晶體結合模式注:圖中A、B、C分別是化合物6/9/10在TAF1(2)bromodomain的晶體結合模式,PDB分別為5I29/5I1Q/6DF7
2018年,Crawford等[39]繼續(xù)對化合物9的甲酰胺和苯環(huán)部分進行改造,得到了選擇性和活性都更高的化合物GNE371(10),其對TAF1(2)的IC50為10 nmol·L-1,而對其他bromodomain基本上沒有活性。化合物GNE371與TAF1(2)bromodomain的共晶結構顯示(見圖7C),該化合物在保持化合物9原有的氫鍵作用的基礎上,增加了一個咪唑上的氮原子與酪氨酸1589(Y1589)的酚羥基的氫原子之間的氫鍵作用,這可能是提高選擇性的關鍵。嗎啉環(huán)取代二甲基后更好地占據(jù)了附近的空腔,進一步提高了化合物的活性。在一個測試靶標參與的實驗中,即使在100 nmol·L-1的濃度下,化合物10仍然使細胞對(+)-JQ1的敏感性增加。這也是迄今為止,唯一的一個高選擇性和高活性的TAF1(2)小分子抑制劑,非常適用于探究TAF1(2)的生物學功能。
5 苯并異喹啉二酮類
Bouchel等[40]在研究選擇性的BRPF抑制劑的過程中,意外發(fā)現(xiàn)化合物BAY299(11)是一個BRPF2/TAF1(2)雙靶點抑制劑,其對BRPF2、TAF1(2)的IC50分別為67、8 nmol·L-1,而對bromodomain其他家族尤其是BET家族,活性較差。BAY299對組蛋白H3、H4與TAF1(2)相互作用的IC50分別為970、1 400 nmol·L-1,而且對血液瘤細胞有較弱的抑制作用。大鼠的藥代動力學研究顯示該化合物具有良好的藥代動力學特性,如低的血液清除率(約占肝血流量的17%),高的穩(wěn)態(tài)分布容積(Vss=1.5 L·kg-1),長的半衰期(t1/2=10 h,靜脈注射),良好的生物利用度(F=73%)。BAY299與TAF1(2)的共晶結構顯示(見圖8),苯并咪唑酮結構模擬乙酰化賴氨酸,與N1583形成關鍵氫鍵以及通過水分子與Y1540形成間接氫鍵。
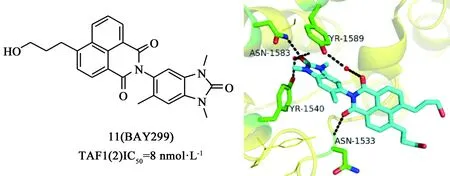
圖8 化合物11的結構及其與TAF1(2)bromodomain的晶體結合模式(PDB: 5MG2)
6 二價TAF1抑制劑
二價結合通過靶向同一蛋白中多個BRD結構域來增強化學探針的親和力和特異性,是研究含BRD蛋白在疾病中的作用的一種有效手段[41]。2018年3月,F(xiàn)rye課題組[42]報道了一系列針對TAF1 bromodomain的二價抑制劑,包括UNC4495(12)、UNC4512(13)、UNC4928(14)等,這類化合物可以同時結合TAF1中兩個不同的bromodomain結構域,其對TAF1 bromodomain復合物的Kd值分別為6.35、10.80和9.69 nmol·L-1。二價抑制劑確實表現(xiàn)出比單價抑制劑更好的細胞性質(zhì),這進一步印證了二價結合的有效性,提供了一個更好地探究TAF1蛋白的功能及在疾病中的作用的高效探針。

圖9 化合物12~14的結構
TAF1蛋白的表觀遺傳功能與腫瘤、帕金森病等疾病聯(lián)系密切,目前研究表明它們有望成為腫瘤治療的新靶標。TAF1(2)bromodomain已顯示與BRD4 bromodomain有協(xié)同作用,確定TAF1(2)bromodomain是否也與BET bromodomain家族的其他成員相關聯(lián)顯得尤為必要。如果TAF1只與BRD4有協(xié)同作用,那么抑制TAF1(2)bromodomain可以允許選擇性調(diào)節(jié)BRD4活性,這可能會給BRD4抑制的治療帶來益處,有助于避免臨床試驗中泛BET抑制劑帶來的副作用。此外,理解TAF1不同于BET bromodomain的轉(zhuǎn)錄效應也可以揭示TAF1抑制劑的替代治療機會。目前,TAF1(2)抑制劑數(shù)量相對較少,母核結構相對單一,獲得更多具有高活性、高選擇性的TAF1(2)抑制劑來進一步闡明其生物學作用以及與疾病相關作用至關重要。

