高效液相色譜-串聯質譜法測定雜糧豆類中11 種真菌毒素
張新娜,馬麗艷,2,*,潘賽超,張春嬌,張永新,周 昉,黃昆侖,2,戴蘊青,2
(1.農業部農產品貯藏保鮮質量安全風險評估實驗室(北京),北京 100083;2.中國農業大學食品科學與營養工程學院,北京 100083)
真菌毒素是一類由絲狀真菌在適宜條件下產生的有毒次級代謝產物[1],迄今發現已有400多種真菌毒素[2],是繼農藥殘留、重金屬污染后,影響糧食質量安全的又一類關鍵風險因子。當前發現的主要威脅人類和動物健康的真菌毒素種類有黃曲霉毒素(aflatoxins,AF)、赭曲霉毒素A(ochratoxin,OTA)、伏馬毒素(fumonisins,FB)、玉米赤霉烯酮(zearalenone,ZEN)、HT-2毒素、T-2毒素、脫氧雪腐鐮刀菌烯醇(deoxynivalenol,DON)、橘毒素、展青霉素、鏈格孢霉毒素等[3-4]。大量研究表明,真菌毒素可致DNA損傷,低濃度下即可對人和動物健康造成危害,使肝臟、腎臟和胃腸道發生病變,有些毒素還具有致癌、致畸、致突變等毒性[5-6]。
雜糧豆類是除大豆之外的小宗淀粉質豆類的總稱,主要包括綠豆、豌豆、蠶豆、紅小豆、扁豆、豇豆、蕓豆、鷹嘴豆等[7]。雜糧豆類有一定的營養、保健和藥用價值,隨著飲食習慣和膳食結構的變化,人們對雜糧豆類的需要越來越多[8]。目前,糧食中真菌毒素的危害已經引起廣泛重視,但是對雜糧豆類產品,由于產地分散,產量規模小,其安全問題還未引起足夠的重視。但是,已有研究表明,在雜糧豆類的生長過程中易受到豆類根腐病、細菌性葉斑病、灰斑病、銹病、蕎麥鉤翅蛾等為主的病蟲害的危害,從而影響產品產量和質量、埋下食品安全隱患[9]。目前對糧谷的真菌毒素報道很多[10-14],對豆類的研究主要集中在大豆上,在其他雜糧豆類中的研究較少[15-17]。Castillo等[18]研究發現黑豆可能存在鏈格孢霉毒素、ZEN和單端孢霉烯族毒素的污染風險。Tseng等[19-20]在白豆中檢測到蛇形霉素、ZEN、T-2和FB1、AFB1、AFB2、AFG1、AFG2,赤豆和綠豆中檢測到了FB1。Iha等[21]則發現不同加工處理過程可以減少黑白斑豆中OTA的污染水平。
真菌毒素的檢測方法主要有薄層色譜法、氣相色譜法、氣相色譜-質譜法、酶聯免疫吸附法、高效液相色譜法、高效液相色譜-串聯質譜法等[22-30]。目前國家標準中測定真菌毒素的方法多針對某種或某類毒素,樣品的前處理方法多采用固相萃取柱、真菌毒素專用凈化柱或免疫親和柱凈化,選擇性較強[31-34]。由于真菌毒素的種類較多,且同一樣品可能污染多種真菌毒素,建立多種毒素同時測定的方法對于全面掌握真菌毒素的污染狀況非常必要。高效液相色譜-質譜聯用具有高選擇性和靈敏度,可以同時檢測多種化合物,在真菌毒素檢測中的應用越來越廣泛。與常見的小麥、稻谷、玉米等糧谷類樣品相比,紅豆、綠豆、黑豆等雜糧豆類中在色素、蛋白質、脂肪、碳水化合物等的含量有一定的差異,在質譜中基質對毒素離子化效果會產生一定的影響。因此,本實驗針對雜糧豆類中易感染的真菌毒素,通過優化提取溶劑、提取時間、凈化方式等,建立高效液相色譜-串聯質譜同時檢測多種真菌毒素的方法,為更好地監控雜糧豆類中真菌毒素的污染狀況、實施質量安全監管、指導消費者安全膳食提供參考。
1 材料與方法
1.1 材料與試劑
紅豆、綠豆和黑豆等樣品分別購自北京市、河北省大型連鎖超市,以及北京市及河北省縣級農貿市場。
AFB1、AFB2、AFG1、AFG2、OTA、T-2毒素、DON、FB1、FB2、FB3、ZEN、MycoSep 226多功能凈化柱美國Romer公司;乙腈、甲醇(均為色譜純) 北京百靈威科技有限公司;C18吸附劑 安捷倫科技(中國)有限公司;Florisil吸附劑 天津博納艾杰爾科技有限公司;超純水(Millpore純水儀制備)。
1.2 儀器與設備
6460高效液相色譜-串聯質譜儀 美國安捷倫科技有限公司;渦旋振蕩器 海門市其林貝爾儀器制造有限公司;YP5002電子天平 上海越平科學儀器有限公司;HC-3018離心機 安徽中科中佳科學儀器有限公司。
1.3 方法
1.3.1 樣品前處理
豆類樣品混合均勻,用粉碎機粉碎,過40 目篩。
稱取研磨好的樣品5.0 g(精確到0.01)于50 mL離心管中,加入15.0 mL甲醇-水(70∶30,V/V),渦旋振蕩3 min,在8 000 r/min離心5 min,上清液轉移至干凈容器中,再次向樣品中加入10.0 mL乙腈-水(84∶16,V/V),渦旋振蕩3 min,8 000 r/min離心5 min,合并上清液,混勻,取1 mL提取液于2 mL離心管中,加入30 mg C18吸附劑,渦旋30 s后離心,上清液過0.22 μm有機濾膜,待測。
1.3.2 色譜條件
色譜柱:Agilent Proshell 120 EC-C18(3.0 mm×100 mm,2.7 μm);流動相:A為0.1%甲酸溶液;B為乙腈;梯度洗脫程序:20% B保持1 min;5 min變為65% B;8 min變為85% B;保持2 min;10.01 min變為20% B保持6 min;柱溫30 ℃;流速0.3 mL/min;進樣量2.0 μL。
1.3.3 質譜條件
離子源:電噴霧離子源,正負模式切換;檢測方式為多反應監測;離子源溫度350 ℃;干燥器溫度350 ℃;干燥器流速10 L/min;鞘氣溫度300 ℃;鞘氣流速11 L/min;毛細管電壓3 500 V;碰撞氣為N2。
采用直接進樣的方式,將一定濃度的真菌毒素標準溶液注入高效液相色譜-串聯質譜中進行質譜條件優化,確定多反應監測參數。
1.4 數據分析
所有實驗至少重復3 次,數據以平均值表示,采用Excel 2013軟件進行統計分析和繪圖。
2 結果與分析
2.1 質譜條件優化
分別在正離子和負離子模式下進行母離子掃描,設置掃描范圍為200~800 u,確定不同模式下化合物的響應值。確定母離子后,進行子離子掃描,優化碰撞電壓。優化結果表明,ZEN在負模式下靈敏度較高,其他化合物在正模式下靈敏度較高,11 種真菌毒素多反應監測質譜參數見表1,11 種真菌毒素基質標準溶液的總離子流圖見圖1。
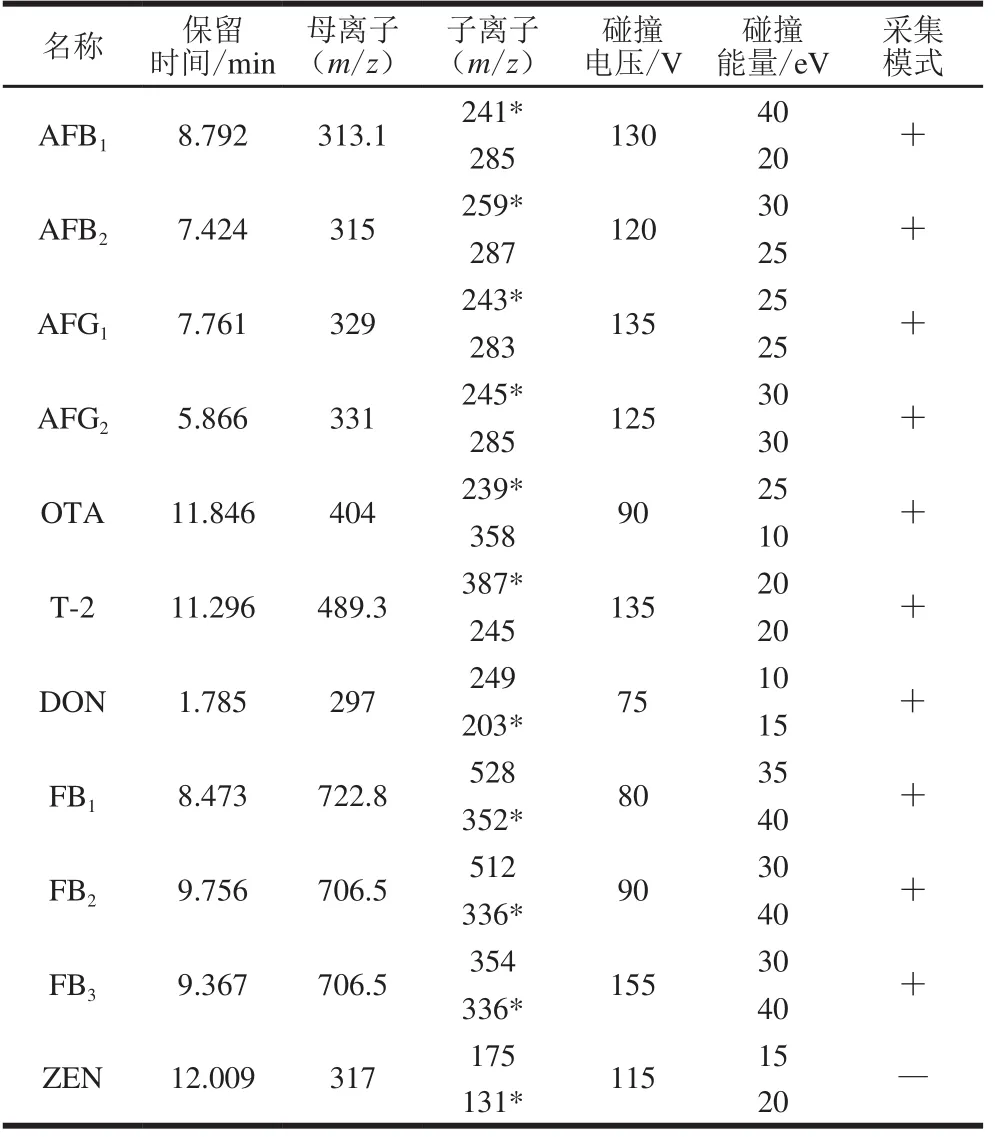
表 1 11 種真菌毒素的多反應監測質譜參數Table 1 Multiple reaction monitoring parameters for 11 mycotoxins
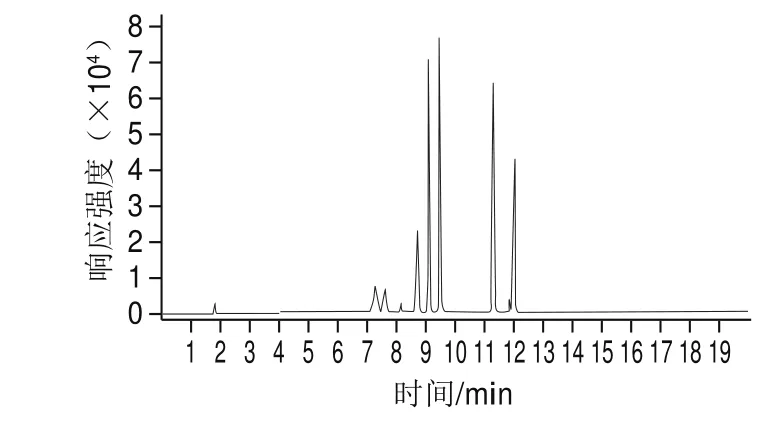
圖 1 11 種真菌毒素基質標準溶液總離子流圖Fig. 1 Total ion current chromatograms of matrix standard solution of 11 mycotoxions
2.2 實驗條件優化
2.2.1 提取溶劑優化
實驗比較5 種提取溶液的提取效果,提取液分2 次提取,結果見圖2。
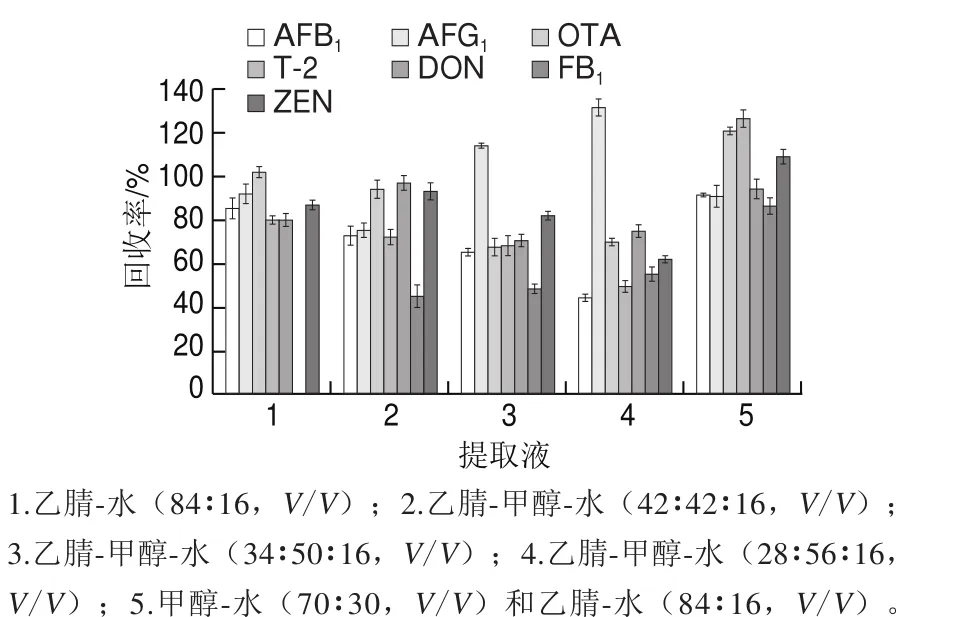
圖 2 溶劑對真菌毒素提取效果的影響Fig. 2 Recovery rates of mycotoxins in different extraction solvents
大多數真菌毒素易溶于有機溶劑。乙腈和甲醇是目前最常用的兩種提取溶劑,它們常與一定比例的水組合來提取不同極性的真菌毒素。乙腈-水(84∶16,V/V)是常用的組合,可用于AF、ZEN、DON等毒素的提 取[31,33,35]。 從 圖2可 以 看 出 ,利用乙腈-水(84∶16, V/V)提取時,除FB1外,其他真菌毒素的回收率均能達到80%以上,這與B族FB的分子含有羧基基團,極性較強,在該提取溶劑溶解性差有關。在乙腈、甲醇和水3 種溶劑中,極性最大的為水,其次是甲醇,實驗發現隨著體系中甲醇比例的提高,對FB的提取率逐漸增加,但對其他真菌毒素,特別是AFB1的提取率有所下降。考慮到不同真菌毒素的極性差異,實驗采用分步提取的方式進行提取,先用甲醇-水(70∶30,V/V)溶劑體系進行第1次提取,將FB等高極性的化合物提取出來,再用乙腈-水(84∶16,V/V)體系進行第2次提取,將AF等充分提取,從圖2可以看出,經過雙體系聯合提取后,11 種真菌毒素均達到理想的提取效果。
2.2.2 提取時間優化
實驗分別比較提取1、2、3、4 min的提取效果,結果表明,提取時間為1 min時DON、FB1、OTA和ZEN的回收率小于60%;提取時間為2 min時,除FB1外,回收率均超過了70%;當提取時間為3 min時,所有真菌毒素的回收率均大于70%,延長提取時間為4 min時,回收率無明顯提高,而提取時間的延長可能會使化合物分解或產生變化[13]。因此,實驗確定提取時間為3 min。
2.2.3 凈化方式優化
在毒素的提取過程中樣品中的碳水化合物、蛋白質、脂肪、色素等組分也部分被提取,不僅會影響痕量目標物的檢測,也會對色譜、質譜系統造成污染。為降低基質效應,需要對提取液進行凈化。MycoSep 226多功能凈化柱在多組分真菌毒素的分析中應用較多[35-36],Florisil和C18吸附劑對脂類、非極性干擾物有一定的吸附作用。實驗比較MycoSep 226多功能凈化柱、Florisil和C18吸附劑的凈化效果。結果發現提取液經MycoSep 226多功能凈化柱凈化后,FB1和OTA被吸附無法檢測到,這與劉丹等[36]的研究一致。提取液中加入30 mg吸附劑凈化后,Florisil對FB1有一定的吸附,而C18的凈化效果良好,除FB1和ZEN的回收率在80%左右外,其他毒素的回收率均達90%以上,凈化后效果良好。Sun Juan等[37]在研究谷物中多種毒素的提取方法時也發現C18吸附劑凈化后,大多數真菌毒素的回收率為60.0%~101.7%,結果較為滿意。實驗發現隨著C18吸附劑加入量的增加,也會對FB1和ZEN有一定的吸附,因此本實驗采取30 mg C18進行凈化處理。
2.2.4 線性關系、檢出限和定量限測定
分別吸取不同濃度的真菌毒素標準溶液,用空白基質配制標準曲線,按建立好的方法進行質譜分析,以質量濃度為橫坐標,定量離子的響應值為縱坐標繪制標準曲線,以3 倍信噪比計算方法的檢出限。標準溶液的線性范圍、相關系數及檢出限見表2。
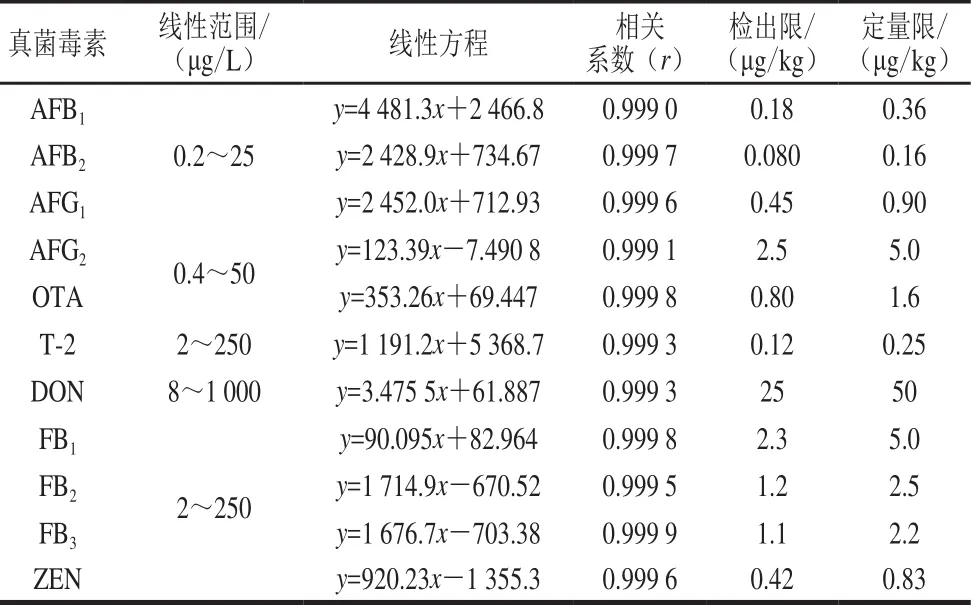
表 2 11 種真菌毒素的線性范圍、相關系數和檢出限Table 2 Linear ranges, correlation coefficients (r) and LODs of 11 mycotoxins
從表2可以看出,不同真菌毒素標準曲線的質量濃度范圍有一定差異,主要考慮了真菌毒素的限量水平、儀器的響應值、實際陽性樣品的含量范圍等因素。11 種真菌毒素在各種范圍內線性關系良好,相關系數在0.999 0~0.999 9之間。GB 2761—2017《食品中真菌毒素限量》中規定了食品中6 種真菌毒素的限量,其中涉及豆類及其制品有AFB1和OTA,其限量均為5 μg/kg;涉及谷物及其制品中有DON和ZEN,限量分別為1 000 μg/kg和60 μg/kg,目前尚未對FB和T-2毒素制定限量標準。歐盟對直接食用的玉米中FB的限量為1 000 μg/kg;對其他谷物中T-2的限量為50 μg/kg[38],從已有的限量看,本實驗建立的方法能滿足食品中真菌毒素殘留限量的測定要求。
2.2.5 方法的準確度和精密度
采用添加回收的方法測定方法的準確度。分別向空白樣品中添加不同濃度的真菌毒素標準溶液,按確定好的方法提取、凈化、分析,加標回收率實驗結果見表3。
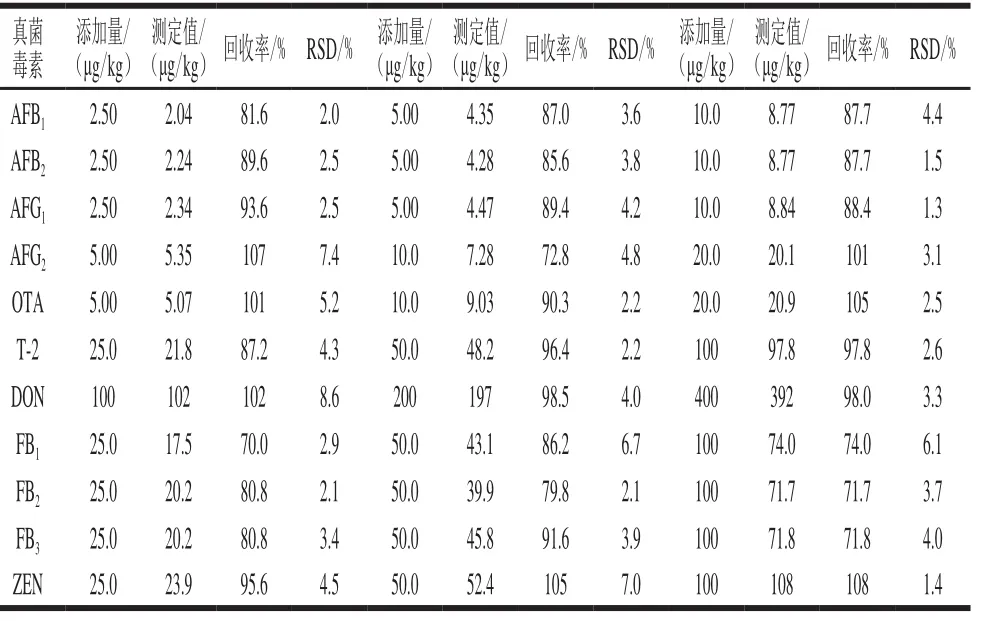
表 3 11 種真菌毒素的加標回收率(n= 6)Table 3 Recoveries and relative standard deviations of 11 mycotoxins from spiked samples (n= 6)
從表3可以看出,11 種真菌毒素在2.50、5.00、25.0 μg/kg三個添加水平的回收率在70.0%~108%之間,相對標準偏差(relative standard deviation,RSD)在1.3%~8.6%之間,符合GB/T 27404—2008《實驗室質量控制規范基本信息 食品理化檢測》中的相關要求。
2.2.6 雜糧豆類中真菌毒素的檢測
利用建立的方法對黑豆(12 份)、綠豆(13 份)、紅豆(12 份)共37 份樣品進行檢測,結果發現6 份樣品中檢出真菌毒素,陽性率為16.2%,所檢測到的真菌毒素均為ZEN殘留,其中綠豆樣品2 份、紅豆樣品4 份。
綠豆樣品中ZEN檢出陽性率為15.4%,平均含量3.4 μg/kg,該含量均低于谷物及其制品中規定的ZEN的限量值。紅豆樣品中ZEN檢出陽性率為33.3%,其中有兩份樣品含量較高,分別為270 μg/kg和764 μg/kg,超過國家標準中ZEN的限量值(60 μg/kg)4~12 倍,應當引起注意。
3 結 論
本實驗建立甲醇-水(70∶30,V/V)、乙腈-水(84∶16,V/V)兩種溶劑體系聯合提取,C18吸附劑凈化,高效液相色譜-串聯質譜同時檢測雜糧豆類中的11 種真菌毒素的方法。該方法簡單、快速、準確度高可用于真菌毒素的快速檢測。對雜糧豆類中真菌毒素檢測結果表明,該類食品中存在一定的安全隱患,希望相關部門給予重視、進行風險評估,制定相應的政策和措施,以保障餐桌上的食品安全。

