基于微滴式和芯片式數字PCR技術的轉基因克螟稻成分的定量檢測
鄧婷婷,黃文勝,葛毅強*,陳 穎,*
(1.中國農業大學食品科學與營養工程學院,北京 100083;2.中國檢驗檢疫科學研究院,北京 100176;3.科技部中國農村技術開發中心,北京 100045)
隨著轉基因作物種植面積的日益擴大和著轉基因食品飛速發展,許多國家都出臺轉基因標識標簽制度,歐盟、韓國及日本的轉基因標識閾值(質量分數)分別為0.9%、3.0%、5.0%[1-3],我國自2002年起實施《農業轉基因生物標識管理辦法》[4],明確規定在中國境內銷售農業部許可并列入標識的轉基因生物及其產品,必須進行轉基因成分的標識。隨著全世界標識制度的完善和定量標識制度的發展,建立轉基因產品的檢測技術尤其是精準定量檢測技術將越來越重要。
目前國內外針對轉基因成分定量分析最常用的方法是實時熒光聚合酶鏈式反應(polymerase chain reaction,PCR)法,該技術依靠不同濃度的標準樣品建立標準曲線對未知模板進行定量分析,已比較成熟地用于轉基因定值當中[5-8]。我國也發布了多項基于實時熒光PCR技術的轉基因作物定量檢測標準方法[9-10],其定量靈敏度在0.5%~0.1%之間。但是,實時熒光PCR技術用作定量時由于每次進行檢測操作都需同時進行已知濃度標準品的擴增并制作標準曲線,校準品和樣品間背景的不同及PCR擴增效率等因素都引入了偏差,導致其定量結果往往與實際值相差甚遠[11-12]。此外,低拷貝數的目標DNA分子很難通過擴增檢測到[13-15],因此在實際應用中局限性較多。
數字PCR是近年來發展起來的單分子DNA絕對定量檢測技術,通過對樣品DNA極度稀釋,對每個微反應單獨進行PCR擴增后采用終點法檢測PCR產物,并依據泊松分布原理對靶基因定量,在不需要標準樣品的情況下實現目標成分的絕對定量[16],有效避免了上述實時熒光PCR定量帶來的擴增反應抑制物、PCR擴增效率差異及標準曲線等帶來的定量偏差等問題,并可減少實時熒光PCR帶來的基體效應[17]。數字PCR具有測量獨立性與無需任何校準物的特點,也使得低豐度靶標分子的精準檢測成為可能[13,18-19]。由于數字PCR定量更加準確靈敏,目前已經逐漸應用到轉基因定量分析和低含量的轉基因成分檢測中。Fu Wei等[20]選取CaMV35s啟動子和NOS終止子作為篩選轉基因作物的通用元件,用數字PCR進行定量檢測,并對MON810等9 種轉基因品系進行特異性驗證,結果獲得檢測限為0.1%這一低于歐盟規定閾值的結果,表明該方法特異性好、靈敏度高,適于轉基因成分含量的精確定量。David等[21]利用微滴式數字PCR方法分別建立了兩個多重定量方法,可對12 個品系的轉基因玉米進行含量測定,其檢出限、重復性和真實性均符合國際標準中GMO定量要求。其他研究也表明與實時熒光PCR方法相比,數字PCR定量方法定量更加準確靈敏[22-24]。
本研究基于微滴式和芯片式數字PCR平臺,以抗蟲轉基因水稻品系克螟稻為研究對象,擬建立轉基因水稻的精準定量分析方法,并與傳統的實時熒光定量PCR結果進行比較,以期為食品和農產品中轉基因成分的定量分析提供新的方法和借鑒。
1 材料與方法
1.1 材料與試劑
轉基因水稻(Oryza sativa)LL62品系(大米樣品)、轉基因大豆(Glycine max)GTS40-3-2、轉基因玉米(Zea mays)Bt11等標準物質購于歐盟聯合研究中心標準物質與測量研究所及美國油脂化學家協會。各種含量的轉基因克螟稻、TT51-1、KF6等轉基因大米標準樣品及非轉基因大米(明恢63)、大豆、玉米、小麥,高粱,油菜等樣品由本實驗室保存。
ddPCR Super Mix(no dUTP)、ddPCR Droplet Generation Oil、ddPCR Droplet Reader Oil、Droplet Generator DG8 Cartridge 美國Bio-Rad公司;RealMaster Mix(with ROX) 美國ABI公司;食品基因組提取試劑盒NucleoSpin?Food 美國MN公司。
1.2 儀器與設備
QX200?微滴式數字PCR系統(包括微滴生成器、封膜機、PCR擴增儀和微滴讀取儀) 美國Bio-Rad公司;Bio-Mark?微流體芯片式數字PCR系統(含儀器配套耗材) 美國Fluidigm公司;QuantStudio? 3D微流體芯片式數字PCR系統(含儀器配套耗材) 美國Life Technologies公司;7500實時熒光PCR儀 美國ABI公司;樣品研磨機 德國IKA公司;離心機 美國Beckman Coulter公司;Qubit核酸蛋白分析儀 美國Thermo Scientific公司。
1.3 方法
1.3.1 基因組DNA提取
所有樣品材料放入樣品研磨機中,研磨至粒度60 目左右,樣品基因組DNA按照NucleoSpin?Food核酸提取試劑盒說明書提取,-20 ℃保存備用。
1.3.2 引物和探針的設計及合成
本實驗根據大米蔗糖磷酸合成酶(sucrose phosphate synthase,SPS)和轉基因克螟稻品系特異性基因序列,分別設計3 對引物探針(表1),用于篩選適用于數字PCR的引物探針組,相關序列及其標記由英濰捷基(上海)貿易有限公司合成。
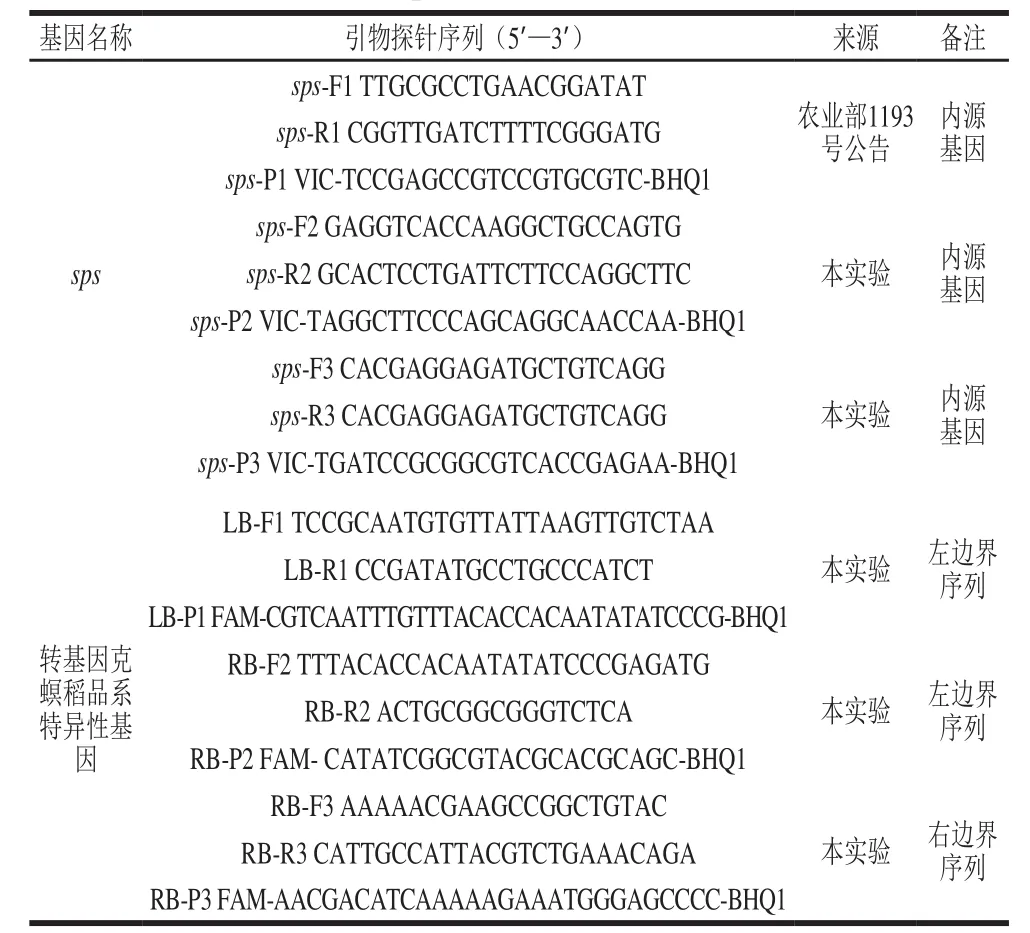
表 1 sps和克螟稻品系特異性基因引物探針序列Table 1 Sequences of primers and probes for used for PCR amplification of sps and KMD event-specific genes
1.3.3 擴增體系和反應參數
1.3.3.1 數字PCR擴增體系
分別向0.2 mL PCR管中加入2×ddPCR Super Mix(no dUTP)10 μL,終濃度為0.32 μmol/L的sps基因及克螟稻品系特異性基因正向引物和反向引物,0.12 μmol/L sps基因熒光標記探針,0.2 μmol/L克螟稻品系特異性基因熒光標記探針,1 μL DNA模板,利用ddH2O補齊至20 μL。
1.3.3.2 數字PCR擴增參數及數據分析
將配制好的數字PCR混合液,加入微反應體系生成裝置的加樣孔中生成微反應體系。將微反應體系放置于PCR擴增儀中,按以下參數進行PCR擴增:95 ℃、5 min(1 ℃/s),1 個循環;94 ℃、15 s,60 ℃、1 min(1 ℃/s),50 個循環;98 ℃、10 min(1 ℃/s),1 個循環;12 ℃保存反應產物。將擴增產物放入讀取儀中對微反應體系進行熒光檢測并計數。
1.3.3.3 實時熒光PCR擴增體系和參數
0.2 mL PCR反應管中加入2×Real Master Mix(with ROX)10 μL,終濃度為0.4 μmol/L的正向引物和反向引物、0.2 μmol/L的探針、1 μL DNA模板,利用ddH2O補齊至20 μL。
實時熒光PCR程序為:預變性95 ℃、10 min;95 ℃、10 s;60 ℃、45 s;45 個循環。
1.3.4 引物探針的篩選及其特異性
以常見轉基因作物品系和常見植物基因組DNA為模板,按上述反應條件對本研究各組引物探針的有效性和特異性進行測試。分別采用非轉基因大米明恢63和轉基因克螟稻品系大米樣品DNA為擴增模板,以ddH2O為空白對照,分別對3 組sps基因和克螟稻品系特異性基因的引物探針進行有效性擴增。隨后選取擴增效率最高的sps基因和克螟稻品系特異性基因引物探針組,利用非轉基因大米明恢63、轉基因大米TT51-1、KF6 、LL62品系、大豆、玉米、小麥、高粱、油菜、100%及1%轉基因克螟稻大米樣品、轉基因大豆GTS40-3-2、轉基因玉米Bt11為模板,驗證擴增效率最高的sps基因和克螟稻品系特異性基因引物探針組的特異性。
1.3.5 轉基因克螟稻定量體系的條件優化
利用Qubit核酸蛋白分析儀將質量分數為100%的轉基因克螟稻DNA溶液定量到質量濃度20 ng/μL,并按6 倍梯度稀釋后分別加入4 μL DNA溶液至內源基因sps的微滴式數字PCR擴增體系中,每個梯度3 次重復進行定量實驗,通過計算每個梯度3 次重復的相對標準偏差(relative standard deviation,RSD),判斷轉基因克螟稻定量體系中最適DNA模板添加量。
以質量分數為100%的轉基因克螟稻大米樣品為模板,分別考察擴增退火溫度和單雙重微滴式數字PCR等擴增條件對定量結果的影響。將微滴式數字PCR擴增參數中的退火溫度分別設為58、60、62 ℃和64 ℃,每個梯度3 次重復進行定量實驗,按1.3.3節所述方法計算最終的克螟稻轉基因成分含量。根據優化好的條件,分別比較sps基因和克螟稻品系特異性基因分開擴增的兩個單重微滴式數字PCR體系與兩個基因合并后的雙重微滴式數字PCR體系擴增5 次重復結果的差異。
1.3.6 轉基因克螟稻定量方法在芯片式數字PCR平臺上的適用性
分別在微流體芯片式數字PCR平臺Bio-Mark?和QuantStudio? 3D對已建立的基于微滴式數字PCR平臺的轉基因克螟稻成分定量檢測方法進行驗證。利用已優化的雙重數字PCR條件,將質量分數為100%的轉基因克螟稻標準樣品分別在Bio-Mark?和QuantStudio? 3D微流體芯片式數字PCR平臺上進行擴增,實時監測其擴增曲線,以確保每個微滴/微孔均能有效擴增,針對擴增微反應體系的分布情況等逐一進行分析。
1.3.7 轉基因克螟稻定量的絕對靈敏度和線性范圍
利用Qubit核酸蛋白分析儀測定轉基因克螟稻大米DNA溶液濃度后按2 倍梯度稀釋,分別稀釋至1.5 pg及0.5 pg,即內外源基因的濃度均為1 copies/μL(大米單拷貝基因組質量約為0.5 pg[25])。共稀釋4 個梯度,每個梯度3 個重復實驗,按1.3.3節進行微滴式數字PCR擴增,分別檢測其內源基因sps和克螟稻品系特異性基因的拷貝數,根據內外源基因的理論值和實際值繪制相關性曲線。
1.3.8 數字PCR與實時熒光PCR對不同含量轉基因克螟稻的測定
利用上述實驗建立的雙重數字PCR定量體系,分別在QX200?微滴式數字PCR平臺和QuantStudio? 3D微流體芯片式數字PCR平臺上對質量分數為0.1%、1%、5%的轉基因克螟稻樣品的進行定量分析,每個樣品3 次重復定量實驗,根據儀器自動給出的內外源基因拷貝數濃度,計算二者之比即為樣品中的轉基因克螟稻含量。
根據1.3.3節的實時熒光PCR擴增體系和參數,利用已知質量分數為100%、10%、5%、0.5%及0.1%的轉基因克螟稻樣品進行實時熒光PCR擴增,基于擴增Ct值制作內外源基因的標準曲線,并將0.1%、1%、5%轉基因克螟稻樣品內外源基因Ct值代入標準曲線中,對這3 個含量的樣品進行定量,將其結果與微滴式及芯片式數字PCR定量結果比較研究。
1.4 數據分析
數字PCR擴增結束后,每個基因熒光本底值與陽性值之間差異較大,即陰陽性擴增熱點之間界限分明且陽性擴增熱點較為集中,即可判定為擴增結果良好,擴增圖像可直接用作實驗結果。
由于數字PCR是絕對定量技術,無需標準曲線即可直接測得樣中的內外源基因絕對含量。因此,數字PCR讀取儀逐一對每個微反應擴增產物進行計數分析后,根據泊松分布原理計算得到sps和克螟稻品系特異性基因的拷貝數濃度(copies/μL)。而本研究采用的sps和克螟稻品系特異性基因均為單拷貝基因,按下式計算樣品中轉基因克螟稻定量結果[26-27]:

2 結果與分析
2.1 引物探針篩選
通過采用實時熒光PCR方法對已設計合成的內外源基因引物探針進行篩選,結果表明所有引物探針均能有效擴增出靶基因,但sps基因引物探針組F2/R2/P2和克螟稻品系特異性基因引物探針組LB-F1/R1/P1信號最強(圖1)。為保證后續數字PCR能到達最大效率,本研究選取sps-F2/R2/P2和LB-F1/R1/P1兩組引物探針,用于轉基因克螟稻的內外源基因定量。
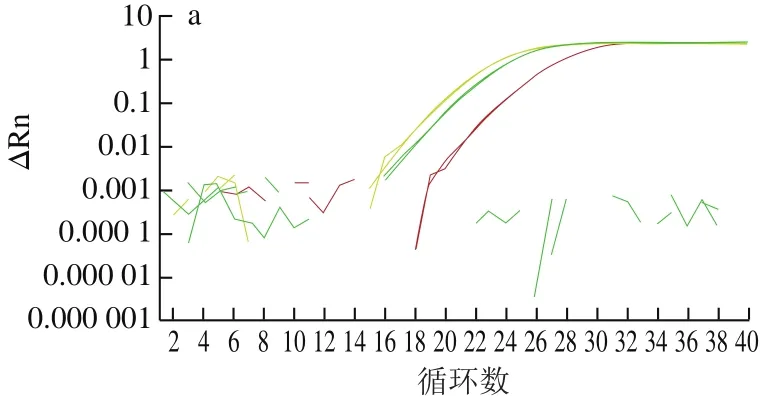
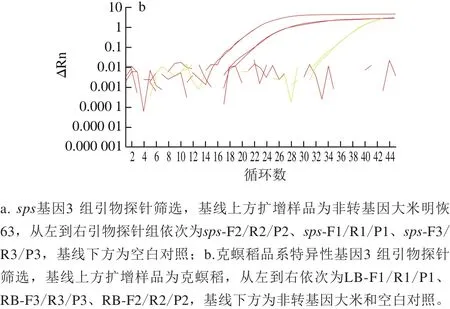
圖 1 sps及克螟稻品系特異性基因的引物探針篩選結果Fig. 1 Effectiveness of the primers and probes in amplifying sps and KMD event-specific genes
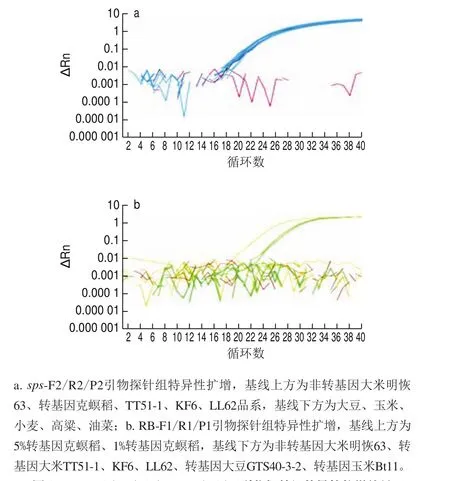
圖 2 sps- F2/R2/P2及LB-F1/R1/P1引物探針組特異性擴增結果Fig. 2 Specificity of the primers and probes in amplifying sps and KMD event-specific genes
以利用非轉基因大米、常見轉基因大米、大豆及玉米品系及常見作物基因組為模板,對sps-F2/R2/P2和LB-F1/R1/P1兩組引物探針的特異性進行分析。sps-F2/R2/P2引物探針組僅能擴增出大米成分(含非轉基因大米明恢63、轉基因大米TT51-1、KF6、LL62品系),對其他禾本科植物玉米、小麥、高粱及大豆、油菜等作物均無擴增。LB-F1/R1/P1引物探針組僅能擴增出克螟稻轉基因成分,對其他轉基因大米品系和其他轉基因作物均無擴增(圖2)。表明這兩組引物探針特異性較好。
2.2 轉基因克螟稻微滴式數字PCR定量體系的條件優化
當加入數字PCR擴增體系中的克螟稻大米樣品DNA量從20 ng/μL按6 倍稀釋6 個梯度后,20 μL擴增體系中DNA量在10 pg~80 ng之間時,目標基因的理論拷貝數濃度約為8 000、1 333、222、37、6、1 copies/μL。當其含量高達8 000 copies/μL即擴增體系中DNA濃度高達80 ng時,6 次重復的RSD高于25%,而其余幾個濃度梯度,即使DNA含量低至1 copies/μL,6 次重復的RSD仍低于25%(表2),即本研究中克螟稻定量體系中最適DNA添加量在10 pg~13 ng之間。
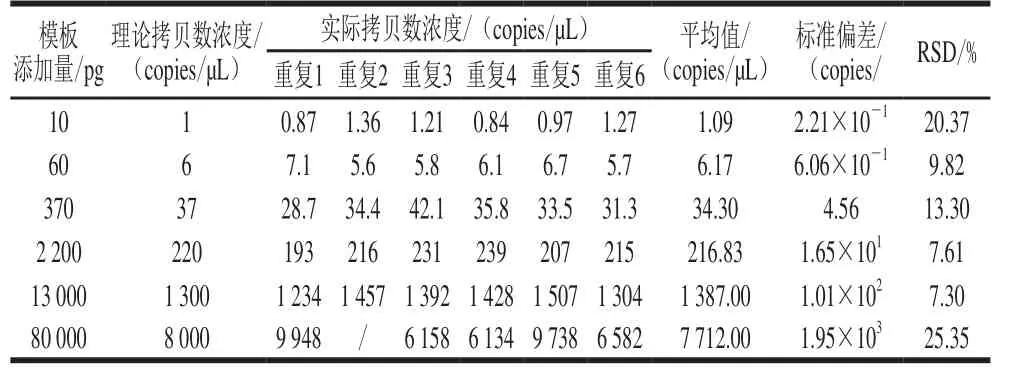
表 2 克螟稻定量體系模板優化Table 2 Optimization of genomic DNA concentration in the quantitative system
當數字PCR擴增退火溫度分別為58、60、62 ℃和64 ℃時,質量分數為100%的克螟稻轉基因相對含量分別為99.29%、100.36%、100.43%、97.39%,所有擴增樣品均能有效區分陰性和陽性微滴點(圖3)。雖然當退火溫度為60 ℃時偏差最小,但統計學分析顯示這4 組數據無顯著性差異(P>0.05),即退火溫度在58~64 ℃之間時,對定量結果無顯著性影響。

圖 3 克螟稻定量體系PCR退火溫度優化Fig. 3 Optimization of annealing temperature for GM rice KMD in digital PCR
以質量分數為100%的轉基因克螟稻大米樣品為模板,根據優化條件,在模板含量為10 ng DNA,退火溫度為60 ℃時,比較分開擴增sps基因和克螟稻品系特異性基因的兩個單重數字PCR體系與兩個基因合并后的雙重數字PCR擴增體系定量結果。單重擴增后定量得到的克螟稻轉基因相對含量均值為100.11%,RSD為1.74%(圖4a),而雙重體系的相對含量均值為99.93%,RSD為3.59%(圖4b)。兩種方法定量偏差及多次重復的RSD均遠小于25%,符合目前國際最嚴格的國際標準和歐盟定量方法要求[28-29],即兩種方法均適用于克螟稻大米樣品的定量。為節約試劑和時間成本,后續實驗中,均采用雙重數字PCR擴增體系進行研究。
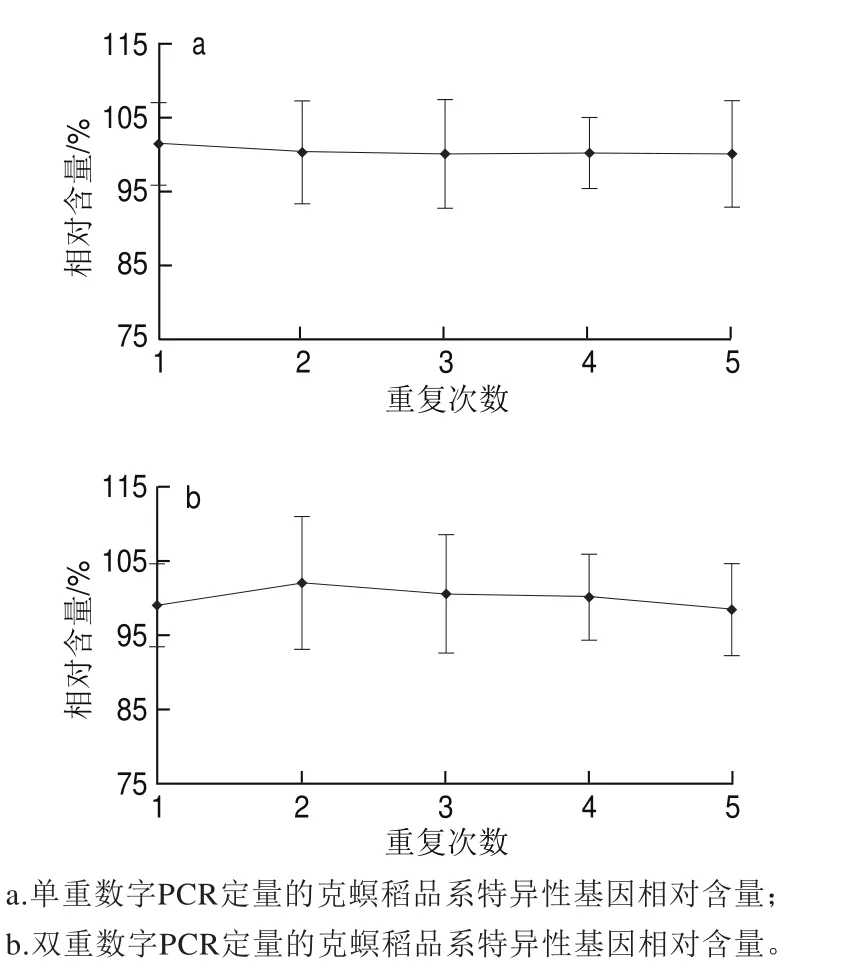
圖 4 單重數字PCR與雙重數字PCR擴增結果比較Fig. 4 Comparison of amplification results between singplex and duplex digital PCR
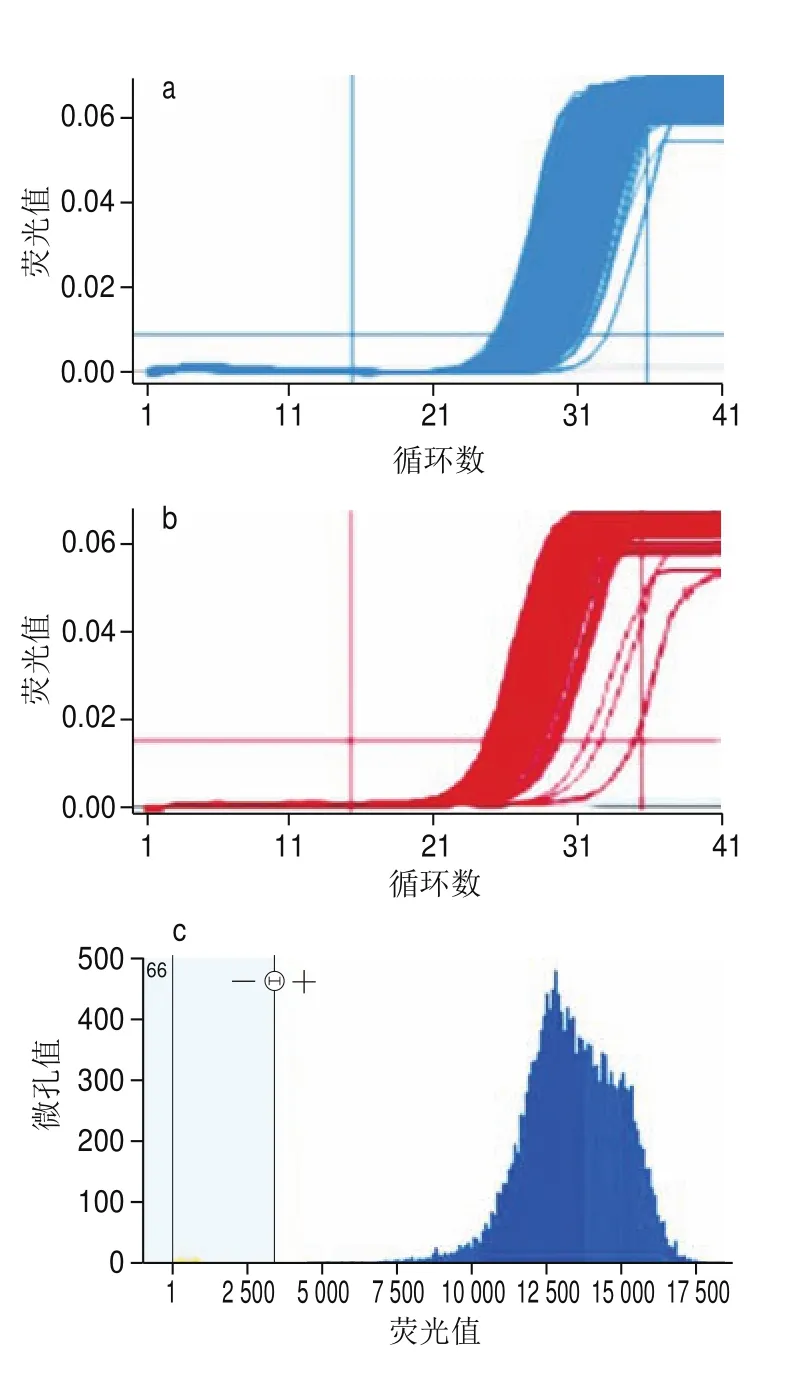

圖 5 100%克螟稻轉基因大米在芯片式數字PCR平臺上擴增Fig. 5 Amplification of KMD GM rice genes on the chip-based digital PCR platform
轉基因克螟稻定量方法在芯片式數字PCR平臺上的適用性利用已優化的微滴式數字PCR擴增條件,分別將質量分數為100%的克螟稻大米樣品在微流體芯片式數字PCR平臺Bio-Mark?和QuantStudio? 3D上進行擴增,分別得到其內源基因與外源基因的實時擴增曲線(圖5)。Bio-Mark?數字PCR平臺上內外源基因各自的765 個反應倉Ct值均較為集中,表明所有微孔均得到了較好的擴增,這也使得定量結果準確可靠(圖5a、b),相對含量為103.26%,3 次重復的RSD僅為1.7%,定量準確性和精密度均較為理想。QuantStudio? 3D微流體芯片式數字PCR平臺對質量分數為100%的標準樣品進行芯片式數字PCR定量檢測時,內外源基因所產生的陰性點和陽性點分離較好,無中間模糊區(圖5c、d),相對含量為99.43%,3 次重復的RSD僅為1.7%。表明本研究所建立的微滴式數字PCR定量方法在其他微流控芯片式數字PCR平臺上也能正常擴增,本方法適用性較好。
2.3 轉基因克螟稻定量絕對靈敏度和線性范圍
將克螟稻轉基因大米DNA溶液按多倍梯度稀釋時,在1~1 000 copies/μL的整個稀釋梯度中,sps與克螟稻品系特異性基因RSD分別在0.63%~2.62%和0.96%~3.62%之間,所有稀釋梯度的RSD均符合國際要求[29]。其內外源基因稀釋梯度理論值和實際值線性相關,R2分別為1和0.999 8。該體系所檢測的濃度梯度均具有很好的線性關系,并且與理論拷貝數相符,該檢測體系能夠對含量低至1 copies/μL的轉基因克螟稻進行準確定量。
2.4 轉基因克螟稻數字PCR定量結果與實時熒光PCR方法定量結果比較
運用已建立的數字PCR方法,分別在QX200?微滴式數字PCR平臺、QuantStudio? 3D微流體芯片式數字PCR平臺及實時熒光PCR平臺上定量分析轉基因質量分數為0.1%、1%、5%的克螟稻轉基因大米樣品,將三者結果進行比較分析。所有平臺定量結果的3 次重復RSD均小于25%,表明所有操作重復性較好。微滴式和芯片式數字PCR平臺上3 個梯度轉基因大米樣品定量偏差在-0.204%~7.203%之間(表3),即使是針對質量分數為0.1%的克螟稻轉基因大米樣品,該方法在不同平臺上的定量結果精密度和準確性仍然符合要求。表明本研究建立的數字PCR方法對克螟稻的定量檢測靈敏度可達0.1%。
利用實時熒光PCR方法對質量分數同樣為0.1%、1%、5%克螟稻樣品進行定量時,內外源基因的實時熒光PCR擴增效率分別為107.34%和99.62%,符合90%~110%的范圍[30]且內外源基因的標準曲線R2都達到0.99以上。根據各組數據RSD可知,本研究中實時熒光PCR的實驗操作重復性較好,且內外源基因PCR擴增效率及標準曲線相關性也符合要求,而3 個梯度轉基因大米樣品的定量值其與實際值偏差分別為29.942%、25.426%及-6.738%(表3),遠大于微滴式及芯片式數字PCR的偏差,尤其是0.1%和1%的克螟稻樣品定量偏差均已超過目前國際通用的定量方法要求[29]。而數字PCR即使針對質量分數為0.1%的樣品,其偏差最大也僅為7.203%,符合轉基因定量中偏差在25%以內的要求[28-29]。因此,數字PCR的定量準確性及靈敏度要好于實時熒光PCR,尤其是針對低含量的克螟稻成分進行定量時,數字PCR的結果更為可靠。
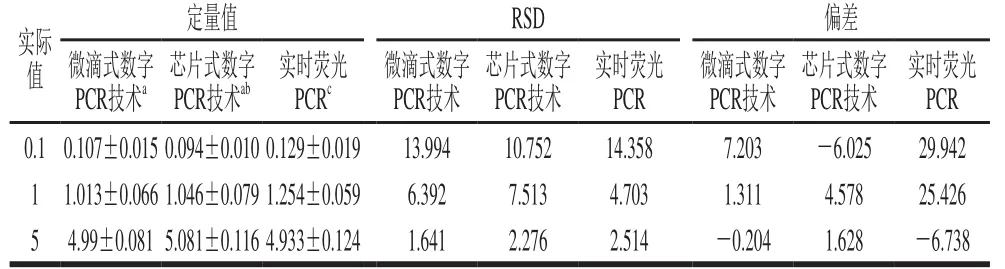
表 3 不同含量的克螟稻數字PCR及實時熒光PCR定量檢測結果Table 3 Quantitative results of different contents of KMD GM rice by digital PCR and real-time PCR%
3 討論與結論
雖然數字PCR技術將DNA模板進行稀釋分布到大量的獨立反應室中進行單獨擴增,極大降低了反應間的相互抑制,提高了反應效率,但也有研究表明DNA純化方法等條件優化措施會對定量結果產生較大的影響[24,31]。因此本研究對最能影響克螟稻定量反應體系的因素如模板濃度、退火溫度及單雙重反應的差異等情況均進行研究,建立適用于克螟稻品系特異性轉基因成分定量的最優條件。還有研究表明模板DNA的片段長度會影響模板的均勻分布,進而影響定量結果[11],本研究分析隨機酶切、超聲等方式斷裂大米基因組DNA對數字PCR定量結果的影響,發現當DNA濃度在合適范圍內時,各種處理后的定量結果與對照相比,其差別無統計學意義(數據未列出),即大米基因組DNA無需斷裂處理也可得到較為理想的定量結果。但此結果僅適用于克螟稻等轉基因大米品系的定量研究,對于其他轉基因作物,尤其是小麥等基因組較大的作物,在對樣品精準定量前還需對數字PCR的各種條件逐一進行優化。
在轉基因定量中考慮測量值的不確定度很有必要,由于對一些影響因素缺少定量描述,因此在轉基因成分定量檢測的不確定度分析方面還沒有一個通行的成熟方法,歐盟聯合研究中心推薦采用循環實驗結果進行某一轉基因定量方法的不確定度評估[32],在缺乏循環實驗數據時,可以利用現有數據依據國家計量技術規范[33]和文獻[30,34]方法對定量的不確定度進行分析。由于數字PCR無需標準曲線對樣品進行定量,由標準物質均勻性、穩定性、稀釋梯度及標準曲線等因素帶來的不確定度均無需考慮,這也是利用實時熒光PCR定量檢測轉基因成分時最能影響不確定度的部分[35]。此外,數字PCR為終點讀取,PCR擴增效率的不確定度理論上也可排除在外。因此除取樣的不確定度之外,僅需考慮稀釋梯度、批內重復、儀器示值等的不確定度即可。
轉基因含量通常以質量、體積或者單位個數(顆粒、DNA以及蛋白分子等)的形式描述純的轉基因成分的質量與相應成分的總質量之比。數字PCR是通過絕對定量方法測定目的基因在樣本中的拷貝數,通過內外源基因的拷貝數之比得到轉基因成分的含量。在目標基因為單拷貝插入的轉基因品系中,所得內外源基因拷貝數之比即為轉基因含量百分比。若目標基因為多拷貝插入或樣本為親本雜交后代,該比值作為相對定量結果將不夠準確,需作進一步換算。對于定量中的內源基因,首先要選擇低拷貝且拷貝數可穩定遺傳的基因,由于單拷貝基因相對于多拷貝基因來說更加穩定,在不同作物栽培種中的突變率更低[36],更加適合用作轉基因成分定量中的內源基因。而轉基因定量分析中的外源基因選擇時,單拷貝的特異邊界序列是首選,尤其是當檢測樣品為混合產品時,對每一品系分別進行定量,得到的轉基因成分含量比利用某一外源篩選元件進行定量得到的結果要更為準確。但也有研究指出以多拷貝基因為對象的檢測由于原始材料中基因的拷貝數高使得檢測靈敏度更高[37]。本研究中大米內源基因sps和克螟稻品系特異性基因均為穩定遺傳的單拷貝基因,因此內外源基因拷貝數之比可直接轉換為克螟稻轉基因成分含量。
轉基因標識制度的有效實施依賴于科學可靠的轉基因定量檢測方法。本研究結果表明,基于數字PCR的定量方法可準確檢測樣品中的從0.1%~100%質量分數的克螟稻轉基因大米成分,尤其是在對低含量克螟稻轉基因大米成分的定量中,方法的精密度和準確性均高于目前常用的實時熒光PCR方法,可以滿足轉基因標識需求,也為我國轉基因產品標識閾值的設定提供了一定的借鑒依據。

