質粒DNA轉染人PBMC電穿孔條件的影響因素
孔明圣,于洋,張亞倩,李玲,張文峰,邵紅偉
(廣東藥科大學生命科學與生物制藥學院,廣東省生物技術候選藥物研究重點實驗室,廣東 廣州 510006)
在有關基因功能的研究中將目標基因導入受體細胞的效率高低對研究結果至關重要,電穿孔是基因傳輸常用的方法之一,相對于病毒傳輸系統和其他轉染方法,電穿孔具有方便高效,不引入額外的轉染介質,潛在副作用更低,適合各類細胞系,原代細胞和干細胞,包括一些常規方法難以轉染的細胞,并且已廣泛用于體外和體內各種應用,包括基因治療,傷口愈合和藥物篩選等[1-4]。
隨著嵌合抗原受體修飾T細胞(CAR-T)、T細胞抗原受體(T Cell Receptor, TCR)修飾T細胞(TCR-T)等基于免疫細胞的抗腫瘤研究以及基于免疫細胞基因組編輯技術的廣泛應用,目前對于T淋巴細胞等免疫細胞的基因修飾研究越來越多[5-8]。而作為原代細胞,免疫細胞尤其是淋巴細胞的基因傳輸效率一直是制約相關研究的重要因素。本研究通過摸索各種可能會導致電穿孔轉染效率和細胞存活率的因素,對質粒轉染人PBMC的電穿孔方法進行了較為詳細的分析與探索,為基于淋巴細胞的相關基礎研究以及臨床應用提供了有益的參考。本研究分析了電穿孔電壓、脈沖時間、電轉緩沖液、細胞培養狀態,質粒質量對轉染效率和細胞活率的影響。
1 材料與方法
1.1 材料與試劑
質粒pCMV-GFP(日本NEPA GENE,4 700 bp);質粒pDC315-GFP(本實驗室構建,4 700 bp);質粒pcDNA3.1-GFP(本實驗室構建,7 200 bp);質粒pMax-E2F1(3 500 bp)、pEB-3xflag-GFP(8 300 bp)、px458_2A_GFP(9 300 bp)均購自Addgene;人外周血(來自本實驗室志愿者);DMEM培養基、Fetal Bovine Serum、PBS pH7.2 basic(1×)、Opti-MEM、Penicillin streptomycin、RPMI-1640培養基、X-VIVO無血清培養基均購自GIBCO;QIAGEN Plasmid Plus Midi Kit(25)(QIAGEN);Toxin SensorTM內毒素檢測系統(金斯瑞生物科技)。
1.2 主要儀器
NEPA21 高效基因轉染系統(日本NEPA GENE);OLYMPUS IX51倒置熒光顯微鏡(奧林巴斯); NANODROP 2000超微量分光光度計(Gene Company Limited);GALLIOSTM流式細胞分析儀(BECKMAN COULTER);VARIOSKAN FLASH全波長光譜掃描儀(THERMO SCIENTIFIC);JS-680D全自動數碼凝膠成像分析系統(上海培清科技有限公司);JS-2012細胞培養箱(THERMO SCIENTIFIC)。
1.3 方法
1.3.1 PBMC的制備 利用真空采血管抽取本實驗室志愿者30 mL左右靜脈血,使用淋巴細胞分離液分離PBMC。PBMC的活化培養:第1天,用無血清培養基調整細胞濃度至1~2×106/mL,加入重組人IFN-γ(1 000 U/mL);第2天,加入OKT-3(50 ng/mL)和重組人IL-2(300 U/mL);第3天細胞換液,補充重組人IL-2(300 U/mL);之后根據細胞密度每3天半量換液或細胞傳代1次,并補加重組人IL-2(300 U/mL)。
1.3.2 Nanodrop2000測定質粒濃度 按照Nanodrop 2000儀器測量范圍(2~15 000 ng/μL),將高濃度抽提質粒用超純水稀釋至40~50 ng/μL(電泳圖計算值),每次取1 μL測量,每個樣品測3次,取平均值。
1.3.3 全波長光譜掃描測定質粒純度 將質粒用超純水稀釋至約50 ng/μL,取100 μL稀釋后質粒加入到96孔微孔板中,設置掃描區間為200~400 nm進行1 nm步進的光譜掃描。
1.3.4 質粒的內毒素含量測定 將質粒稀釋至約5 ng/μL,使用Toxin SensorTM內毒素檢測系統對質粒的內毒素含量進行測定,詳細檢測方法見試劑盒說明書,檢測范圍為0.01~1 EU/mL。
1.3.5 質粒電穿孔轉染條件的設置 將PBMC用生理鹽水洗滌后計數,再用電轉緩沖液洗滌1遍后調整細胞密度為2×107/mL,加入質粒10 μg/組。根據預實驗結果以及廠家推薦電轉的電壓和脈沖時間參數,按照表1共設置了8組電穿孔條件,對未經培養刺激的PBMC進行電轉。轉染前,提前加入1 mL含 IL-2(300 U/mL)的X-VIVO無血清培養基于24孔板中,將孔板置于培養箱中37 ℃孵育15 min,電轉完成后盡快將細胞吸回培養瓶中,置于37 ℃,5%(φ)CO2細胞培養箱中培養。
1.3.6 PI染色及流式檢測 將10×Annexin-binding buffer 用超純水稀釋10倍,將細胞懸液收集到1.5 mL EP管中,離心去上清,加入100 μL/組稀釋好的1×Annexin-binding buffer,吹打均勻后加入5 μL /組PI染色劑,避光孵育15 min。加入500 μL 1×Annexin-binding buffer后,轉移至流式管中,上機檢測。

表1 電穿孔條件Table 1 Electroporation conditions
注:+.根據推薦參數設置的測試組; -.未測試。
1.4 統計學處理
采用IBM SPSS Statistics 22統計軟件進行統計學處理,以P<0.05為差異有統計學意義。為解決多組數據兩兩之間相似性強弱關系,采用Pearson相關分析,相關系數r大于絕對值0.8為極強相關。
2 結果
2.1 電壓與脈沖時間的優化
首先對電壓和脈沖時間進行了摸索(圖1)。根據廠家推薦方案,設置細胞密度為2×107/mL。質粒為NEPA公司提供的陽性質粒pCMV-GFP(4 700 bp),用量為10 μg/組,電轉緩沖液為Opti-MEM。按照設計的電壓和脈沖時間分別進行電擊,轉染24 h后,進行熒光拍照和流式分析。從圖1A中可以看出,在脈沖時間設定為5 ms的前提下,從150~225 V中,細胞轉染效率隨著電壓增加而增加,至275 V后轉染效率明顯下降。細胞凋亡率則是一直隨著電壓增加而增加。電壓在達到275 V后,由于細胞凋亡率的增加,導致了轉染效率的快速下降。圖1B中可以看出,在電壓設定為200 V的條件下,細胞轉染率在0.5~3 ms區間水平較低,檢測不到熒光表達,而至5 ms,轉染效率明顯提高。細胞凋亡率在脈沖時間為0.5~3 ms之間是隨著時間增加而增加的,而到了5 ms的時候,凋亡率反而比3 ms更低。說明尋找一個凋亡率較低同時轉染效率較高的脈沖時間是可行的。綜合考慮轉染效率和細胞凋亡率,在保證更好的細胞狀態下,選擇200 V,5 ms作為后續實驗的電擊方案。
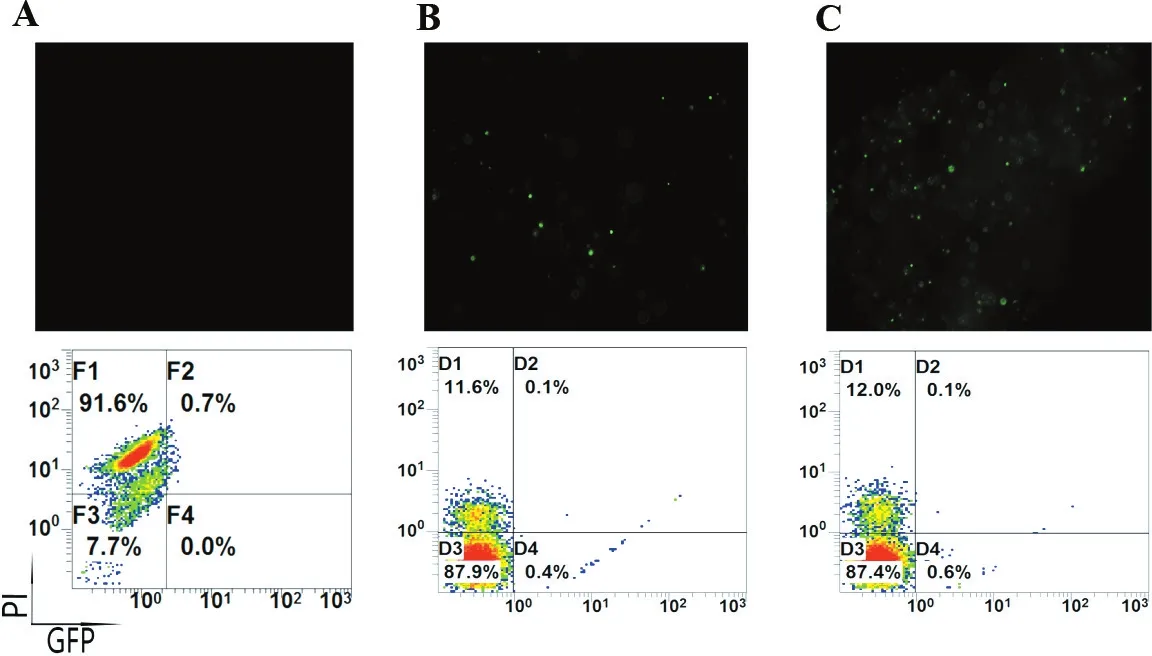
2.2 緩沖液對電穿孔效率的影響
比較了PBS,RPMI-1640和Opti-MEM 3種不同的緩沖液對電穿孔效率的影響(圖2),可以看出,在轉染效率上Opti-MEM>RPMI-1640>PBS;在細胞存活率上,Opti-MEM與1640比較接近,但兩者都顯著優于PBS組。PBS組細胞狀態極差,轉染熒光效率也極低,說明適合的電轉緩沖液對電穿孔是非常重要。
A.比較150~275 V范圍電壓對電轉PBMC的影響; B.比較0.5~5 ms范圍脈沖時間對電轉PBMC的影響。
圖1不同的電壓和脈沖時間對人PBMC轉染效率以及凋亡率的影響
Figure1Effect of different voltages and pulse times on human PBMC transfection efficiency and apoptotic rate
2.3 細胞狀態對電穿孔效率的影響
由于細胞的不同生理狀態能夠顯著影響轉染效率,對活化和靜息狀態的PBMC分別進行了電穿孔轉染實驗。從圖3可以看出,不同的細胞狀態下電穿孔的轉染效率和細胞凋亡率有顯著區別。活化培養7 d后,細胞處于增殖狀態,其轉染效率與靜息狀態的PBMC相比有明顯增加,不過隨之而來的是細胞凋亡率也顯著增加。
2.4 質粒因素對電穿孔效率的影響
2.4.1 質粒的分子量對電穿孔效率的影響
為了比較不同分子量大小的質粒對PBMC電穿孔轉染效率和細胞凋亡率的影響,選擇了5種攜帶GFP標記的常用質粒,分別是px458_2A_GFP(9 300 bp)、pEB-3xflag-GFP(8 300 bp)、pcDNA3.1-GFP(7 200 bp)、pCMV-GFP(4 700 bp)、pMax-E2F1(3 500 bp)(圖4)。對于PBMC電穿孔結果,只有觀測到分子量比較小的pMax-E2F1組和pCMV-GFP組有熒光,前者的熒光率顯著高于后者;而當質粒大小≥7 200 bp后并沒有觀測到熒光;從圖中也可以看出質粒越大,細胞的凋亡率也隨之增大,表明質粒大小會顯著影響電穿孔的效率,同時質粒自身的性質也會影響熒光率。
A. PBS緩沖液組; B. 1640 組; C. Opti-mem組。
圖2不同緩沖液對PBMC電轉轉染效率和細胞凋亡的影響
Figure2Effect of different buffers on PBMC electroporation efficiency and apoptosis
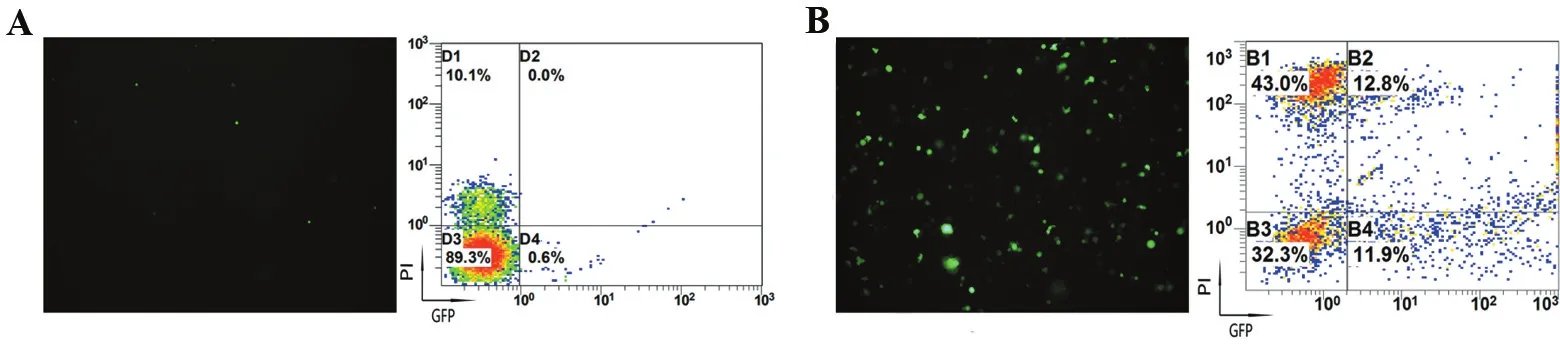
A.新鮮分離的未活化PBMC組; B.經細胞因子刺激PBMC組。
圖3不同的細胞狀態對電轉效率和細胞凋亡率的影響
Figure3Effect of different cell states on electrotransfer efficiency and apoptotic rate
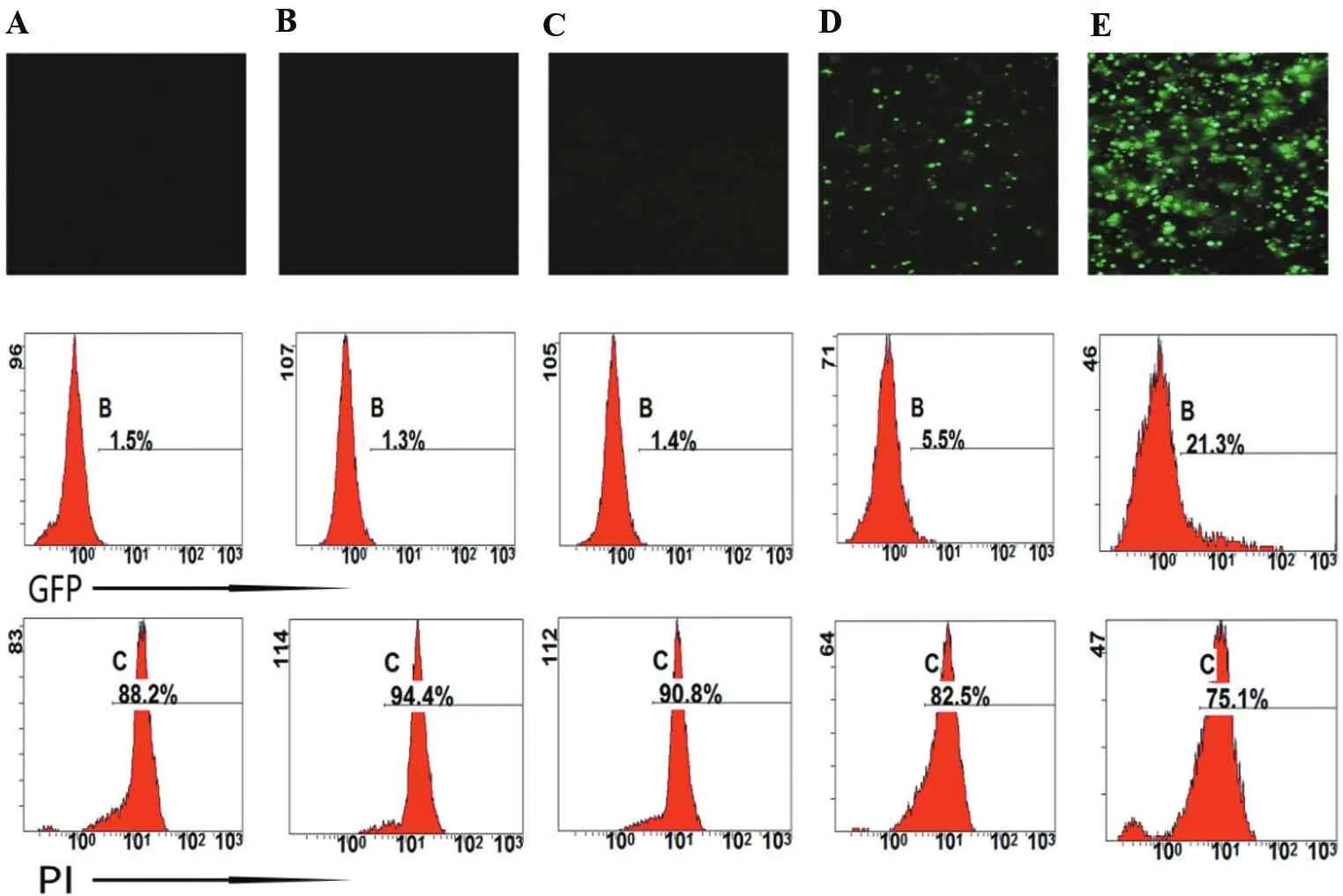
A. px458_2A_GFP(9 300 bp); B. pEB-3xflag-GFP(8 300 bp); C. pcDNA3.1-GFP(7 200 bp); D. pCMV-GFP(4 700 bp);E. pMax-E2F1(3 500 bp)。
圖4質粒的分子量對電穿孔效率的影響
Figure4Effect of the molecular weight of plasmid on electroporation efficiency
2.4.2 質粒的純度對電穿孔效率的影響
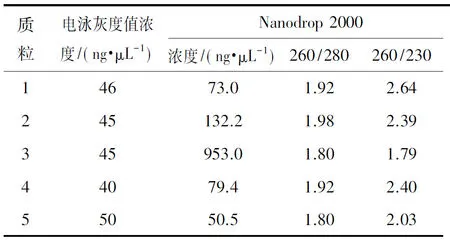
從圖5的A和B中可以看出,不同方法提取的質粒其不同構象分子所占的比例差異較大,利用Nanodrop 2000檢測各質粒的濃度,結果顯示個別質粒所測濃度與根據電泳圖灰度值所估算的濃度差異較大(表2),與之相對應的260/230比值也偏小。從這一結果推測可能其中含有雜質,利用Nanodrop 2000對各質粒進行全波長掃描,可以看出每組質粒吸收峰圖無顯著區別(圖5C)。隨后利用全波長酶標儀對質粒進行光譜掃描分析(圖5D),可以看出各組質粒在200~220 nm之間的吸收光譜圖存在較大差異,3號質粒在此處的波動變化最大,顯示存在較多的短波長光吸收雜質,且在260~280nm之間的峰型也比較粗糙,顯示雜質種類較多,這也在一定程度上解釋了利用不同方法估算出的該質粒的濃度差異較大的原因。此外還對各組質粒的內毒素含量進行了測定(圖5E),可以看出不同方法提取的質粒在內毒素含量上也存在較大差異。為了探討不同方法所提質粒對PBMC電穿孔效率的影響(圖5F),利用上述優化的電壓和脈沖時間對PBMC進行了電穿孔轉染。轉染24 h后,從圖中可以看出,只有1號質粒有明顯的轉染熒光,且細胞的存活率也是比較高的說明質粒純度對于電穿孔轉染效率和電轉細胞的存活尤為重要。

A.質粒電泳圖(M:1 kb DNA Marker); B.質粒超螺旋比例; C. Nanodrop2000超微量分光光度計質粒DNA檢測峰圖; D.全波長酶標儀光譜掃描; E.質粒內毒素含量檢測; F.質粒轉染PBMC細胞轉染效率和細胞凋亡率分析。
1. qiagen-pCMV-GFP; 2.國產試劑盒-pCMV-GFP; 3.傳統堿裂解法-pCMV-GFP; 4.qiagen-pDC315-GFP; 5.國產試劑盒-pDC315-GFP。
圖5質粒的純度檢測以及不同純度質粒對電穿孔效率的影響
Figure5Detection of plasmid purity and effect of plasmid on electroporation
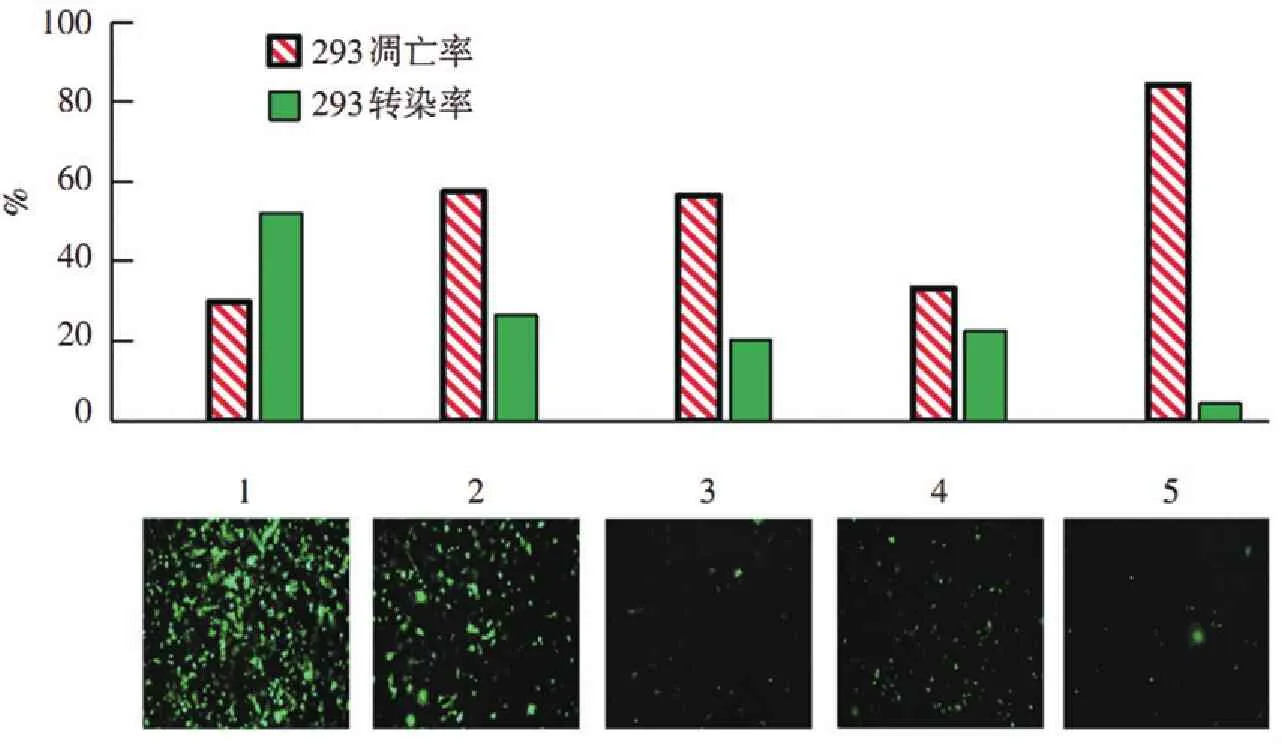
為了更好地顯示各組質粒在電穿孔轉染方面的差異,以HEK-293細胞作為對照組進行了轉染實驗(圖6)。從圖中可以看出1~5號質粒的轉染效率分別為52%,26.5%,20.3%,22.6%,4.3%。1號和4號存活率都在65%以上,而2、3、5號組的存活率都在43%以下。
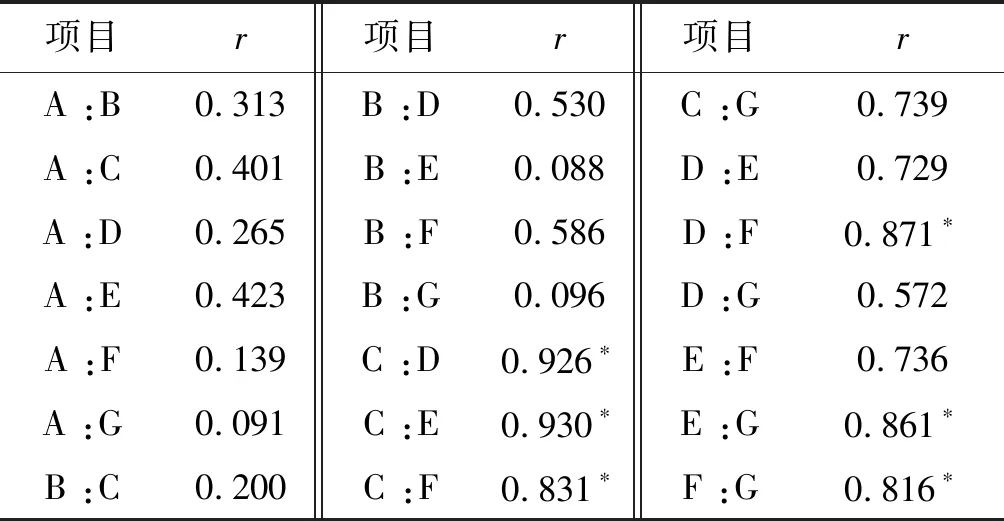
為了更好地挖掘影響電穿孔效率的信息,對所有質粒純度相關指標和轉染情況進行量化,包括以下變量:質粒超螺旋比例、質粒Nanodrop檢測濃度值、內毒素含量、細胞轉染效率,細胞凋亡率,使用SPSS統計學分析軟件,對各個變量之間進行相關性分析以及其相關性的顯著性檢驗(表3)。發現內毒素含量與細胞轉染率、細胞凋亡率具有極強相關性(r>0.83)。
表2質粒的電泳灰度值濃度和Nanodrop2000儀器檢測分析
Table2Multivariate two-way correlation analysis of plasmid factor influencing electrical transition
注:260/280、260/230為儀器檢測質粒純度的相關指標。
1. qiagen-pCMV-GFP; 2.國產試劑盒-pCMV-GFP; 3.傳統堿裂解法-pCMV-GFP; 4. qiagen-pDC315-GFP; 5.國產試劑盒-pDC315-GFP。
圖6質粒純度對293細胞系電穿孔效率和細胞活性的影響
Figure6Effect of plasmid purity on electroporation of 293 cell line in control group and transfection analysis
表3質粒因素對電轉影響多因素兩兩相關性分析
Table3Correlation analysis of the influence of plasmid factors on electrotransformation
項目r項目r項目rA :B0.313B :D0.530C :G0.739A :C0.401B :E0.088D :E0.729A :D0.265B :F0.586D :F0.871?A :E0.423B :G0.096D :G0.572A :F0.139C :D0.926?E :F0.736A :G0.091C :E0.930?E :G0.861?B :C0.200C :F0.831?F :G0.816?
注:A. Nanodrop2000質粒濃度值; B.質粒超螺旋比例; C.內毒素含量; D. PBMC轉染效率; E. PBMC凋亡率; F. HEK-293轉染效率; G. HEK-293凋亡率;*P<0.05
3 討論
在非病毒傳輸系統中,能夠有效地對淋巴細胞進行基因轉染的方法當首推電穿孔技術,在樣品制備、實驗周期、便捷程度等方面,電穿孔都具有顯著的優勢。然而,諸多的因素,如電壓、電擊時間、細胞狀態、電轉緩沖液、質粒的純度、大小等都會影響到電穿孔的轉染效率,這極大限制了電穿孔轉染的應用[9]。原代淋巴細胞的非病毒方法轉染一直是難點之一,對其進行優化對于推動和簡化基因相關的免疫學功能研究非常重要。目前利用電穿孔法將質粒DNA轉染人PBMC的報道較少[10-13]。本研究中,首先對PBMC電穿孔的電壓和脈沖時間進行了優化,可以看出隨著電壓的增大,細胞凋亡率會隨之增大,而轉染效率在一定范圍內隨之增大,超過一定范圍反而降低。之前有研究表明,適當的電壓和脈沖時間可以保證細胞在電轉后盡快地……恢復,而過大的電壓則會導致細胞的不可逆電穿孔[14-15]。
本研究考察了不同電轉緩沖液對電穿孔效率的影響,其中Opti-MEM的轉染效率和細胞存活率較高。有關電穿孔緩沖液中細胞致敏動力學的研究表明,不同緩沖液對細胞大小形態的變化,細胞骨架破壞程度和鈣流入以及細胞活性的恢復都有重要的影響,因此對每種細胞,確定最適的電轉緩沖液是非常重要的[16-17]。
本研究發現質粒的純度和性質對于電穿孔轉染成功與否至關重要的。考慮到電穿孔實驗的各種試劑和耗材都可以方便地購買,而自行構建的質粒其所用的提取方法每個實驗室都不太一樣,即使是相同的提取方法,不同的提取批次也會有差異。通過電泳、微量紫外分光檢測、全波長酶標儀光譜掃描、內毒素檢測等多個方面對質粒進行評價,以確定重要的影響因素。許多研究者會發現,盡管經過仔細的純化和質量控制,仍然很難重復電轉儀公司所標示的基因轉染效率,這很可能是由于他們使用自行構建的更大的質粒而不是公司提供的參考質粒造成的[18-19]。本研究發現不同的質粒其自身性質也會對細胞轉染情況造成很大差異,尤其是分子量,大分子的DNA轉染效率極低,迄今尚無好的解決辦法[9,20]。此外,本研究還發現除了對質粒中內毒素、蛋白質等特定的雜質進行檢測外,利用高分辨率全波長光譜掃描儀對質粒進行全面的檢測也是有必要的,可以方便快捷地判斷質粒的純度。
綜上所述,本研究對影響質粒轉染PBMC電穿孔效率的多種因素進行了探索,優化了電壓、脈沖時間、電穿緩沖液、細胞狀態,闡明了質粒純度對電穿孔轉染效率至關重要,為基于淋巴細胞的基因傳輸相關研究以及今后的臨床應用研究提供了有益的參考。

