不同發酵溫度對牛肝菌豆瓣醬品質變化研究
雷鎮歐,陳水科,李想*
(1.四川旅游學院,成都 610100;2.嶺南師范學院 生命科學與技術學院,廣東 湛江 524048)
牛肝菌是牛肝菌科和松塔牛肝菌科等真菌的統稱,目前確認的品種有153種,富含多糖、多酚等多種活性成分,具有抗氧化、調節免疫力、保護肝損傷等保健功效,又因其氨基酸含量豐富,味道鮮美,廣受消費者歡迎[1];目前已經實現人工栽培,加工成鮮食品、干制品、休閑食品、菌醬等產品[2]。因其富含呈味物質,其發酵調味醬被廣泛使用,發酵過程中的微生物多樣性變化直接影響成品醬的風味,成為調味品領域的研究熱點[3]。
本文采用市售鮮白牛肝菌為原料,將其添加到豆瓣醬的加工過程中,正交試驗優化其配方,對比不同發酵溫度條件,分析牛肝菌豆瓣醬的還原糖含量、氨基酸態氮含量、總酸含量、蛋白質含量、蛋白酶活性、淀粉酶活性、糖化酶活性等理化指標的變化規律,研究不同發酵模式下溫度對牛肝菌豆瓣醬風味的影響,探索其發酵過程中的質量變化規律,為傳統發酵工藝的改良提供了理論依據。
1 材料與方法
1.1 材料與設備
1.1.1 材料
鮮白牛肝菌、胡豆、面粉、食鹽:購于成都市龍泉驛區農產品批發市場;其他試劑:均為國產分析純。
1.1.2 設備
VM0198破壁料理機:Vita-Mix公司;GL2201-1SCN電子天平:上海雙旭電子有限公司;PV顯微分光光度計:北京美嘉圖科技有限公司;A330333臺式酸度計、DZX320生化培養箱:上海艾測電子科技有限公司;其他烹飪加工器皿:均由四川旅游學院實驗室提供。
1.2 方法
1.2.1 實驗設計
本實驗基礎配方及制備工藝參照行業標準,并通過預制實驗確定,分別采用恒溫模式、先高溫后低溫模式、先低溫后高溫模式3種發酵溫度模式進行發酵[4]。將牛肝菌豆瓣醬分成3個組別,每組3個平行組,分別在第0,5,10,15,20,25,30天7個時間點取樣檢測。
1.2.2 牛肝菌豆瓣醬制備工藝
1.2.2.1 原料初步處理
種曲的制備參照劉永琪的方法[5];蠶豆曲的制備參照丁祖志[6]關于蠶豆曲的制備工藝;牛肝菌的處理:將鮮白牛肝菌用多功能料理機制茸備用。
1.2.2.2 工藝流程
將蠶豆曲1000 g、鮮白牛肝菌茸100 g、種曲20 g、鹽80 g、水300 g混合均勻放入密封容器內自然發酵,用水隔絕空氣,每3天攪拌1次,發酵周期為30天。
1.2.2.3 發酵溫度
分別采用恒溫模式:35 ℃發酵30天、先高溫后低溫模式:50 ℃ 10天→40 ℃10天→30 ℃10天、先低溫后高溫模式:30 ℃10天→40 ℃10天→50 ℃10天3種發酵模式進行發酵,分別用模式1、模式2、模式3標注。
1.2.3 主要化學成分檢測
總酸的測定采用酸堿滴定法,具體操作參照GB/T 12456-2008《食品中總酸的測定》標準[7];
氨基酸態氮的測定采用酸度計法,具體操作參照GB 5009.235-2016《食品中氨基酸態氮的測定》標準[8];
蛋白質含量的測定采用分光光度法,具體操作參照GB 5009.5-2016《食品中蛋白質的測定》標準[9];
還原糖含量的測定采用高錳酸鉀滴定法,具體操作參照GB 5009.7-2016《食品中還原糖的測定》標準。
1.2.4 主要酶活性檢測
蛋白酶活力的測定采用甲醛法,具體操作參照SB/T 10317-1999《蛋白酶活力測定法》標準;淀粉酶活力的測定采用比色法,具體操作參照GB/T 5521-2008《糧油檢驗 谷物及其制品中α-淀粉酶活性的測定》標準[10]。
1.3 數據處理
每個組別試驗重復3次,并進行統計分析和均值差異性分析,P<0.05。
2 結果分析
2.1 不同發酵溫度模式對牛肝菌豆瓣醬總酸含量的影響
總酸含量是評價發酵醬料衛生的主要指標,其含量多少直接顯示其發酵過程中產酸微生物的數量以及是否被雜菌污染等,總酸含量過高引起菌落數量失衡,導致出品質量不合格[11]。由圖1可知,模式1和模式3總酸增加幅度在0~10天內較快,10~30天增加平緩;模式2在0~15天增加平緩,15~20天增加幅度加大,20~30天增加幅度平緩。分析發現模式1和模式3在0~10天內溫度適宜,產酸微生物大量繁殖,酸類物質增加較多,模式2在15~20天時溫度較適宜。30天時模式3總酸含量高于國家標準,其適宜的溫度繁殖了不同的菌群,其受食鹽添加量的影響,本配方食鹽添加量不能有效抑制其他產酸菌群的繁殖;食鹽用量過多會延長發酵時間,影響發酵效果;綜上,模式3要通過調節配方食鹽含量干預產酸菌群,優化發酵效果。

圖1 牛肝菌豆瓣醬總酸含量變化Fig.1 The change of total acids content inBoletus edulis broad bean paste
2.2 不同發酵溫度模式對牛肝菌豆瓣醬氨基酸態氮含量的影響

圖2 牛肝菌豆瓣醬氨基酸態氮含量變化Fig.2 The change of amino acid nitrogen content inBoletus edulis broad bean paste
由圖2可知,3種發酵溫度環境下,氨基酸態氮含量均呈現先增加后降低的趨勢,主要是牛肝菌、豆瓣中蛋白質大分子被發酵前期的蛋白酶降解,其降解程度受發酵溫度影響。3種模式溫度對比發現,模式1、模式3前期降解程度強于模式2,主要是其溫度適宜,模式2溫度過高不利于降解反應,模式1和模式3在0~20天氨基酸態氮含量始終增加,而模式2在15天已經達到最高值;隨著時間增加,相關酶活性降低,蛋白質分解停止,在氨基酸態氮含量達到最大值后開始被呈味物質消耗,其含量慢慢下降,說明模式2發酵速度和風味物質形成時間早于模式1和模式3。從氨基酸態氮含量變化角度分析,模式3的先低溫后高溫模式優于模式1的恒溫模式,優于模式2的先高溫后低溫模式。
2.3 不同發酵溫度模式對牛肝菌豆瓣醬蛋白質含量的影響
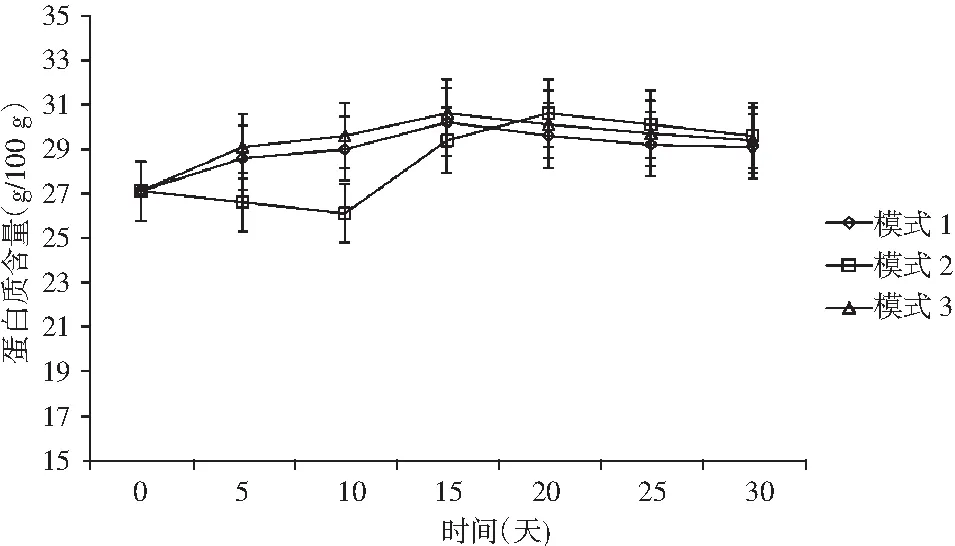
圖3 牛肝菌豆瓣醬蛋白質含量變化Fig.3 The change of protein content in Boletus edulis broad bean paste
牛肝菌豆瓣醬中的蛋白質主要來源于牛肝菌和豆瓣中,其被微生物分解成多肽和游離氨基酸,是醬料風味物質的主要來源。由圖3可知,在3種模式溫度下,牛肝菌豆瓣醬蛋白質含量變化幅度相對穩定,模式2在10~20天蛋白質含量增幅相對較大,可能是受微生物分解減慢引起的;最終測定蛋白質含量較初始測定增加,主要是揮發性物質酶解過程中速度緩慢,對氮需求量減少以及水分揮發引起的。
2.4 不同發酵溫度模式對牛肝菌豆瓣醬還原糖含量的影響
牛肝菌豆瓣醬原料中的淀粉被水解成還原糖,是微生物的主要能源物質,其含量變化直接反映出醬料微生物的繁殖情況以及淀粉的水解程度[12]。在整個發酵過程中,還原糖被酵母菌等發酵成有機酸和醇類物質,直接影響后期風味物質的形成。還原糖與氨基酸發生氨基美拉德反應,影響醬料發酵色澤。還原糖是衡量醬料風味物質含量、色澤形成的重要指標。
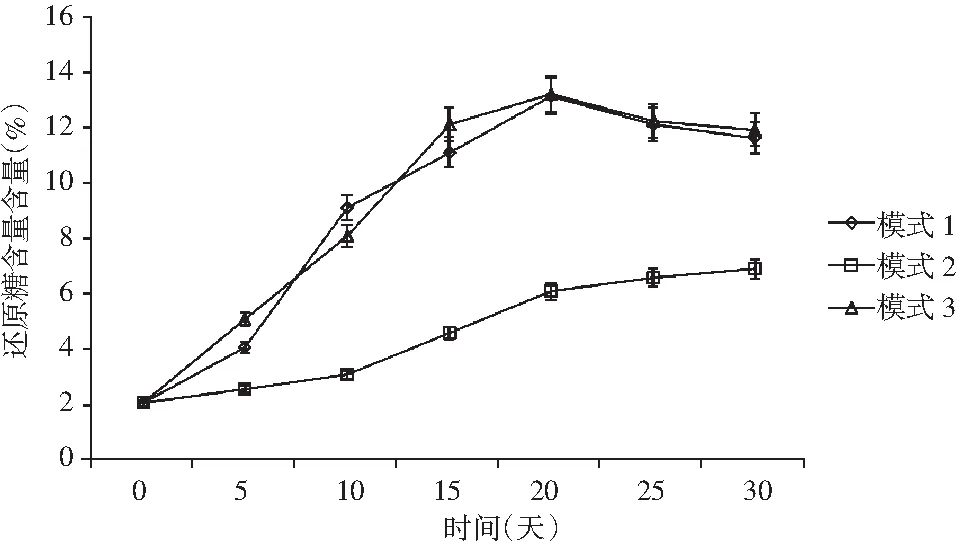
圖4 牛肝菌豆瓣醬還原糖含量變化Fig.4 The change of reducing sugar content inBoletus edulis broad bean paste
由圖4可知,3種不同發酵溫度模式下牛肝菌豆瓣醬中的還原糖含量均呈上升趨勢,主要是發酵過程中還原糖的生產量高于其消耗量,比較3種模式,模式1與模式3前期還原糖含量的積累量高于模式2,主要是模式2前期發酵溫度過高,雖有利于糖化酶的還原,但是相對高溫使淀粉酶的穩定性降低,活性降低。模式1和模式3在20天時開始下降,主要是受酶活力的影響,還原糖化酶的速度降低,模式2在20天時仍保持增長,主要是其后期發酵溫度適宜淀粉酶的穩定,但從還原糖含量總量來看,模式1和模式3優于模式2,更有利于風味物質的形成和形成良好的發酵色澤。
2.5 不同發酵溫度模式對牛肝菌豆瓣醬蛋白酶活性變化的影響
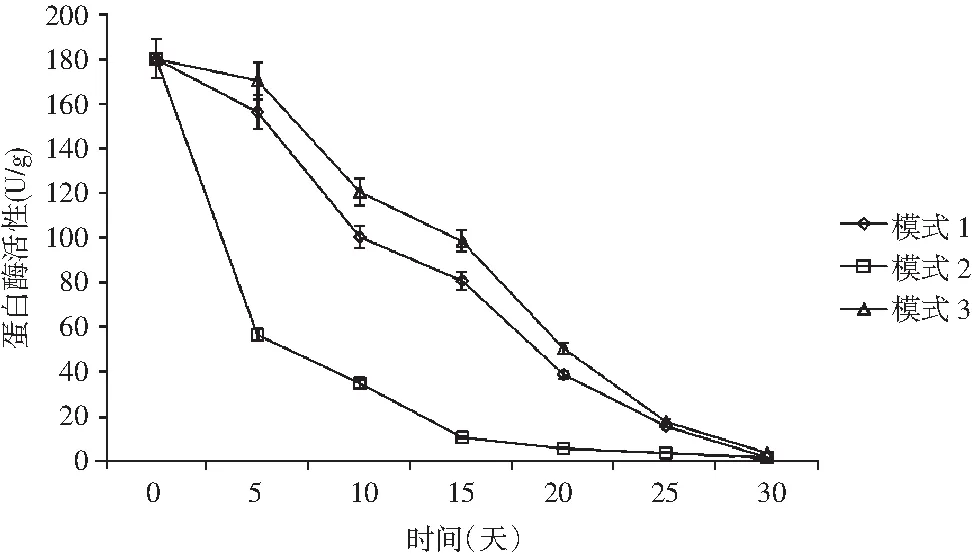
圖5 牛肝菌豆瓣醬蛋白酶活性變化Fig.5 The change of protease activity of Boletus edulis broad bean paste
蛋白酶活性主要受pH值、鹽濃度等的影響,隨著發酵過程中酸度的增加,其活性下降。由圖5可知,對比3種溫度模式,模式1和模式3蛋白酶活性下降較為平緩,模式2蛋白酶活性下降較快,主要是受溫度和發酵醬中酸度的影響,這與前面分析結果相對應,驗證了牛肝菌豆瓣醬總酸含量的變化趨勢。綜合分析,模式2先高溫后低溫模式相對較差。
2.6 不同發酵溫度模式對牛肝菌豆瓣醬淀粉酶活性變化的影響

圖6 牛肝菌豆瓣醬淀粉酶活性變化Fig.6 The change of amylase activity of Boletus edulis broad bean paste
牛肝菌豆瓣醬中豆瓣是淀粉的主要來源,其在發酵過程中經過淀粉酶的作用水解,加速后期微生物的產酸、產醇類物質,直接影響牛肝菌豆瓣醬風味物質的形成和色澤。由圖6可知,隨著發酵時間增加,淀粉酶活性呈下降趨勢,主要是發酵時間延長,微生物總量減少,淀粉酶產生的數量隨之減少,其活性降低,另外在發酵過程中,水分蒸發以及pH值降低,抑制淀粉酶活性。模式2先高溫后低溫模式下降幅度明顯高于模式1和模式3,主要是在相對溫度較高的環境下,淀粉酶穩定性下降,影響還原糖的生成和發酵質量。基于此,模式2先高溫后低溫模式淀粉酶活性略低于模式1和模式3。
3 結論
本實驗分別采用恒溫模式、先高溫后低溫模式、先低溫后高溫模式3種發酵溫度模式進行發酵,分析不同發酵模式下牛肝菌豆瓣醬中總酸含量、氨基酸態氮含量、蛋白質含量、還原糖含量的變化,通過鹽的添加控制總酸的量的前提下,模式2先高溫后低溫發酵模式劣于模式1恒溫模式與模式3先低溫后高溫模式;進一步比較3種發酵溫度模式的蛋白酶活性、淀粉酶活性的變化情況,發現發酵初期相對高溫發酵導致酶的穩定性下降,影響醬料中酶的活性,驗證了前期理化檢驗結果的變化情況。最終確定采用先低溫后高溫模式:30 ℃10天→40 ℃10天→50 ℃10天牛肝菌豆瓣醬的發酵效果最佳。研究不同發酵模式下溫度對牛肝菌豆瓣醬風味的影響,探索其發酵過程中的質量變化規律,為傳統發酵工藝改良提供了理論依據。

