1,25(OH)2D3對腎小球系膜細胞凋亡相關因子表達的影響
唐小鐵,徐潔,王麗媛,于洋,崔學彬,孫維言
原發性腎小球疾病作為臨床常見疾病,是引起終末期腎臟疾病的重要原因。系膜增生性腎小球腎炎(MsPGN)屬于原發性腎小球疾病的一種類型,主要由彌漫性系膜細胞異常增生導致,加之患者腎臟細胞外基質病理性聚集共同作用導致發病[1-2]。研究發現,腎小球系膜細胞(HMC)凋亡與MsPGN的發病密切相關,這是因為在HMC細胞凋亡的過程中會大量消耗增殖細胞,加速致病進程[3]。因此在MsPGN治療過程中,對系膜細胞的增殖進行抑制、加快細胞凋亡,能對過度增殖性系膜細胞進行消除,獲得治療效果。相關研究顯示,1,25(OH)2D3能抑制HMC增殖速度,加速凋亡,但其具體機制仍未闡明[4]。Caspase蛋白因子在細胞凋亡過程中發揮關鍵作用,其中Caspase-3活性能反映細胞凋亡程度。而表皮生長因子(EGF)對細胞體外增殖存在促進作用[5]。基于此,本研究對1,25(OH)2D3對腎小球系膜細胞凋亡相關因子表達的影響進行分析,報道如下。
1 材料與方法
1.1 材料 (1)HMC細胞株:由武漢科技大學附屬普仁醫院實驗中心提供,并經免疫熒光實驗、形態學觀察鑒定;(2)試藥與試劑:1,25(OH)2D3;Caspase-3活性檢測試劑盒、BCA蛋白定量試劑盒(美國Sigma公司);兔抗人Caspase-3單克隆抗體、p-Akt(磷酸化Akt)單克隆抗體、Caspase-8單克隆抗體、Caspase-9單克隆抗體(深圳華大基因研究院);(3)儀器設備:T100型PCR 儀(美國Bio-Rad公司)、MCO-18AIC型CO2培養箱(日本SANYO)、Falcon 96孔懸浮細胞培養板(美國BD公司,貨號 CM001923);低溫冰箱(日本 SANYO公司)。
1.2 實驗方法
1.2.1 細胞培養及分組: 2017年10月—2018年9月在武漢科技大學附屬普仁醫院腎內科實驗室進行實驗。選擇由鏈霉素100 mg/L、10% 胎牛血清(FBS)及青霉素100 U/ml組成的L-DMEM完全培養基實施HMC細胞株復蘇,在37℃飽和濕度的CO2(濃度為5%)培養箱內進行培養。根據2×105/ml密度將對數期HMC接種在6孔板內,待細胞徹底貼壁后,再于饑餓條件下持續培養24 h,分成A組(空白對照組)、B組(EGF組)、C組[1,25(OH)2D3組]、D組[EGF、1,25(OH)2D3聯合組]。其中A組于5%胎牛血清DMEM培養基內進行培養,B組于培養基內加入EGF(10 ng/ml)培養液,C組加入1,25(OH)2D3(10-8mol/L)培養液,D組加入EGF(10 ng/ml)培養液和1,25(OH)2D3(10-8mol/L)培養液。
1.2.2 Caspase-3蛋白活性檢測:4組經48 h干預培養后,開展細胞裂解實驗[6],并經BCA蛋白定量試劑盒對提取蛋白表達進行測定,在96孔板底酶標板內準確配置等量的反應體系,其中包括緩沖液80 μl、Ac-DEVD-pNA 10 μl、待測樣品10 μl,混勻后孵育4 h。待顏色變化,測定吸光度值。
1.2.3 細胞凋亡相關因子測定[7]:采用Western blot法對4組的Akt、p-Akt及Caspase-3、Caspase-8、Caspase-9蛋白進行測定。細胞裂解后,經高速離心25 min,分離上清液;置入Loading Buffer煮沸10 min,促使蛋白變性。再分別開展上樣電泳及PVDF轉膜,用TBST溶液洗滌6次(每次5 min),滴入ECL發光試劑,經X線片曝光;Akt、p-Akt及Caspase-3、Caspase-8、Caspase-9蛋白表達量以其與GAPDH的灰度比值表示。
1.2.4 Caspase mRNA水平測定[8]: 選擇熒光實時定量PCR法對Caspase-3、Caspase-8、Caspase-9的mRNA表達進行測定,選取4組細胞,應用TRIzol法對RNA進行提取,并經反轉錄試劑盒使總RNA反轉錄為cDNA,所有操作全部參照說明書執行,參照說明書設計Caspase-3、Caspase-8、Caspase-9引物的上游、下游、引物長度。將PCR反應體系設置為25 μl,在42℃環境下開展反轉錄30 min,99℃ 5 min,促使反轉錄酶的活性喪失。記錄基因擴增Ct閾值,選擇2-△△ct計算各個mRNA基因表達量。
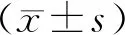
2 結 果
2.1 Caspase-3蛋白活性比較 A組、B組、C組及D組Caspase-3蛋白活性分別為(0.890±0.004)、(0.362±0.005)、(1.376±0.010)、(1.001±0.002); B組 2.2 p-Akt/Akt值比較 A組、B組、C組、D組的p-Akt/Akt比值分別為(0.240±0.005)、(0.599±0.026)、(0.047±0.004)、(0.439±0.060);C組 圖1 4組HMC內p-Akt、Akt蛋白的表達 2.3 Caspase蛋白表達 Caspase-3及Caspase-9蛋白表達C組>D組>A組>B組(q=5.156、5.436、7.326;5.074、5.982、6.513,P均<0.01); Caspase-8蛋白的表達4組比較,差異無統計學意義(q=0.165、0.178、0.204,P均>0.05),見表1。 表1 4組Caspase蛋白表達情況 2.4 Caspase mRNA基因表達 Caspase-3 mRNA、 Caspase-8 mRNA及Caspase-9 mRNA基因表達C組>A組>D組>B組(q=15.672、17.526、19.421,5.168、5.689、6.024,6.425、6.974、7.654,P均<0.01),見表2。 表2 4組Caspase mRNA基因表達情況 原發性腎小球腎炎作為腎小球疾病常見類型,為引起晚期腎病的首要病因,多見于MsPGN。研究發現,MsPGN是一種呈彌漫性腎小球系膜細胞增生的系膜基質增生性疾病,早期主要表現為系膜細胞數量異常增多[9-10]。因此,臨床認為對系膜細胞增生進行抑制,加快系膜細胞凋亡為控制MsPGN靶點,故探究HMC增生抑制原理,尋找誘導HMC凋亡藥物對于治療腎小球腎炎就顯得尤為重要[11]。研究顯示,B組細胞的凋亡機制復雜多變,實驗中可以從細胞表面死亡受體內質網以及線粒體等信號途徑通路進行探究[12]。Akt屬于蛋白激酶B,是人體細胞因子與其他下游蛋白刺激的重要組成部分,共同參與調節信號通路,于線粒體介導性內源性凋亡通路內起到主要作用[13]。本研究顯示,B組Caspase-3的活性低于A組,并且p-Akt/Akt比值高于A組,說明B組HMC相關凋亡活性顯著減弱,這可能與p-Akt/Akt比值升高存在相關性,而Akt磷酸化在加快HMC增殖及阻斷其凋亡過程中可能起到參與作用。結果顯示,于線粒體凋亡通路初期階段,熱休克蛋白(HSP)家族內HSP27和Akt互相作用,能對凋亡發生進行介導。Akt磷酸化能減弱凋亡信號的調節激酶1相關活性,通過抑制原癌基因蛋白質與Akt磷酸化底物的結合,阻斷Caspase-9蛋白的活化,從而阻止細胞凋亡[14]。活化Caspase-3僅能于凋亡細胞內檢出,故對Caspase-3活性改變進行檢測可觀察到細胞早期凋亡,進而反映細胞凋亡活性改變[15]。 Caspase起始蛋白可被活化成活性蛋白水解酶,對下游相關效應凋亡蛋白酶進行切割,而活化性效應凋亡蛋白酶能對保持細胞結構、活動的相關蛋白實施裂解,從而促進細胞凋亡,多由Caspase-3、Caspase-8、Caspase-9誘導凋亡[16]。研究數據顯示,Caspase-3蛋白因子為細胞凋亡期間關鍵性終末剪切酶,于細胞程序性死亡過程中發揮關鍵作用[17]。本研究結果表明,A組Caspase-3及Caspase-9 mRNA的表達均高于B組,說明加快HMC增殖后,和凋亡有關的Caspase-3蛋白及Caspase-9蛋白的表達均減少,加之分析A組p-Akt/Akt比值低于B組,認為HMC增殖后,能經Akt磷酸化減少Caspase-3蛋白、Caspase-9蛋白表達,進而對細胞凋亡過程進行抑制。細胞因子于凋亡的3條途徑內,Akt為線粒體介導性凋亡通路的主要交匯點,能經磷酸化或與凋亡相關因子互相作用對細胞凋亡進行調節[18]。Caspase-8是死亡受體途徑的主要啟動因子,在對其活化誘導后,能對其下游相關同源酶進行進一步鏈式水解,后將其效應物Caspase-3的生物效應激活,相關研究發現Caspase對細胞分化存在促進作用,可對細胞自噬進行調節,加速細胞遷移。 1,25(OH)2D3是維生素D3主要生物活性形式,作為類固醇激素能調節鈣磷、腎素血管緊張素釋放、免疫系統、胰島素分泌、神經系統功能。相關研究顯示,1,25(OH)2D3能阻斷細胞增生、加快細胞凋亡,降低系統性硬化癥及糖尿病等相關慢性疾病出現風險[19]。本研究結果表明,A組Caspase-3蛋白活性低于C組、D組,且B組Caspase-3蛋白活性低于D組;說明1,25(OH)2D3干預治療后能增強正常的HMC凋亡活性,且能增強增殖后HMC相關凋亡活性,提示1,25(OH)2D3能加快HMC凋亡。同時,本結果顯示,A組p-Akt/Akt比值高于C組,Caspase-3、Caspase-9 mRNA的表達均低于C組;說明1,25(OH)2D3能經阻斷Akt磷酸化,使Caspase-3、Caspase-9 mRNA表達上調,增加HMC凋亡活性,加快HMC凋亡。而B組p-Akt/Akt比值高于D組;說明1,25(OH)2D3能增強增殖后HMC的凋亡活性,分析原因可能與阻斷Akt磷酸化,使Caspase-3、Caspase-9 mRNA表達上調存在相關性[20]。 綜上所述,1,25(OH)2D3可使增殖后HMC相關凋亡活性增強,通過抑制Akt磷酸化,上調Caspase-3蛋白及Caspase-9蛋白表達,從而增強HMC凋亡活性,加速凋亡進程。 利益沖突:無 作者貢獻聲明 唐小鐵:研究方案設計,整理資料、分析資料、撰寫論文;徐潔:收集整理資料,參考書籍查找;王麗媛:收集整理資料,分析數據,圖表設計;于洋:修改論文;崔學彬、孫維言:收集資料
3 討 論

