卒中綠色通道收治的1例靜脈竇血栓形成病例報道
王慧琴,劉亢丁,靳航,王守春,邢英琦
1 病例介紹
患者男性,51歲,因“言語不清4 h加重伴抽搐發作1.5 h”于2017年10月27日以“缺血性卒中”收入吉林大學第一醫院。患者入院前4 h無明顯誘因出現目光呆滯、言語不清,表現為答非所問、反應遲鈍,就診于吉林大學第一醫院急診,行頭顱CT示“雙側多發腔隙性腦梗死”,NIHSS評分6分,遂于入院前1.5 h于急診給予阿替普酶靜脈溶栓治療。首劑靜推后,患者突然抽搐發作。為求進一步診治,收入吉林大學第一醫院神經內科。病程中患者無惡心、嘔吐。
既往史:缺血性卒中病史3年,未遺留后遺癥。高血壓病史10余年,血壓最高可達240/90 mm Hg,規律服用硝苯地平片和纈沙坦降壓治療,血壓控制欠佳。腎功能不全病史5年。吸煙20年,每日10支左右,已戒4年。飲酒20年,200 g/d,已戒4年。
入院查體:血壓135/90 mm Hg,心率80次/分,神志清楚,完全性混合性失語,雙側瞳孔等大同圓,直徑約3.5 mm,對光反射靈敏,雙側額紋及鼻唇溝對稱等深,口角無歪斜,伸舌居中,四肢肌力5級,四肢肌張力正常,雙側腱反射對稱引出,右側病理征(+),無項強,Kernig征(-),余神經系統查體不配合。
實驗室檢查:D-二聚體、PT和APTT均正常。抗凝血酶Ⅲ、蛋白S、蛋白C、雌二醇、抗心磷脂抗體、抗雙鏈DNA及抗核抗體未見異常。血Hcy水平66.60 μmol/L,高于正常,血清維生素B12水平87.00 pmol/l,較正常減低。基因檢測顯示MTHFR基因C677T為TT型,存在純合突變。抗β2-糖蛋白1抗體27 RU/mL略升高。腦脊液常規檢查:蛋白0.31 g/L,葡萄糖6.4 mmol/L,氯132.1 mmol/L,潘氏反應陰性,白細胞5×106/L,紅細胞500×106/L,腰椎穿刺腦脊液壓力為190 mm H2O。
影像學檢查:顱腦多排CT平掃(2017-10-27發病4 h,急診):雙側多發腔隙性腦梗死,腦軟化灶。顱腦多排CT平掃(2017-10-28):雙側多發腔隙性腦梗死,腦軟化灶;左側顳葉密度稍低。經顱多普勒超聲(2017-10-29):未見異常。頸動脈超聲(2017-10-29):左側頸動脈內中膜不均勻增厚,右側頸部動脈斑塊形成(單發),雙側VA管徑不對稱,左側發育優勢。頸靜脈超聲:左側頸內靜脈全程血栓形成(2017-10-30);左側頸內靜脈J1段、J2段血栓形成,J3段可見稀疏血流信號(2017-11-09)(圖1)。頭顱MRI平掃+DWI(2017-10-30):腦內多發腔隙性腦梗死及缺血灶,部分形成軟化灶伴膠質細胞增生;考慮左側丘腦、左側顳枕葉及海馬亞急性腦梗死;腦白質疏松;輕度腦萎縮(圖2)。MRA(2017-10-30):雙側PCA動脈硬化所致血管輕度狹窄;右側VA纖細,考慮先天發育;左側顳枕交界處增粗迂曲血管影。MRV(2017-10-30):左側橫竇、乙狀竇及左側頸內靜脈改變(圖2)。DSA(2017-11-09):左側橫竇、左側乙狀竇及左側頸內靜脈未顯影,右側橫竇、右側乙狀竇及右側頸內靜脈通過皮層靜脈引流顯影;左側頸外動脈通過動靜脈瘺向左側靜脈遠端供血(圖2)。四肢靜脈彩超(2017-11-01):左側頭靜脈(前臂)血栓形成(急性期、完全型)。右上肢靜脈彩超(2017-11-08):右側頭靜脈(前臂)血栓形成(急性期、完全型)。
臨床診斷:
缺血性卒中
顱內靜脈竇血栓形成
左側頸內靜脈血栓形成
顱內動靜脈瘺
雙上肢血栓性淺靜脈炎
右側頸部動脈斑塊形成(單發)
高血壓病3級(極高危險組)
高同型半胱氨酸血癥
維生素B12缺乏癥
治療經過:中年男性,卒中樣起病,既往有缺血性卒中病史,基線NIHSS評分6分,考慮急性缺血性卒中可能性大,且就診時間在超急性期時間窗內。患者在頭顱CT排除腦出血后急診行阿替普酶靜脈溶栓治療。首劑靜推后,患者突然癲癇發作,立即停藥。復查頭顱CT未見腦出血,即刻NIHSS評分6分。收入院后提檢顱腦多排CT平掃、MRI+DWI、頸動脈超聲、MRA等腦血管病相關檢查,暫給予抗血小板聚集、改善循環及對癥支持治療,患者病情無明顯變化。入院后1 d,CT結果回報左側顳葉密度稍低,支持缺血性卒中診斷。入院后3 d,經TCD、頸動脈超聲結果提示患者顱內動脈系統未見異常,但超聲醫師行頸動脈超聲檢查過程中偶然發現患者左側頸內靜脈全程血栓形成。結合患者抽搐病史,完善顱內靜脈相關檢查,明確顱內靜脈系統疾病的可能。患者入院后4 d,頸靜脈超聲回報(圖1)左側頸內靜脈全程血栓形成。立即給予華法林抗凝、甘露醇脫水降顱壓等治療。隨后相繼完善頭顱MRV(圖2)及靜脈系統血栓形成相關病因學檢查,明確患者缺血性卒中、顱內靜脈竇血栓形成、左側頸內靜脈血栓形成的診斷。

圖1 頸部靜脈超聲
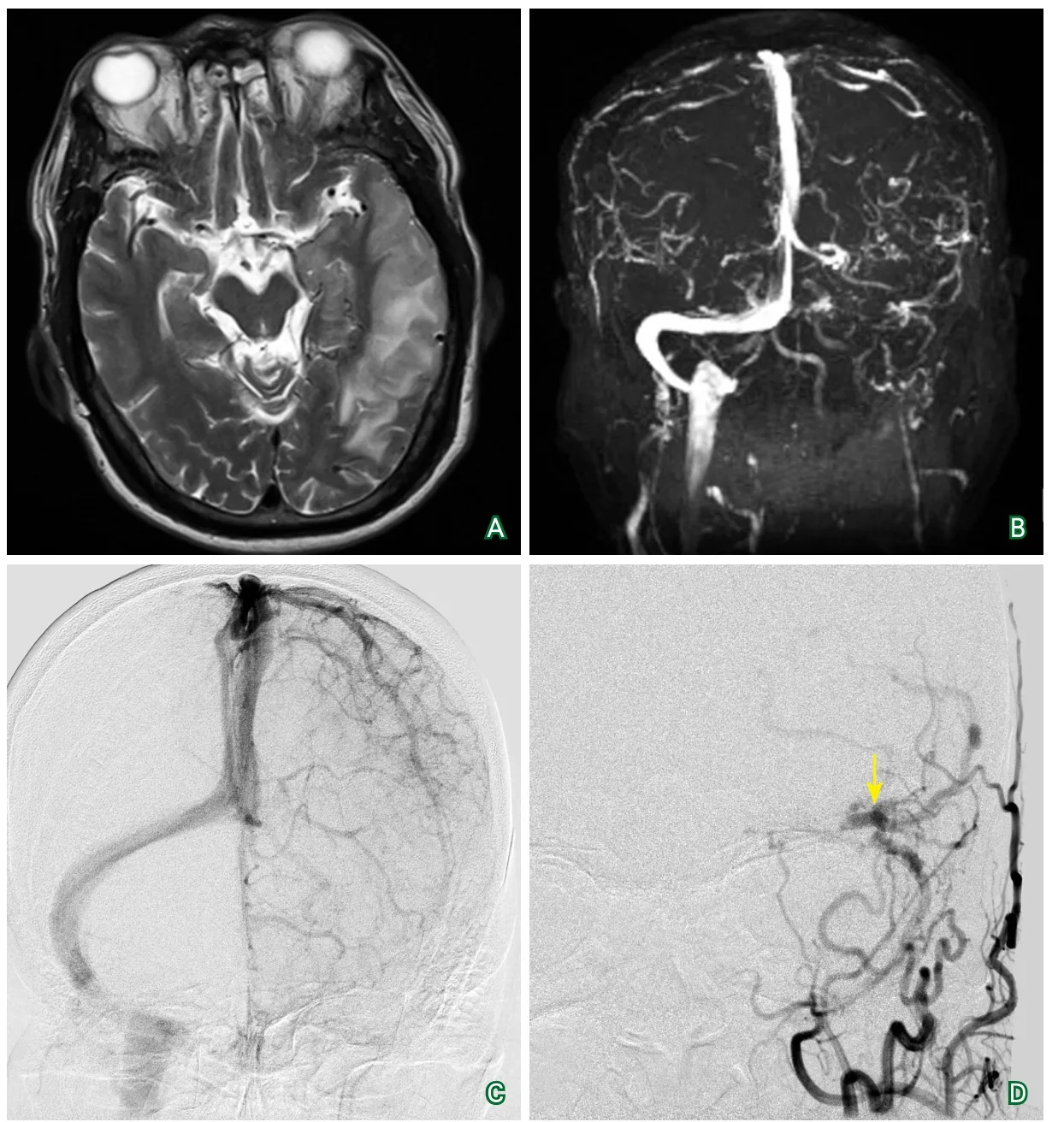
圖2 其他影像學檢查
分析患者發病原因,陽性輔助檢查為血Hcy水平明顯升高,伴有維生素B12缺乏,且患者雙上肢相繼發生靜脈血栓,考慮患者為易栓體質。進一步提檢MTHFR基因,發現患者MTHFR基因C677T為TT型,存在純合突變。該基因可介導Hcy在人體內的清除,促進DNA甲基化反應,誘導內皮細胞激活促凝因子,使機體處于高凝狀態,促進血栓形成。另外,患者此次發病形成大量靜脈系統血栓伴急性缺血性卒中癥狀,應注意是否存在顱內血管動靜脈瘺,抑或大量靜脈血栓形成后導致顱內血管通透性及壓力改變,造成動靜脈瘺出現,進一步完善DSA明確血管內情況。DSA提示(圖2)左側橫竇、左側乙狀竇及左側頸內靜脈血栓形成;左側頸外動脈通過動靜脈瘺向左側靜脈遠端供血。入院后14 d復查頸部靜脈超聲,超聲提示(圖1):左側頸內靜脈J1段、J2段血栓形成,J3段可見稀疏血流信號。出院時患者神志清楚,語言流利,雙側病理征陰性。出院后繼續抗凝治療,隨訪5個月,患者無復發。
2 討論
顱內靜脈竇血栓形成(cerebral venous sinus thrombosis,CVST)是一種好發于年輕人的相對罕見而嚴重的卒中類型,占所有卒中的0.5%~1%[1-2]。CVST的危險因素具有多樣性,臨床癥狀不典型,及時準確的診斷對于CVST患者的治療和預后具有重要意義。影像學檢查在其診斷中起著主要的作用[3]。
CVST的影像學檢查方法可被分為無創性檢查和有創性檢查兩類。DSA能夠清晰、直觀地顯示顱內靜脈竇的解剖結構、引流及代償情況,是診斷CVST的“金標準”。但其作為有創檢查,只適用于一些診斷不明或考慮行血管內治療的病例[4]。無創性檢查中,臨床對于高度懷疑CVST的患者常規采用頭部MRI和MRV進行評估。MRV是CVST早期診斷和長期隨訪中敏感而無創的檢查方法[5]。但是對于急癥患者,MRV往往因難以及時實現而延誤診療時機。此外,患者常常因躁動或體內有金屬植入物而無法配合檢查。
本文介紹由血管超聲偶然發現頸靜脈血栓,進而相繼診斷了CVST、動靜脈瘺,治療過程中患者反復上肢靜脈血栓,最后基因診斷發現患者具有易栓體質的病例,旨在為臨床高度懷疑CVST而早期無法確診的患者提供新的思考。頸靜脈超聲檢查不僅具有安全、無創、簡便等優點,而且可以直接顯示頸內靜脈內膜的改變、有無血栓形成、管腔直徑及血流速度,是臨床對有頸內靜脈置管史的可疑頸內靜脈血栓形成患者的常規篩查手段。但對于CVST患者,頸靜脈超聲的應用尚未普及。
對CVST患者進行頸靜脈超聲檢查。一方面,頸靜脈超聲可以探及CVST患者的頸內靜脈血流動力學改變特點,為臨床診斷提供依據。?zkan ?zen等[6]研究納入了2008-2010年診斷為CVST的40例患者,并將其分為單側完全型CVST組(29例)、雙側彌漫型CVST組(6例)和單側部分型CVST組(5例)。通過彩色多普勒對各實驗組及對照組的雙側頸內靜脈進行檢查,結果發現,CVST患者患側頸內靜脈回流血流量顯著減低。對于臨床高度懷疑CVST而無法配合MRV檢查的患者,頸靜脈超聲對臨床診斷可能具有提示意義。
另一方面,頸靜脈超聲可以明確患者是否存在頸內靜脈病變,為原因不明的CVST患者實現病因篩查。CVST的病因復雜多樣,其中17%~27%的病例病因尚不明確[1]。頸內靜脈是上矢狀竇、竇匯、橫竇至乙狀竇的延續,是顱內靜脈的主要回流通路。一些研究推測,頸內靜脈病變可以通過引起血流動力學改變使顱內靜脈回流障礙,從而導致CVST的發生。頸內靜脈病變類型包括:局限性狹窄、長段纖細、靜脈血栓及靜脈瓣異常等[7-8]。在這種情況下,血栓很可能從頸靜脈開始形成,并以逆行方式延伸到顱內靜脈系統。由于最初的癥狀不典型,此類患者通常在其疾病初期難以獲得明確的診斷,缺乏相關危險因素的患者尤其如此。患者的預后很大程度上取決于診斷時間,如果及時診治,CVST的死亡率則<10%。因此,在緊急情況下及時進行頸靜脈超聲檢查可以提示CVST的發生,為早期診斷提供可能。
此外,頸靜脈超聲能夠明確CVST是否合并頸內靜脈血栓形成,為臨床治療提供依據[9]。近年來,微球囊血管內成形術和局部微導絲機械破壞血栓輔助直接溶栓療法的應用使局部靜脈內溶栓技術得到了進一步發展。對于擬行血管內介入治療的患者,術前應該重點關注CVST是否合并頸內靜脈血栓形成,術中積極開通頸內靜脈,將明顯縮短整個治療周期。
綜上,我們建議對可疑CVST患者常規進行頸靜脈超聲檢查,為CVST的早期診斷及治療方案的選擇提供參考。但頸靜脈超聲檢查針對CVST的規范化診斷標準仍需要進一步探討。

