藏北嵩草種子休眠與發芽特性研究
鄧晨玥, 徐慧齊, 呼天明, 何學青
(西北農林科技大學草業與草原學院,陜西 楊凌,712100)
種子休眠是指具有生活力的種子在適宜的環境條件(即水分與空氣充足、溫度適宜)下經過一定時間仍然不能發芽的現象[1],而種子發芽是植物生命周期中的關鍵發育步驟,并且對農業生產也很重要[2],因此破除種子休眠、尋找種子發芽最適條件的研究變得尤為重要。
藏北嵩草(KobresialittledaleiC. B. Clarke)是莎草科,嵩草屬的多年生草本植物,主要分布于中國青藏高原,具有耐寒、耐旱、耐瘠薄、耐輻射、耐強風的特點,并且草質柔軟、營養價值高,富含蛋白質,是家畜喜愛的原生優良牧草,除此之外,還具有控制水土流失、維持生態平衡的重要作用[3]。嵩草屬種子在自然條件下發芽率極低,未經處理的嵩草種子室內和室外發芽率分別只有4%和2%[4],休眠率明顯,所以,打破嵩草種子休眠、提高嵩草屬植物種子發芽率及其特性的研究具有重要意義。有關打破嵩草屬植物的休眠并提高其發芽率的研究已有相關報道[5-8],但主要集中利用層積和溫度處理等物理方法,處理效果不顯著。魚小軍等[7]研究表明冬季層積對完整和破皮線葉嵩草(Carexcapillifolia(Decne.) S. R. Zhang)種子的發芽無顯著影響。康建軍等[8]研究發現粗壯嵩草(KobresiarobustaMaxim.)在25/5℃,25/15℃和 25/20℃變溫的條件下,不同處理后發芽率最高僅能達到30%,未能滿足栽培利用之需。
種子的休眠與發芽特性因種而異,因此不同種子應選擇適宜其本身的方法來破除休眠,提高發芽率。打破種子休眠的方法可分為物理方法和化學方法兩大類。其中物理處理方法主要包括溫度、光照、溫水浸種和電磁場處理等[9]。張國云等[5]對嵩草(Kobresiamyosuroides(Villars) Fiori)種子的研究中發現在相同質量濃度氫氧化鈉(NaOH)溶液處理下,結合低溫層積處理比單獨使用NaOH溶液處理,種子萌發率均有提高,但未達到顯著性差異。周之琴等[6]用濃硫酸處理藨草(ScirpustriqueterL.)和苔草(Carexspp.)的種子,但對發芽無顯著促進作用。化學處理法包括滲透調劑類、無機鹽類、激素等處理[9]。其中,激素在種子休眠和發芽過程中扮演著重要的作用。如劉文瑜等[10]以0.1 mmol·L-1GA3將蒺藜苜蓿(Medicagotruncatula)浸種后低溫層積處理對于種子發芽效果最好。郭春秀等[11]使用80 mg·L-1赤霉素(GA3)水溶液浸泡沙生針茅(Stipaglareosa)種子24 h,對于提高種子的發芽率和發芽勢的效果最好。有關植物生長調節物質對降低藏北嵩草種子休眠率,提高發芽率的研究報道甚少,結合前人研究,本試驗采用赤霉素3(Gibberellin,GA3,GA4+7),脫落酸(Abscisic acid,ABA)等3種外源激素和赤霉素的生物合成抑制劑多效唑(Paclobutrazol,PA),脫落酸的生物合成抑制劑氟啶酮(Fluridone,FL)以及NaOH處理藏北嵩草種子,探究藏北嵩草種子休眠機理并尋求快速有效提高藏北嵩草植物種子發芽率的方法,為嵩草屬植物有效利用提供理論參考依據。
1 材料與方法
1.1 試驗材料
供試材料為藏北嵩草成熟種子。于2014 年采集于西藏那曲地區,經風干清選后置于4℃冰箱中保存備用。
1.2 試驗方法
將藏北嵩草裝于燒杯中,用75%的酒精處理種子30 s后取出,使用蒸餾水沖洗3~5次,再用質量分數為1.0%的次氯酸鈉溶液消毒1 min,用蒸餾水沖洗干凈備用。
1.2.1種子生活力測定預處理 初始生活力[12]:將完整飽滿的種子浸泡在蒸餾水中在25℃下過夜(12 h),將種子取出用解剖刀沿腹縫線縱切、橫切以及刺破種皮處理,進行生活力測定。
新鮮未發芽種子生活力:發芽試驗結束后,將未發芽的種子采用橫切方法進行切割,進行生活力測定。
1.2.2NaOH溶液處理 每處理選取25 粒飽滿的藏北嵩草種子,放入20,30,40 g·L-1的NaOH溶液中,分別浸泡處理1,2,3 h,將種子洗凈后放入置有雙層濾紙的直徑為9 cm培養皿中,貼上標簽,用于發芽試驗,每處理3次重復。
1.2.3外源植物生長物質單一溶液處理 每處理選取25 粒飽滿的藏北嵩草種子,放入置有雙層濾紙的培養皿中,分別加入6 mL濃度為0,50,100,200,400 μmol·L-1的GA3,GA4+7,FL,PA,ABA溶液浸濕濾紙,以蒸餾水為對照,每處理3次重復,隨后進行發芽試驗。
1.2.4外源植物生長物質混合溶液處理 將濃度均為400 μmol·L-1的4種外源激素ABA,FL,GA3和PA兩兩之間進行等體積混合,混合后試劑最終濃度為200 μmol·L-1,每處理選取25 粒飽滿的藏北嵩草種子,放入放置雙層濾紙的直徑為9 cm培養皿中,分別加入6 mL混合后的溶液,以蒸餾水為對照進行發芽試驗,每處理3次重復。
1.3 試驗指標測定
1.3.1種子千粒重測定 從凈種子中隨機選取8組種子,每組100粒,用千分之一天平準確稱重,取平均值計算種子千粒重。
1.3.2種子吸水率測定 選取刺破種皮與完整的藏北嵩草種子各25粒,每處理3次重復,在25℃條件下,將種子浸泡在蒸餾水中,分別在0.5 h,1 h,2 h時將種子取出快速用濾紙吸干種子表面水分,準確稱重,隨后每隔 2 h取出種子,按照同樣的方法進行稱量,并按下列公式計算吸水率。

1.3.3種子生活力測定 將不同處理的種子置于點滴板上,滴加0.5% TTC溶液,將點滴板置于黑暗條件下30℃的恒溫箱中12 h,其中每處理25粒種子,重復3次,取出浸泡于TTC溶液中的種子用清水洗凈后,進行觀測,記錄胚正常染色的種子數量,并按下列公式計算生活力。

新鮮未發芽的種子數(粒)=
供試種子數(粒)-發芽種子數(粒)

1.3.4發芽試驗相關指標測定 將所有處理的培養皿置于恒溫光照培養箱內進行發芽試驗,培養條件為:溫度(25±2)℃[13],光照16 h,黑暗8 h。以胚根突破種皮作為發芽標準[14],觀察發芽總時長為28 d,種子發芽期間每天觀察并記錄發芽種子數,用于計算種子發芽率、發芽勢和發芽指數,計算公式如下:


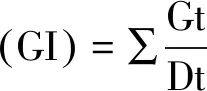
1.4 數據處理
所有數據均用Excel 2013錄入,數值均以平均值±標準誤表示,采用SPSS Statistics 17.0軟件對數據使用Duncan’s法檢驗各處理之間的差異顯著性。
2 結果與分析
2.1 藏北嵩草種子形態結構及千粒重測定
通過觀察發現,藏北嵩草種子形狀為長圓形或橢圓形,先端尖,外種皮為黑褐色,光滑,不易剝離。種子長為2.3 ~ 2.9 mm,寬為1 ~ 2 mm,果實具有較長的果柄和果喙,其中,果柄長0.2 ~ 0.3 mm,果喙長0.2 ~ 0.3 mm,種子千粒重為0.7520±0.091 g,說明種子飽滿。
2.2 種皮透性對藏北嵩草種子吸水率的影響
藏北嵩草種子吸水曲線如圖1所示。刺破種皮與完整種皮的藏北嵩草種子吸水變化趨勢相似,都呈現先快速增加后平緩直至穩定飽和的狀態,且在整個吸水階段,刺破種皮種子的吸水率始終大于完整種子。浸種0.5 h后,刺破的種子與完整種子的吸水率增幅最大,吸水率分別達到20%與13%,隨即進入相對較緩的增長階段,浸種4 h后吸水率基本持平,進入吸水的飽和期,兩者吸水率最大分別達到25%與22%。兩種處理的種子在吸水過程中吸水率始終存在差異,但均可在4 h內快速吸水,表明藏北嵩草種皮并不影響水分進入種子內部。
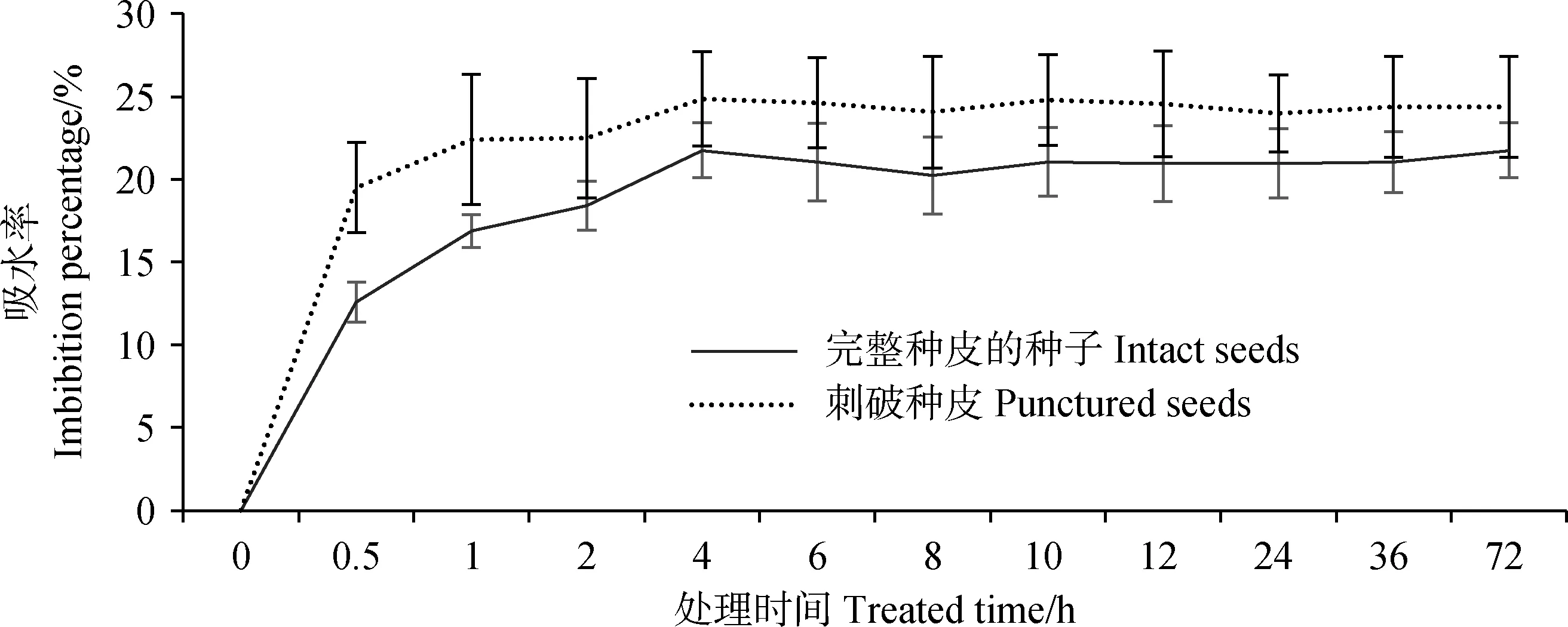
圖1 種皮透性對藏北嵩草種子吸水率的影響Fig.1 Effect of seed coat permeability on dynamics of Kobresia littledalei seed imbibition rate
2.3 種皮透性對藏北嵩草種子生活力測定的影響
種皮透性對藏北嵩草種子生活力測定的影響結果如圖2所示,采用縱切、橫切和刺破種皮處理后,染色率分別為90%,90%和64%,而完整種子在任何染色時長下都無法進行染色,說明藏北嵩草種皮通透性影響了TTC進入種子內部。
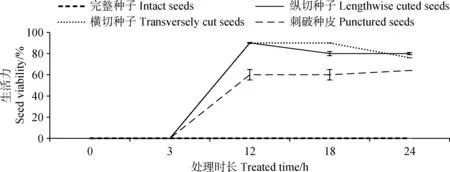
圖2 不同處理對藏北嵩草種子生活力測定的影響Fig.2 Effects of different treatments on seed viability of Kobresia littledalei
2.4 不同濃度NaOH處理對藏北嵩草種子發芽與霉變的影響
圖3顯示,20 g·L-1NaOH處理藏北嵩草種子時,隨處理時長的增加,種子發芽率與發芽勢呈先增加后降低趨勢,處理2 h可達到最高發芽率(84%),發芽勢達到83%。30 g·L-1與40 g·L-1NaOH處理1 h對藏北嵩草種子發芽率與發芽指數促進效果最顯著(P<0.05),發芽率由對照的42%提高到96%與98%,發芽指數由對照的2.20提高到3.90與3.72,,但隨著處理時長的增加,發芽率與發芽指數持續降低。
由圖4可知,各濃度處理下,處理時長為1 h時,霉變率都為0,而40 g·L-1NaOH處理3 h時,霉變率達到最高,為35%。隨NaOH濃度的升高與浸種時間的增加藏北嵩草種子的霉變率增加。
2.5 不同外源植物生長物質單獨作用對藏北嵩草種子發芽的影響
不同濃度、不同種類外源植物生長物質處理對藏北嵩草種子發芽情況影響不同(圖5)。除400 μmol·L-1處理外,在50 ~ 200 μmol·L-1的GA4+7顯著提升藏北嵩草種子的發芽(P<0.05),發芽率分別為56%,55%,56%(對照組為32%)。50 μmol·L-1處理后,種子發芽指數為1.45,與對照(0.96)相比呈現顯著差異(P<0.05)。經過不同濃度GA3處理后,200 μmol·L-1處理有最高發芽率(55%)且與對照組有顯著差異(P<0.05),但對照組與其它各濃度處理間無顯著性差異。PA是GA3的合成抑制劑,各個濃度的PA處理后,種子發芽率、發芽指數均隨著濃度的升高而降低,發芽勢與對照組相比顯著降低(P<0.05)。各濃度的ABA均顯著抑制了種子的發芽率與發芽勢(P<0.05),ABA的合成抑制劑FL在高濃度(≥200 μmol·L-1)時顯著促進了種子的發芽并且400 μmol·L-1的FL還能夠顯著增加種子發芽指數(P<0.05)。各濃度的GA4+7、GA3、FL處理后,種子發芽勢無顯著變化。在藏北嵩草種子發芽的整個過程中,無霉變現象且處理后未發芽的種子生活力之間沒有顯著差異(圖6)。
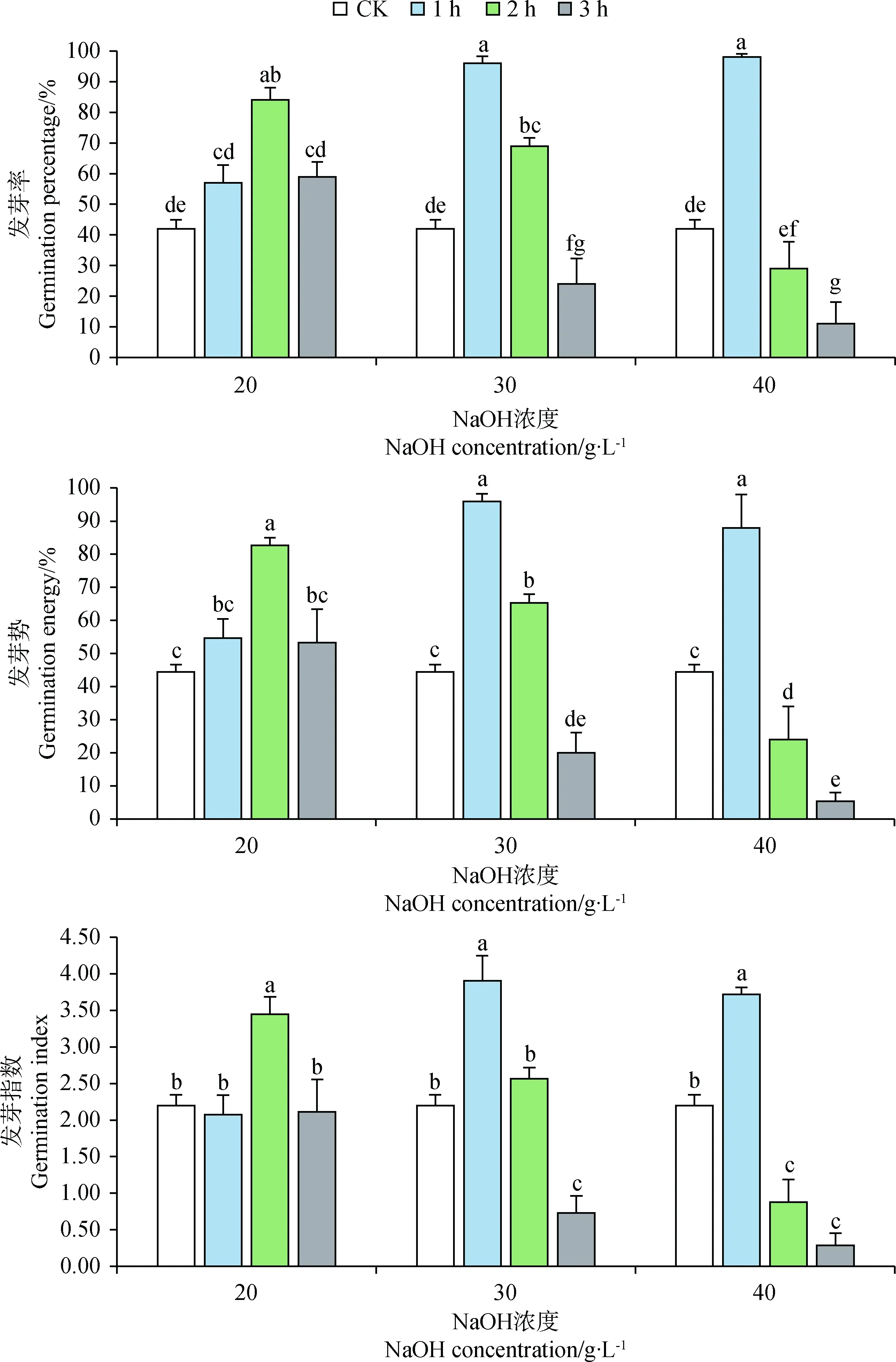
圖3 氫氧化鈉處理對藏北嵩草種子發芽的影響Fig.3 Effects of NaOH with different treatments on seed germination of Kobresia littledalei注:圖中標不同字母表示差異顯著(P<0.05)。下同Note:Different letters in the legends indicate significant difference at the 0.05 level. The same as below
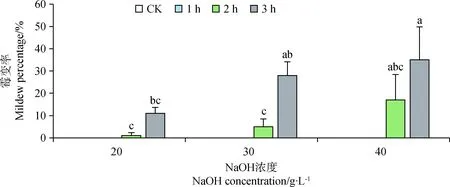
圖4 氫氧化鈉處理對藏北嵩草種子霉變率的影響Fig.4 Effects of NaOH with different treatments on seed mildew percentage of Kobresia littledalei
對發芽試驗后新鮮未發芽種子進行生活力測定后發現,高濃度(≥200 μmol·L-1)GA4+7、100 μmol·L-1與2 00 μmol·L-1GA3,100 μmol·L-1FL,50 μmol·L-1PA處理后種子生活力分別為59%,33%,18%,14%,9%,18%,與對照組(1%)呈顯著差異(P<0.05)。除此之外,所有濃度梯度的ABA處理后種子生活力都與對照組都呈顯著差異(P<0.05)。
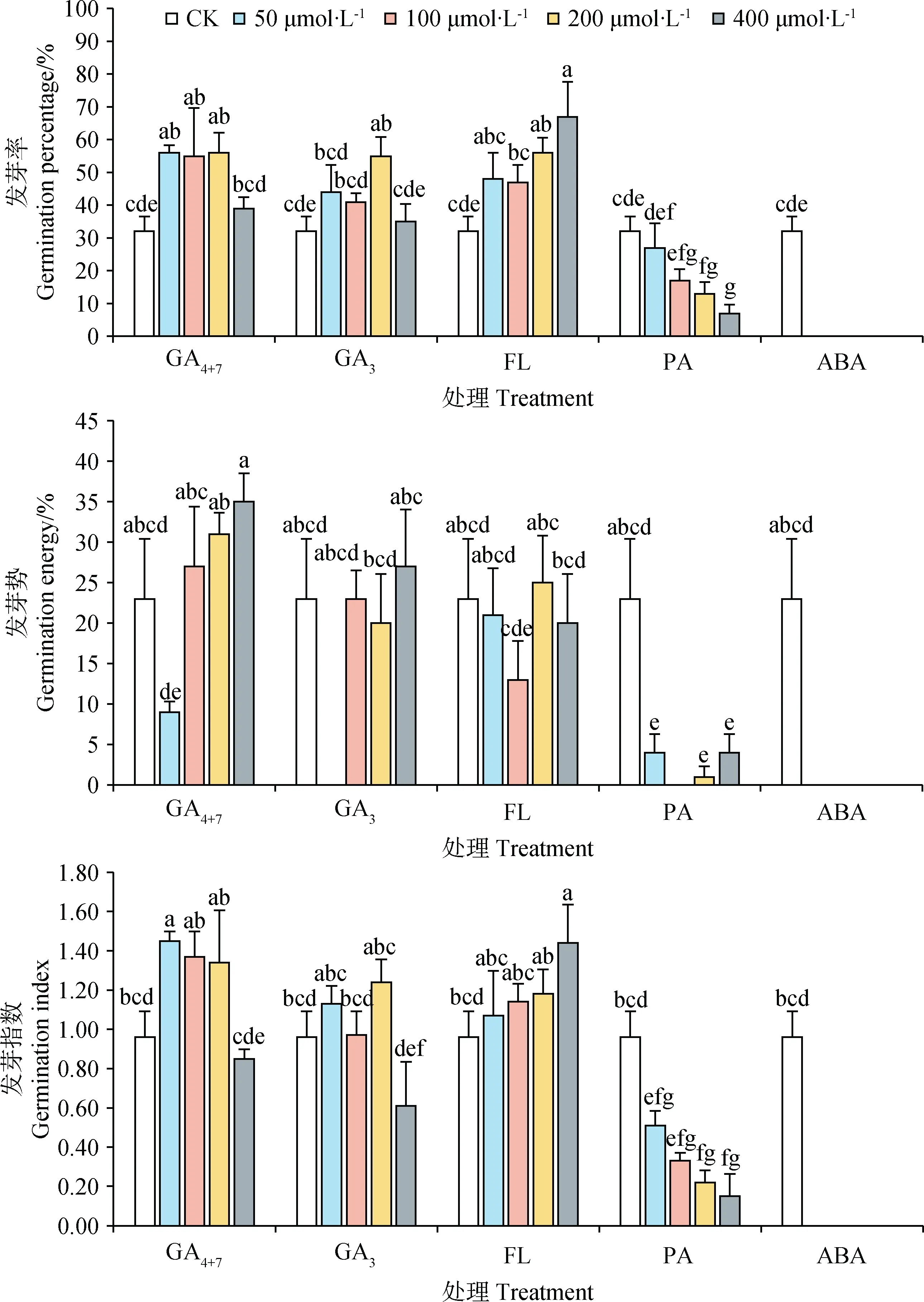
圖5 不同濃度外源植物生長物質單獨處理對藏北嵩草種子發芽的影響Fig.5 Effects of different plant exogenous growth substances at different concentrations on seed germination of Kobresia littledalei
2.6 不同濃度外源植物生長物質相互作用對藏北嵩草種子發芽的影響
由圖7可知,GA3+ABA與ABA+FL處理后藏北嵩草種子發芽率與發芽勢接近于0,顯著低于對照組(P<0.05),與ABA單獨作用于藏北嵩草種子的結果相似,而GA3,FL單獨作用時,藏北嵩草種子發芽率顯著提升(P<0.05),但發芽勢與對照組相比無顯著變化,且GA3+FL顯著提升種子發芽率(P<0.05)。GA3+FL處理的發芽率、發芽指數與對照組無顯著差異,而GA3+PA、FL+PA處理的發芽率與對照組無顯著差異,發芽指數卻顯著降低(P<0.05)。PA單獨處理后發芽率為13%,與對照(33%)有顯著差異(P<0.05),而GA3+PA處理后發芽率為36%,與對照無顯著差異。由圖8可知,ABA單獨處理后種子生活力為36%,GA3+ABA處理的種子生活力為25%,兩者都與對照組(1%)相比有顯著差異(P<0.05)。
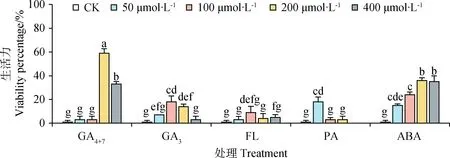
圖6 不同濃度外源植物生長物質單獨處理對藏北嵩草新鮮未發芽種子生活力的影響Fig.6 Effects of different plant exogenous growth substances at different concentrations on ungerminated seed viability of Kobresia littledalei
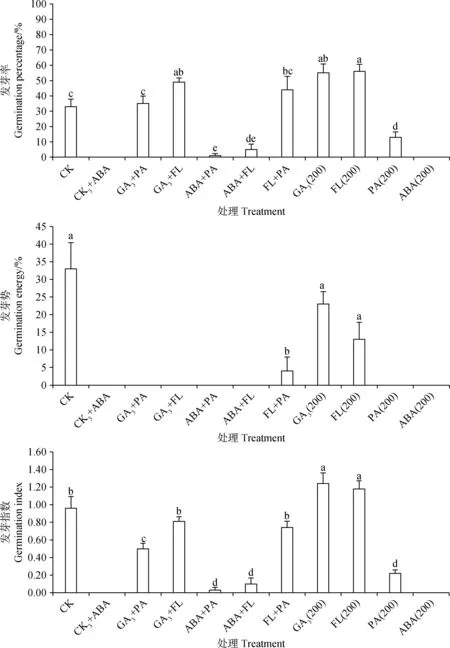
圖7 不同外源植物生長物質互作處理對藏北嵩草種子發芽的影響Fig.7 Effects of different plant exogenous growth substance combinations on seed germination of Kobresia littledalei
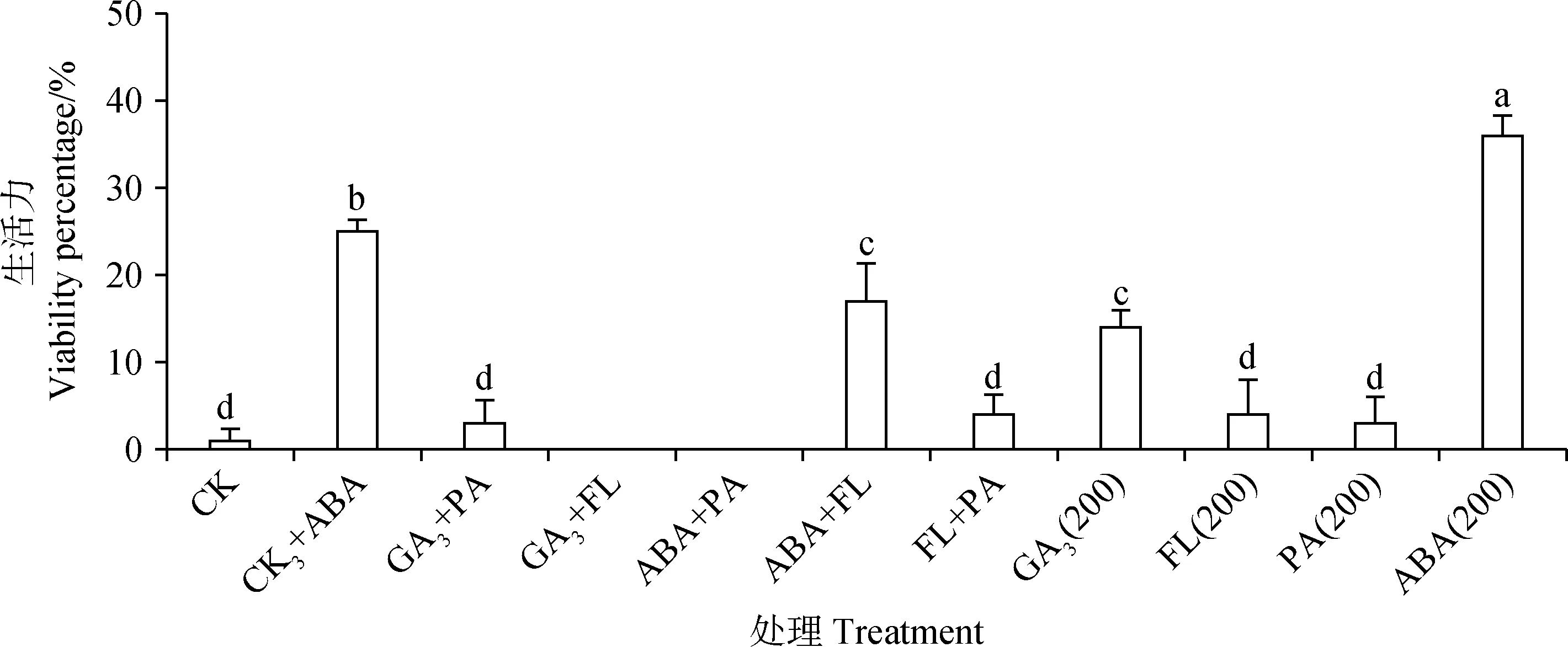
圖8 不同外源植物生長物質互作處理對藏北嵩草新鮮未發芽種子生活力的影響Fig.8 Effects of different plant exogenous growth substance combinations on ungerminated seed viability ofKobresia littledalei
3 討論
根據Baskin和Baskin對種子休眠體系的劃分[15],種子休眠可劃分為物理休眠、生理休眠、形態休眠、形態生理休眠和復合休眠5種類型。本研究發現刺破種皮處理比完整種子吸水率更高且前期吸水速率也更快,但都可以吸水,表明種皮透水并不是影響藏北嵩草休眠的因素,即藏北嵩草種子不屬于物理休眠。生活力測定結果表明藏北嵩草種子具有高生活力,存在較大的發芽潛力。使用NaOH處理藏北嵩草種子后,能夠使種子發芽率高達98%,說明種胚已經發育完全,表明種子不具有形態休眠,屬于生理性休眠。
藏北嵩草種子采自青藏高原,因為自然環境的原因,種子有堅硬致密的果皮,有利于其適應當地惡劣環境,同時也阻礙了胚根突破種皮,限制了種子的發芽[16]。NaOH處理能夠增加種子的發芽率,可能是由于強堿自身的腐蝕性作用使種皮的透性改變,減輕或消除種皮阻力,使胚根更容易的突破種皮,同時能夠將種子本身抑制發芽的物質外漏,使種子加快發芽。湯前等[17]在稗草(Echinochloacrusgalli)種子發芽的研究中發現,用20%NaOH處理種子,發芽率從2.22%提高到58.33%。王薇[18]研究發現結縷草(ZoysiajaponicaSteud.)種子經NaOH處理后可縮短發芽時間,提高發芽率。本研究40 g·L-1NaOH處理藏北嵩草種子1 h發芽率可達98%,可見NaOH能有效破除藏北嵩草種子休眠。低濃度(20 g·L-1)時,隨著處理時間的增加,發芽率隨之增加,但未產生霉變率;但高濃度(30 g·L-1,40 g·L-1)處理后,隨著處理時長的增加發芽率降低,霉變率升高。不難看出,NaOH對于藏北嵩草種子的發芽雖有顯著促進作用但高濃度與長時間的處理也會增加其霉變率,這可能是由于浸種過程中種子自身含有的如酚類、黃酮類等化合物被淋洗出,而使得對微生物的抵抗能力減弱,進而表現出較高霉變率,這些化合物可能也是種子的內源發芽抑制物[19]。因此,選擇合適的NaOH濃度與處理時長是非常必要的。
在維持種子休眠進而抑制種子發芽的過程中,ABA的作用至關重要[20]。田迅等[21]研究得出20 ~ 60 mg·L-1濃度的ABA對少花蒺藜草(CenchruspauciflorusBenth.)種子發芽有最大抑制作用的結論。黃曉輝等[22]在研究中發現低濃度(<200 μmol·L-1)外源ABA對羊草(Leymuschinensis(Trin.) Tzvel.)種子休眠和發芽無影響,高濃度(>200 μmol·L-1)顯著抑制其發芽。本試驗發現外源ABA對種子發芽及外源FL、GA3有抑制作用,這可能是由于ABA對種子休眠的誘導作用可通過赤霉素逆轉[23]。
赤霉素能解除種子休眠,使已經結束休眠的種胚生長,能激活植物基因,控制酶蛋白的合成和酶的分泌,從而促進代謝反應可對受到破壞的細胞膜進行修復[24]。鄒竣竹[25]通過1 500 mg·L-1GA3浸種處理野牛草(Buchloedactyloides)種子可顯著促進種子發芽率與發芽速度,并且激素浸種對野牛草幼苗可溶性蛋白的含量有一定的抑制作用。羅富成等[26]用400 mg·L-1GA3溶液將納羅克非洲狗尾草(Setariasphacelatacv. Narok) 浸種24 h,種子各項活力指標均顯著高于對照。Ma等[27]研究發現濃度小于50 μmol·L-1GA3顯著提高羊草種子發芽,濃度大于50 μmol·L-1GA3會降低對羊草種子發芽的促進作用。本研究發現200 μmol·L-1GA3能顯著提升種子發芽率,但GA4+7在50 ~200 μmol·L-1的濃度范圍內都可提升種子發芽率,顯而易見的是GA4+7顯著作用的濃度范圍比GA3的更廣,這可能是因為GA4+7的分子極性更好。這一點與何學青等[28]研究發現GA4+7的分子極性更好,更容易進入柳枝稷(PanicumvirgatumL.)內部,促進柳枝稷發芽的研究結果相似。同時,GA3+FL處理的發芽率、發芽指數與對照組無顯著差異,而GA3+PA處理的發芽率與對照組無顯著差異,發芽指數卻顯著降低,說明此處理不影響種子發芽率但會使種子活力降低。
本研究發現當PA濃度大于等于200 μmol·L-1時顯著抑制藏北嵩草發芽,GA3+PA處理后發芽率與對照無顯著差異,表明了PA的抑制作用可被外源GA3逆轉[29-31],種子休眠與否不僅與內源激素的絕對含量多少有關,還與種子中各激素之間的含量比值有關,休眠的關鍵是平衡關系。就如ABA促進休眠,GA3解除休眠,兩者存在拮抗作用,近來研究表明兩者相互抑制對方的代謝和信號基因,并且兩個植物激素還抑制的其他生物合成[32-33]。張韻等[34]研究發現,外源ABA和GA3浸種處理均能顯著緩解不同濃度NaCl對黃瓜(CucumissativusL.)種子發芽的抑制作用。本研究使用GA3與ABA互作處理發現種子發芽率為零,這可能是GA3與ABA的之間的平衡關系未能打破種子的休眠,它們之間適宜的相對含量還有待進一步研究。
本試驗對于不同處理后測定新鮮未發芽種子的生活力結果顯示,ABA單獨處理后,新鮮未發芽種子休眠率為36%,GA3+ABA處理的種子休眠率為25%,ABA+FL處理后種子的休眠率為17%,以及高濃度(≥200 μmol·L-1)GA4+7,100 μmol·L-1與200 μmol·L-1GA3、100 μmol·L-1FL,50 μmol·L-1PA、所有濃度梯度的ABA處理后種子休眠率均較對照(1%)顯著增加。我們通過初始生活力測定結果顯示種子具有高生活力且種子具有良好的透水性,但由于未測定其透氧性,因此可能是因為藏北嵩草種子種皮有良好的透水性但透氧性較弱,在高濕環境下由于種子的呼吸作用消耗氧氣導致種子失活,加入外源生長物質能夠調節種子生理功能,使藏北嵩草種子較對照組保持胚的活性。
4 結論
藏北嵩草種子屬于生理休眠,40 g·L-1的NaOH處理種子1 h能有效打破種子休眠,種子發芽率可達98%;400 μmol·L-1FL是藏北嵩草發芽較為適宜的外源生長物質濃度;單獨施加適宜濃度的赤霉素(GA3、GA4+7),氟啶酮(FL),脫落酸(ABA),多效唑(PA)及GA3+ABA、ABA+FL等外源植物生長物質均有利于保持藏北嵩草種胚的活性。

