容積定量動態增強MRI在預測宮頸鱗癌淋巴脈管間隙浸潤中的應用研究
白志強,史潔,段小慧,沈君*
宮頸癌是女性第4常見的惡性腫瘤,嚴重威脅著女性的身心健康[1]。宮頸癌的病理分型中,鱗狀細胞癌約占80%。腫瘤淋巴脈管間隙浸潤(lymph vascular space invasion,LVSI)反映了腫瘤的侵襲性,是宮頸癌轉移和復發的危險因素[2],LVSI陽性患者和陰性患者的5年生存率及平均存活時間有顯著差異。而且有無LVSI對早期患者的手術方式及術后支持治療的方案選擇有重要指導意義。目前,LVSI的診斷需通過術后病理檢測,而采用影像學檢查指標預測LVSI的報道少見。動態增強磁共振成像(dynamic contrast-enhanced MRI,DCE-MRI)能提供反映腫瘤組織微觀血流動力學的半定量和定量參數,這些參數能反映腫瘤的血管生成,而血管生成在腫瘤的發生、進展中起著重要作用。因此,DCE-MRI的半定量和定量參數具有預測腫瘤侵襲性的潛力。本研究收集25例宮頸鱗癌患者進行DCEMRI檢查,探討DCE-MRI的半定量和定量參數在預測宮頸鱗癌LVSI中的價值。
1 材料與方法
1.1 一般資料
回顧性分析2017年7月至2018年3月中山大學孫逸仙紀念醫院宮頸癌患者的DCE-MRI檢查資料。病例入選標準:(1)初診患者,無化療、放療史;(2)進行根治性手術切除治療;(3)手術病理證實為鱗狀細胞癌。排除標準:(1)國際婦產科聯盟(international federation of gynecology and obstetrics,FIGO)分期為IA期;(2)未進行手術治療者;(3)DCE-MRI圖像運動偽影嚴重而影響DCE參數測量者。共收集64例宮頸癌患者,其中35例根治性手術,35例中術后病理證實為鱗癌者30例。30例宮頸鱗癌中,4例FIGO分期為IA期,1例DCE-MRI圖像運動偽影嚴重,予以排除。最后,25例宮頸癌患者納入分析,其中IB1期14例,IB2期5例,IIA1期3例,IIA2期3例;年齡31~70歲,平均年齡(50.0±9.6)歲。25例患者主要癥狀為陰道不規則流血或絕經后陰道出血。所有患者均在知情同意下完成檢查并且簽署知情同意書。
1.2 MRI檢查
MRI檢查采用荷蘭Philips 3.0 T超導磁共振掃描儀(Gyroscan Achieva 3.0 TX),檢查序列包括常規序列:①橫斷位T1加權快速自旋回波序列(turbo spin echo T1 weighted imaging,TSE-T1WI):TR=573 ms,TE=8 ms,回波鏈長度(echo train length,ETL)=5,FOV=220 mm×220 mm,矩陣=276×236,層厚=4 mm,層間距=1 mm,層數=24,信號平均次數(number of signal average,NSA)=2;②橫斷位TSE-T2WI序列:TR=3000 ms,TE=100 ms,ETL=22,FOV=150 mm×150 mm,矩陣=248×199,層厚=4 mm,層間距=1 mm,層數=24,NSA=3;③矢狀位TSE-T2WI序列:TR=3000 ms,TE=100 ms,ETL=20,FOV=240 mm×240 mm,矩陣=240×240,層厚=4 mm,層間距=1 mm,層數=15,NSA=2。
常規平掃完成后進行DCE-MRI掃描,首先進行多翻轉角橫斷位TRHIVE (T1 high resolution isotropic volume excitation)序列掃描,TR=3.1 ms,TE=1.42 ms,FOV=360 mm×250 mm,矩陣=144×100,層厚=3 mm,層間距=0 mm,層數=40,NSA=1,翻轉角分別取2°、4°、6°、8°、10°和12°;多翻轉角平掃完成后進行DCE-MRI序列掃描,主要參數與多翻轉角平掃序列相同,翻轉角=12°,120個動態期相,時間分辨率為3 s。檢查前建立靜脈通道留置針,在第4個動態掃描完成后使用高壓注射器團注對比劑Gd-DTPA-BMA (歐乃影,GE醫療集團,愛爾蘭),劑量為0.1 mmol/kg,速率為3 mL/s,對比劑注射完畢后采用相同速率注射生理鹽水20 mL。
1.3 圖像處理及分析
DCE-MRI數據傳輸至離線工作站,運用定量分析軟件(Omni-Kinetics,GE Healthcare)進行圖像處理。首先進行圖像運動校正,再利用多翻轉角成像數據進行T1-mapping計算,將感興趣區(region of interest,ROI)放置于髂內動脈的中心獲得動脈輸入函數,然后采用Extended Tofts Linear血流動力學模型擬合DCEMRI數據,獲得反映腫瘤血流灌注的半定量及定量參數,其中定量參數有:容積轉移常數(volume transfer constant,Ktrans),單位為min-1;返流速率常數(efflux rate constant,Kep),單位為min-1;細胞外血管外體積分數(extracellular-extravascular volume fraction,Ve);血漿體積分數(plasma volume fraction,Vp)。半定量參數有:達峰時間(time to peak,TTP),單位為min;最大斜率(maximum slope,MaxSlope),單位為mmol/(min·L);濃度-時間曲線下面積(area under curve,AUC),單位為mmol·min/L;最大濃度(maximum concentration,MaxCon),單位為mmol/L。腫瘤DCEMRI參數測量時,在宮頸癌原發病灶上逐層繪制ROI,將獲取的二維ROI融合為三維ROI,繪制ROI時避開腫瘤壞死和囊變區,盡量覆蓋腫瘤全部實質部分,獲得腫瘤的半定量和定量DCE-MRI參數。
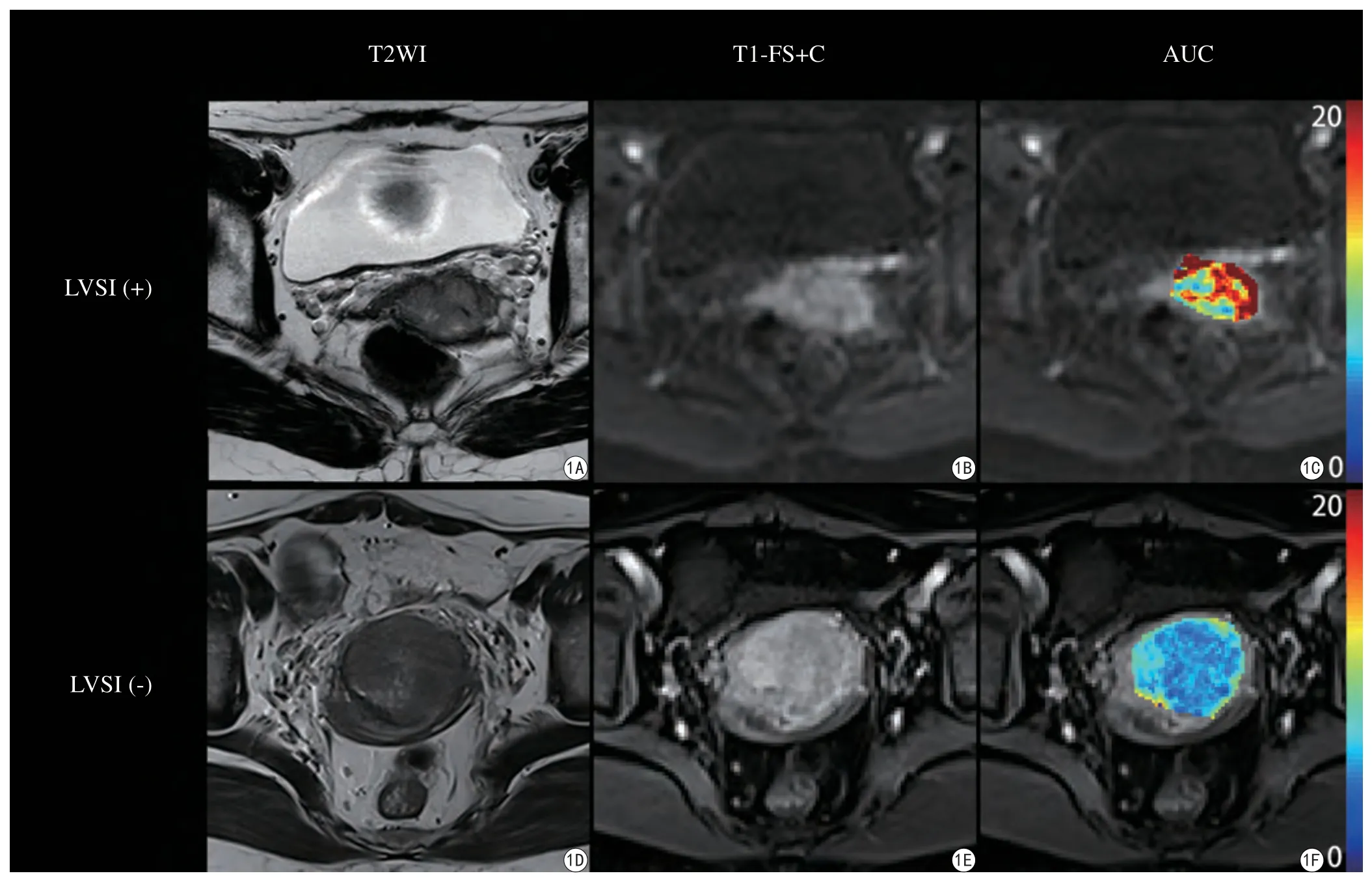
圖1 宮頸癌患者。A~C:女性,41歲,IIA期,術后病理證實為LVSI陽性;D~F:女性,53歲,IB期,術后病理證實為LVSI陰性。從左至右依次為橫斷T2WI、橫斷位脂肪抑制增強T1WI(T1+C+FS)、AUC偽彩圖。LVSI陽性患者AUC為7.247,LVSI陰性患者AUC為0.741Fig. 1 A—C: A 41-year-old woman with cervical cancer which staged IIA, LVSI was proved positive by surgical pathology; D—F: A 53-year-old woman with cervical cancer which staged IB, LVSI was proved negative by surgical pathology. From left to right are transversal T2WI, fat-suppressed contrast-enhanced T1WI (T1+C+FS) and pseudo-colorized map of AUC. The AUC of LVSI positive and negative cases are 7.247 and 0.741, respectively.
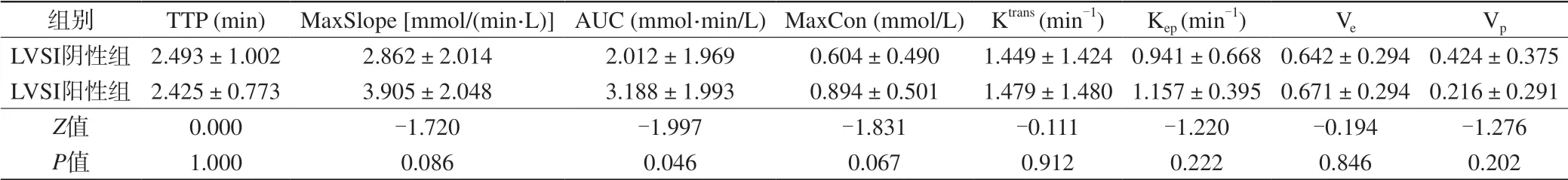
表1 LVSI陰性組和陽性組DCE-MRI各參數的組間比較Tab. 1 Comparisons of DCE-MRI parameters between LVSI negative group and positive groups
1.4 LVSI病理診斷
25例患者進行手術切除,切除的腫瘤進行常規病理檢測,根據病理報告記錄有無LVSI。LVSI是指顯微鏡下在扁平的內皮細胞圍繞成的間隙中存在至少一簇腫瘤細胞。其診斷標準為受累血管周圍存在淋巴細胞浸潤且浸潤灶臨近其他血管,腫瘤內的LVSI灶予以排除[3]。
1.5 統計學處理
采用SPSS 17.0(Chicago,Ill,USA)統計學軟件進行統計學分析。定量資料采用平均值±標準差表示。采用Mann-Whitney U秩和檢驗比較各參數在LVSI陰性組和陽性組間的差異,利用受試者工作特征(receiver operating characteristic,ROC)曲線分析差異有意義的參數的預測效能。采用雙側檢驗,檢驗水準α=0.05,P<0.05為差異有統計學意義。
2 結果
25例患者中LVSI陰性15例,陽性10例。LVSI陰性組及陽性組DCE-MRI參數組間比較見表1。LVSI陰性組和陽性組的AUC分別為2.012±1.969和3.188±1.993,AUC在兩組之間的差異有統計學意義(P=0.046)(圖1)。其余各參數在兩組間的比較差異無統計學意義(P>0.05)。AUC預測宮頸鱗癌LVSI的ROC (圖2)曲線下面積為0.740,取臨界值為1.258,AUC預測宮頸鱗癌LVSI的準確率為0.760,敏感性為0.900,特異性為0.667。
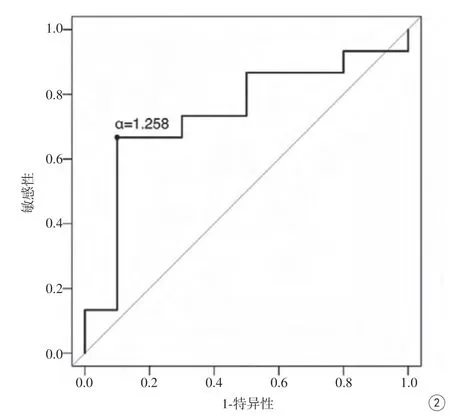
圖2 AUC預測LVSI的ROC曲線Fig. 2 ROC curve of AUC predicting LVSI.
3 討論
3.1 LVSI對宮頸癌患者預后和治療方案的重要影響
宮頸癌為女性常見的惡性腫瘤,其中鱗狀細胞癌最為常見。LVSI的有無對患者的預后和治療有重要影響。根據FIGO報道[4],對于臨床分期為Ⅰ~Ⅱ期的宮頸癌患者,LVSI陽性者5年生存率為79.5%,陰性者為91.3%。對于臨床分期為Ⅲ~Ⅳ期的宮頸癌患者,LVSI陽性者5年生存率為25.4%,陰性者為34.0%。Xie等[5]研究表明,LVSI陽性的早期患者平均存活時間比陰性患者短約1年5個月。此外,LVSI陽性是淋巴結轉移的危險因素[6-7]。現行美國國立綜合癌癥網絡指南指出,對于有生育要求的IA期LVSI陰性患者,可行單純切除術或錐切,若LVSI陽性,則應同時行淋巴結清掃[8]。Sedlis標準對宮頸癌患者術后是否行放療有重要的指導意義[9],而LVSI是構成Sedlis標準的一個指標,故LVSI對宮頸癌患者的后續治療有重要的指導意義。
3.2 目前LVSI的評價方法及局限
LVSI是指顯微鏡下在扁平的內皮細胞圍繞成的間隙中存在至少一簇腫瘤細胞,因此,LVSI需要依靠術后組織病理學檢測才能明確。目前,評價LVSI的影像學手段十分少,Lee等[10]利用PET/CT評價LVSI,發現LVSI陰性組和陽性組的最大標準攝取值(SUVmax)不同,PET/CT有助于術前評價LVSI。但PET/CT檢查價格昂貴且有輻射性,故難以普及。CT及MRI手段用于評估LVSI尚未見報道。
3.3 容積定量DCE-MRI評估LVSI的價值
DCE-MRI不僅可以提供豐富的解剖信息,而且能提供反映腫瘤血管生成情況的功能信息。血管生成與腫瘤的發生和進展密切相關,因此理論上,DCE-MRI半定量和定量參數具有預測腫瘤侵襲性的能力。本研究首次利用宮頸癌原發病灶的DCE-MRI參數來預測宮頸癌LVSI,發現LVSI陽性組原發腫瘤的AUC高于LVSI陰性組,AUC預測宮頸鱗癌LVSI的準確率可達0.760。
AUC是反映在給定時間內進入并且滯留于腫瘤組織的對比劑總量。研究表明,AUC與腫瘤的血流灌注、血管通透性和間質體積等病理特征有密切關系[11]。該參數具有穩定性好、不依賴于模型假設和容易獲取等優勢[12]。Thomassin-Naggara等[13]研究表明,AUC可用于鑒別卵巢附件區良惡性腫瘤,惡性腫瘤的AUC大于良性腫瘤。Li等[14]利用該參數評價乳腺癌患者的預后,并認為AUC大者預后差。還有學者[15]利用DCE-MRI參數評價抗血管生成藥物對腫瘤的療效,認為AUC的下降可作為藥物有效的指征。葉裕豐等[16]認為,與正常宮頸和子宮肌瘤相比,宮頸癌時間-信號強度曲線上升支斜率更大,達峰時間更短,平臺持續時間更長。上述研究表明AUC與腫瘤的侵襲性呈正相關。其原因可能是侵襲性越高的腫瘤新生血管越豐富、微血管通透性越大,而新生血管雜亂無章并相互交通,對比劑排出緩慢。宮頸癌原發腫瘤的AUC越大,其侵襲性越高,可能更容易發生LVSI。
本研究發現LVSI陽性及陰性組Ve無差別。Ve反映的是細胞外血管外間隙的容積分數,受細胞密度、微血管滲透性、壞死、囊變以及細胞外基質等多種因素的影響,Ve受這些因素影響不穩定。隨著腫瘤惡性程度的增高,Ve值可增加或降低。與Ve相比,AUC穩定性好,且反映的是血流灌注、血管通透性和間質體積等病理指標的綜合結果。另一方面,本研究中Ve在LVSI陰性組和陽性組間差異無統計學意義,可能的原因是LVSI陰性組和陽性組均為宮頸惡性腫瘤,故差異不顯著。
3.4 本研究的局限性
本次研究存在如下局限性:①本研究病例數相對較少。原因在于較多的宮頸癌病例在確診時已無法手術,另有相當一部分早期宮頸癌患者采取根治性放療,而進行手術切除的病例數較少;②本研究結果除AUC差異有統計學意義外,其余DCE-MRI參數包括Ve,在LVSI陽性及陰性兩組間差異并無統計學意義,原因可能與本研究納入的樣本量還較少有關,需要今后收集更多病例進行深入研究。
綜上所述,本研究發現LVSI陽性的宮頸鱗癌其AUC高于LVSI陰性宮頸鱗癌,AUC預測宮頸鱗癌LVSI的準確率為0.760,qDCE-MRI半定量參數AUC可有效預測宮頸鱗癌的LVSI,為宮頸癌治療方案的制訂提供參考。
利益沖突:無。

