Notch信號通路經ROCK2對缺氧/復氧誘導H9c2心肌細胞凋亡的影響
易松 楊丹 幸志強
[摘要] 目的 探討Notch信號通路經ROCK2對大鼠心肌細胞缺氧/復氧誘導H9c2心肌細胞的凋亡影響。 方法 選擇SD大鼠乳鼠180只,分為6組,檢測Hes1的表達、心肌細胞活力、心肌細胞乳酸脫氫酶釋放情況、心肌細胞凋亡情況以及NICD、Bcl2、Caspase3以及Hes1表達水平。 結果 SI/R組OD值相比對照組明顯下降(P<0.05);Jagged1+SI/R組與SI/R組、對照組對比,存在明顯差異(P<0.05);Jagged+DAPT+SI/R組OD值與Jagged1+SI/R組對比,存在明顯差異(P<0.05);Jagged1組、DAPT組OD值與對照組對比,均未見顯著差異(P>0.05)。SI/R組、Jagged1+SI/R組、Jagged+DAPT+SI/R組的LDH釋放率、細胞凋亡率相比對照組均有明顯上升(P<0.05);SI/R組、Jagged1+SI/R組、Jagged+DAPT+SI/R組經處理后的Notch1、Hes1、Bcl2均有顯著下降,而Caspase3表達顯著上升(P<0.05)。結論 Notch 信號通路在心肌缺血/再灌注的過程中發揮著重要調控作用,對誘導H9c2心肌細胞凋亡具有重要影響,且激活Notch信號通路能起到抗缺血/再灌注損傷的效果。
[關鍵詞] Notch信號通路;ROCK2;心肌缺血/再灌注;H9c2心肌細胞凋亡
[中圖分類號] R363? ? ? ? ? [文獻標識碼] A? ? ? ? ? [文章編號] 1673-9701(2019)10-0038-04
Effect of Notch signaling pathway on apoptosis of H9c2 cardiomyocytes induced by hypoxia/reoxygenation by ROCK2
YI Song? ?YANG Dan? ?XING Zhiqiang
Department of Cardiology, Yichun People's Hospital in Jiangxi Province, Yichun? ?336000, China
[Abstract] Objective To investigate the effect of Notch signaling pathway on the apoptosis of H9c2 cardiomyocytes induced by hypoxia/reoxygenation in rat cardiomyocytes via ROCK2. Methods A total of 180 SD neonatal rats were selected as the study materials and divided into 6 groups. The expression of Hes1, myocardial cell viability, release of cardiomyocyte lactate dehydrogenase, cardiomyocyte apoptosis and NICD, Bcl2, Caspase3 and Hes1 expression levels were detected. Results The OD value of SI/R group was significantly lower than that of the control group(P<0.05), the OD value of Jagged1+ SI/R group was significantly different from that of the SI/R group and the control group(P<0.05). There was significant difference in the OD value between Jagged+DAPT+SI/R group and the Jagged1+SI/R group(P<0.05). There was no significant difference in the OD value between the control group and Jagged1 group, the DAPT group(P>0.05). The LDH release rate and apoptosis rate of SI/R group, Jagged1+SI/R group and Jagged+DAPT+SI/R group were significantly higher than those of the control group(P<0.05). The levels of Notch1, Hes1 and Bcl2 in the SI/R group, Jagged1+SI/R group and Jagged+DAPT+SI/R group were significantly decreased, while the expression of Caspase3 was significantly increased(P<0.05). Conclusion Notch signaling pathway plays an important role in the regulation of myocardial ischemia/reperfusion, and has an important effect on the induction of H9c2 cardiomyocyte apoptosis. Activation of Notch signaling pathway can inhibit ischemia/reperfusion injury.
[Key words] Notch signaling pathway; ROCK2; Myocardial ischemia/reperfusion; H9c2 cardiomyocyte apoptosis
缺血性心臟病是當前一類嚴重危害人類身體健康的疾病。在我國,有超過2000萬缺血性心臟病患者,且每年以100萬例的速度在不斷增長[1-2]。此類患者可通過溶栓治療、經皮導管冠脈介入術治療(PCI)等方法以恢復心肌血液供應[3]。但臨床發現,缺血心肌組織在重新恢復血液供應后,常出現繼發、加重心肌組織的損傷現象,即易發生缺血/再灌注損傷。對于心肌組織的缺血/再灌注,受多信號通路以及細胞因子的影響,是一項復雜的生物反應過程。當前對于心肌組織的缺血/再灌注相關的信號轉導通路研究是一項重點研究內容。研究通過Notch信號通路作為切入點,通過動物實驗建立大鼠乳鼠心肌細胞缺血/再灌注模型,探討Notch信號通路經ROCK2對大鼠心肌細胞缺氧/復氧誘導H9c2心肌細胞的凋亡影響。
1 材料與方法
1.1 實驗動物
選擇由本院實驗動物中心提供SD大鼠乳鼠180只,納入乳鼠雌雄不拘,育齡1~2 d,體重1.3~1.8 g,批號:20160221。
1.2主要試劑
DMEM細胞培養基、胎牛血清均為美國Gibco公司生產;膠原酶Ⅰ、HEPES、5-溴脫氧尿苷、2-deoxy-D-glucose、5-二苯基四氮唑嗅鹽、3-(4,5-二甲基噻唑-2)-2、MTT均為美國Sigma公司生產;兔抗人Caspase3抗體、兔抗人Bcl2抗體均為美國Cell signaling公司生產;兔抗人Notch1單克隆抗體為美國Abcom公司生產;Notch信號通路的特異性抑制劑DAPT由德國Merck公司生產;激活Notch信號通路的重組大鼠Jagged1蛋白由美國R&D公司生產;LDH-釋放檢測試劑盒由南京建成生物制劑公司生產;TUNEL-凋亡檢測試劑盒由德國Roche公司生產。
1.3 主要儀器
超凈工作臺;CO2細胞培養箱;Olympus倒置顯微鏡;ZW-A微量振蕩器;低轉速離心機;Olympus熒光顯微鏡。
1.4 方法
(1)培養乳鼠原代心肌細胞。應用醫用酒精對SD大鼠乳鼠進行消毒后,于超凈工作臺內無菌條件取下小鼠心臟,置于PBS中剪碎,在添加膠原酶Ⅰ的PBS進行3次重復消化,每次持續5 min。將獲得細胞懸液置于DMEM(含有10%血清)中,經1000 r/min離心處理5 min,棄去上清,通過血清培養基進行細胞重懸處理,經培養箱培育后通過差速貼壁法對心肌細胞進行純化,獲得純化心肌細胞中添加Brdu,以抑制成纖維細胞的增長。心肌細胞接種至6、24、96孔培養板,加入載玻片進行免疫熒光檢測。
(2)建立乳鼠心肌細胞SI/R模型。參考文獻報道[4]的模型建立方法建立心肌細胞SI/R損傷模型。再灌注條件:正常DMEM,經37℃孵育處理4 h。于倒置顯微鏡下對心肌細胞形態變化進行觀察。
(3)試驗分組。將180只小鼠均分為6組,每組30只。6組分別為一般對照組、SI/R組、Jagged1+SI/R組、Jagged+DAPT+SI/R組、DAPT組以及Jagged1組。一般對照組應用正常DMEM進行7 h培養;SI/R組經正常培養1 h+模擬缺血培養2 h+正常DMEM再灌注處理4 h;Jagged1+SI/R組經添加Jagged1(6.8 μM)DMEM孵育1 h+模擬缺血培養2 h+正常DMEM再灌注處理4 h;Jagged+DAPT+SI/R組經添加DAPT(31.25 nM)以及Jagged1(6.8 μM)DMEM孵育1 h+模擬缺血培養2 h+正常DMEM再灌注處理4 h;DAPT組應用添加DAPT(31.25 nM)DMEM孵育1 h+正常DMEM孵育6 h;Jagged1組應用添加Jagged1(6.8 μM)孵育1 h+正常DMEM孵育6 h。
(4)各組心肌細胞活力檢測。各組分組處理后,每孔添加10 μL 的MTT溶液,置于37℃下孵育4 h,每孔再添加100 μL二甲基亞砜,震蕩處理15 min。置于酶標儀490 nm波長下檢測各孔的光密度值(OD)。
(5)心肌細胞乳酸脫氫酶釋放試驗。收集各組細胞培養液置于4℃冰箱中保存。給細胞添加相同體積裂解液,收集處理后的裂解液,于4℃下離心處理獲得上清液,對培養液與裂解液中的心肌細胞乳酸脫氫酶(LDH)活性進行檢測,計算樣本LDH的釋放量。其中,LDH釋放量=培養液中LDH測定值/(培養液、裂解液的LDH測定總值)×100%。
(6)心肌細胞凋亡的檢測。在進行接種前,將蓋玻片置于培養孔中進行爬片細胞的培養;實驗結束后取出蓋玻片,經濃度100%的冷丙酮置于-20℃下固定20 min,自然晾干。心肌細胞凋亡的檢測參考試劑盒的說明書進行操作。檢測后置于熒光顯微鏡下觀察細胞凋亡的情況,以細胞核當中存在綠色熒光顆粒記錄為TUNEL染色陽性,即該細胞為凋亡細胞,對每張切片均隨機取5個及以上高倍視野,計算心肌細胞核的凋亡率。其中,凋亡率=(觀察凋亡細胞數/總細胞數)×100%。
(7)Notch1、Hes1、Bcl2以及Caspase3表達的檢測。取小鼠心肌組織100 mg,置于勻漿器中,添加組織裂解液進行勻漿,于冰上孵育處理1 h。孵育后經1200 r/min離心處理15 min,取上清液。取部分用BCA法對蛋白質進行定量分析,留取部分上清液添加5X上樣緩沖液經沸水蒸煮處理7 min獲得蛋白質樣品。依據第三版《分子克隆》制備蛋白電泳凝膠,控制電壓80 V,于甘氨酸電泳緩沖液當中電泳90 min。電泳結束后裝配轉膜裝置進行轉膜處理60~120 min,應用去離子水將硝酸纖維素膜進行沖洗并置入麗春紅中5 min,應用去離子水沖洗,標記蛋白marker相應條帶。剪下32 KD的Hes1、42 KD(β-actin)、120 KD的NICD膜。經5%的脫脂奶粉封閉處理1 h,加入Hes1一抗(1:1000稀釋)、β-actin一抗(1:2000稀釋)、ICD一抗(1:1000稀釋),室溫下孵育處理1 h。經TBST洗膜2次以及TBS洗膜1次,加入二抗(1:1000稀釋),室溫下孵育處理1 h,經TBST洗膜2次以及TBS洗膜1次,ECL發光液曝光,分析蛋白相對表達量。
1.5 統計學方法
應用SPSS 16.0統計軟件處理數據。各組Western blotting的信號強度以對照組為基礎強度,強度100%,檢測計量資料以均數±標準差(x±s)描述,進行方差分析,組間兩兩對比行LSD-t檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 各組心肌細胞活力(OD值)檢測結果
一般對照組的心肌細胞OD值為(0.73±0.09);SI/R組OD值為(0.41±0.07),相比對照組明顯下降(P<0.05);Jagged1+SI/R組OD值為(0.53±0.06),相比SI/R組或對照組差異顯著(P<0.05);Jagged+DAPT+SI/R組OD值(0.23±0.06)(vs Jagged1+SI/R組,P<0.05);Jagged1組OD值為(0.74±0.09),DAPT組OD值為(0.78±0.14),與對照組相比均未見顯著差異(P>0.05)。
2.2 各組LDH釋放試驗檢測結果
細胞LDH釋放量檢測可用于確定細胞損傷的程度。對照組的LDH釋放率為(11.19±2.13)%;SI/R組LDH釋放率為(36.23±3.33)%,顯著高于對照組(P<0.05);Jagged1+SI/R組LDH釋放率為(28.29±3.16)%,顯著高于對照組,低于SI/R組(P均<0.05);Jagged+DAPT+SI/R組LDH釋放率為(49.62±3.40)%,與Jagged1+SI/R組存在顯著差異(P<0.05);Jagged1組LDH釋放率為(11.23±2.26)%,DAPT組LDH釋放率為(11.37±2.41)%,與對照組相比均未見顯著差異(P>0.05)。
2.3 各組心肌細胞凋亡檢測結果
對照組心肌細胞凋亡率為(7.13±0.72)%;SI/R組細胞凋亡率為(34.24±3.55)%,顯著高于對照組(P<0.05);Jagged1+SI/R組細胞凋亡率為(23.46±11.41)%,相比SI/R組顯著降低(P<0.05);Jagged+DAPT+SI/R組細胞凋亡率為(46.33±6.26)%,顯著高于其他各組(P<0.05);Jagged1組細胞凋亡率為(7.18±0.82)%,DAPT組細胞凋亡率為(7.10±0.65)%,與對照組相比均未見顯著差異(P>0.05)。
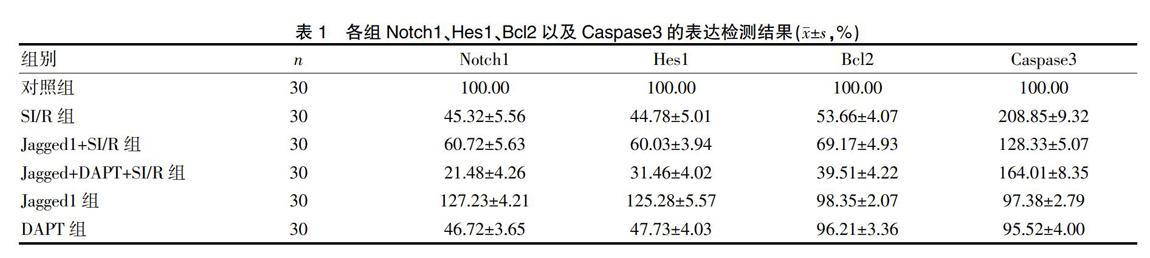
2.4 各組Notch1、Hes1、Bcl2以及Caspase3的表達檢測結果
各組Notch1、Hes1、Bcl2以及Caspase3的表達檢測結果見表1。SI/R組、Jagged1+SI/R組、Jagged+DAPT+SI/R組經處理后Notch1、Hes1、Bcl2均顯著下降,Caspase3表達顯著上升(P<0.05)。
3討論
Notch信號通路是作為心血管系統的發生、發育、病理以及生理過程當中的一種基本的信號通路,該通路具有促進干細胞的分化與增殖,促進損傷細胞的再生作用[4-6]。有研究提示,Notch信號通路在缺血/再灌注的過程中發揮一定的作用[7]。當前研究發現,心梗后晚期的 Notch信號通路中,Notch1分子胞內區的關鍵分子NICD在心梗邊緣區(即在缺血但未壞死的區域內)的表達出現顯著提升;且在Notch 信號通路激活后,心梗恢復期心臟功能出現明顯的改善[8-9]。Gude NA等[10]研究提示,Notch信號通路可能在心肌的缺血損傷過程以及心肌保護過程均發揮出重要的調控作用。Notch信號通路與NF-κB及PI3K/Akt等信號通路通過分子網絡互相間影響,NF-κB以及PI3K/Akt等相關信號通路已被研究證明為心肌缺血/再灌注過程發揮重要作用的通路,不少研究均提示,與NF-κB及PI3K/Akt相關的Notch 信號通路也可能通過多信號通路的級聯效應對心肌缺血/再灌注過程起到調控作用[11]。不少學者基于相關通路的研究認為,心肌缺血/再灌注損傷中,Notch信號通路的激活或發揮出重要的調控作用[12-14]。
本研究主要以通過動物實驗建立大鼠乳鼠心肌細胞缺血/再灌注模型,探討Notch信號通路經ROCK2對大鼠心肌細胞缺氧/復氧誘導H9c2心肌細胞的凋亡影響,SD大鼠乳鼠心肌細胞模型對于Notch信號通路的相關分子Notch與Hes1在正常心肌細胞、缺氧/復氧心肌細胞中的表達明確,其相對于人心房肌標本實驗可有效避免臨床因素的影響[15]。本研究納入小鼠180只,分6組處理,檢測Hes1的表達、心肌細胞活力、心肌細胞乳酸脫氫酶釋放情況、心肌細胞凋亡情況以及NICD、Bcl2、Caspase3以及Hes1表達水平。結果提示,各組心肌細胞活力(OD值)檢測中,SI/R組、Jagged1+SI/R組、Jagged+DAPT+SI/R組明顯下降,而Jagged1組、DAPT組與對照組均無明顯差異,研究排除了Jagged1與DAPT對實驗的影響。而LDH釋放率、細胞凋亡率在SI/R組、Jagged1+SI/R組、Jagged+DAPT+SI/R組均有明顯上升,Notch1、Hes1、Bcl2、Caspase3表達以對照組檢測結果為100.00%,SI/R組、Jagged1+SI/R組、Jagged+DAPT+SI/R組經處理后Notch1、Hes1、Bcl2均有顯著下降,Caspase3表達顯著上升(P<0.05)。實驗結果顯示,通過激活Notch信號通路能有效減輕心肌細胞缺血/再灌注損傷,激活Notch信號通路后,心肌細胞的活力增加,且LDH的釋放率降低,細胞凋亡率降低,且抗凋亡蛋白-Bcl2的表達水平升高,凋亡蛋白Caspase3的表達水平下降;通過抑制Notch信號通路能加重缺血/再灌注損傷現象,實驗結果顯示,抑制Notch信號通路后心肌細胞的活力受到抑制,LDH釋放率升高,細胞凋亡率升高,抗凋亡蛋白-Bcl2的表達水平降低,凋亡蛋白Caspase3的表達水平提升。
綜上所述,本研究提示Notch 信號通路在心肌缺血/再灌注的過程中發揮著重要調控作用,對誘導H9c2心肌細胞凋亡具有重要影響,且激活Notch 信號通路能起到抗缺血/再灌注損傷的效果。
[參考文獻]
[1] 呂平,李巍,楊亞麗,等. 激活Notch1通路減輕高溫高濕條件下H9C2心肌細胞缺氧/復氧損傷[J]. 心臟雜志,2017,29(5):512-517.
[2] 申陽,周云國,曹青,等. Notch信號通路對缺氧/復氧誘導H9c2心肌細胞凋亡的影響及相關機制的研究[C].中國南方國際心血管病學術會議. 2013.
[3] OjamaaK. Signaling mechanisms in thyroid hormone-induced cardiac hypertrophy[J]. Vascular Pharmacology,2010,52(3-4):113-119.
[4] 王曉紅,曹相原,方向韶,等.乳鼠心肌細胞體外氧糖剝奪/復氧損傷模型的構建[J].寧夏醫學雜志,2012,34(3):193-195.
[5] Li S,Zhang X,Wang Y,et al. DAPT protects brain against cerebral ischemia by down-regulating the expression of Notch 1 and Nuclear factor kappa B in rats[J]. Neurological Sciences,2012,33(6):1257-1264.
[6] 周波,錢坤,胡明珠,等. PI3K/Akt/FoxO3a/Bim信號通路介導硫化氫后處理對缺氧H9c2心肌細胞的保護作用[J]. 中國藥理學通報, 2017, 33(7):971-976.
[7] 張潔,萬靜,王海蓉,等. 14,15-環氧化二十碳三烯酸對棕櫚酸鹽誘導的H9c2心肌細胞凋亡的影響及其機制[J]. 武漢大學學報:醫學版,2016,37(5):694-698.
[8] Fassbender JM,Myers SA,Whittemore SR. Activating Notch signaling post-SCI modulates angiogenesis in penumbral vascular beds but does not improve hindlim-blocomotor recovery[J]. Experimental Neurology,2011, 227(2):302-313.
[9] 周學亮,萬力,劉季春. Notch1胞內結構域真核表達質粒構建及在H9c2心肌樣細胞的表達和生物學功能[J]. 中國現代醫學雜志,2013, 23(10):1-4.
[10] Gude NA,Emmanuel G,Wu W,et al. Activation of Notch-Mediated Protective Signaling in the Myocardium[J].Circulation Research,2008, 102(9):1025-1035.
[11] Lu YL,Xie C. Notch signaling pathway blocked by gamma-secretase inhibitor and its effect on the growth and apoptosis of SKOV3 cells[J]. Journal of Sichuan University,2014,45(4):578-581.
[12] Kanungo J,Zheng YL,Amin ND,et al. The Notch signaling inhibitor DAPT down-regulates cdk5 activity and modulates the distribution of neuronal cytoskeletal proteins[J]. Journal of Neurochemistry,2010,106(5):2236-2248.
[13] Bezzina CR,Barc J,Mizusawa Y,et al. Common variants at SCN5A-SCN10A and HEY2 are associated with Brugada syndrome,a rare disease with high risk of sudden cardiac death[J]. Nature Genetics, 2013,45(9):1044.
[14] 周學亮,方義湖,趙勇,等. Notch1減輕心肌缺血再灌注損傷作用的研究[J]. 中華醫學雜志,2016,96(20):1591-1596.
[15] Koibuchi N,Chin MT. CHF1/Hey2 Plays a Pivotal Role in Left Ventricular Maturation Through Suppression of Ectopic Atrial Gene Expression[J]. Circulation Research,2007,100(6):850-855.

