降解菌短密木霉對土壤酶活性的影響
劉晴 董愛榮 鄧世林 鮑彤 劉薇
摘要:為探究短密木霉以及短密木霉、大豆和咪唑乙煙酸相互作用對土壤蔗糖酶和過氧化氫酶活性的影響,本文采用3,5-二硝基水楊酸法、高錳酸鉀滴定法分別測定土壤中蔗糖酶和過氧化氫酶的酶活。結果表明:在土壤中加入短密木霉,5~20 d中土壤蔗糖酶活性均呈現激活趨勢,10 d時蔗糖酶活性最高為53.85 mg/kg,激活率達到169.94%;過氧化氫酶活性呈現出激活—抑制—恢復的趨勢,5 d時土壤過氧化氫酶活性最高,為2.47 mg/g,激活率達5.71%,隨后受到抑制,酶活性最低達2.30 mg/g,抑制率最高達到17.86%。種植大豆、加入短密木霉,再加入100 mg/kg的咪唑乙煙酸后,土壤蔗糖酶活性呈現激活—恢復—激活—抑制的趨勢,10 d時土壤蔗糖酶活性最高,為60.09 mg/kg,激活率達201.21%,20 d時蔗糖酶活性被抑制,其活性為68.13 mg/kg,抑制率最高達62.43%;土壤過氧化氫酶活性呈現抑制—恢復—激活的趨勢, 20 d時酶活性最低為2.43 mg/g,抑制率最高達到17.98%,40 d時酶活性最高,為2.70 mg/g,激活率最高達到9.46%。
關鍵詞:短密木霉;蔗糖酶; 過氧化氫酶
中圖分類號:S158.4文獻標識碼:A文章編號:1006-8023(2019)03-0009-04
Effects of Trichoderma brevicompactum on Soil Enzyme Activity
LIU Qing1, DENG Airong1*, DENG Shilin1, BAO Tong1, LIU Wei2
(1.College of Forestry, Northeast Forestry University, Harbin 150040; 2.Huludao Forestry Development Service Center, Huludao 125000)
Abstract:In order to investigate the effects of Trichoderma brevicompactum and the interaction of Trichoderma brevicompactum, soybean and imazethapyr on the activities of sucrase and catalase in soil, 3.5-dinitrosalicylic acid method and potassium permanganate titration were used to determine the activities of sucrose and catalase in soil respectively. The results showed that, when Trichoderma brevicompactum was added to the soil, in 5-20 days, sucrase activity showed a trend of activation with the highest activity of 53.85 mg/kg in 10 days and the activation rate of 169.94%. Catalase activity showed a trend of activation-inhibition-recovery. The highest catalase activity was 2.47 mg/g and the activation rate was 5.71%. Then it was inhibited. The lowest catalase activity was 2.30 mg/g and the highest inhibition rate was 17.86%. After planting soybean, adding Trichoderma brevicompactum and 100 mg/kg imazethapyr, soil sucrose activity showed the trend of activation-recovery-activation-inhibition. The highest sucrase activity was 60.09 mg/kg in 10 days, the activation rate was 201.21%, and the sucrase activity was in habited in 20 days with the highest sucrase activity of 68.12 mg/kg and the inhibition rate of 62.43%. Soil catalase activity showed a trend of inhibition-recovery-activation, the lowest activity was 2.43 mg/g in 20 days, the highest inhibition rate was 17.98%, the highest activity was 2.70 mg/g in 40 days, and the highest activation rate was 9.46%.
Keywords:Trichoderma brevicompactum; sucrase; catalase
0引言
土壤酶是土壤生態系統代謝的重要驅動力,土壤中進行化學和生物反應是在酶的催化下進行的。土壤微生物和土壤酶活性變化作為檢測土壤質量變化的指標之一,反映了土壤生態系統中微生物參與物質轉化和循環的能力,因此土壤酶受到人們越來越多的關注[1-2]。土壤酶參與土壤中所有的生化反應,在物質轉化、能量代謝和污染土壤修復等過程中發揮著重要作用[3]。同時土壤酶作為一項生態毒理指標,常用于評價土壤健康及生態環境風險[4]。有研究表明,土壤酶可參與有機化合物的降解,因此,它能在治理污染土壤方面得到應用[5]。重復使用一種或幾種類似化學結構的農藥,可能導致農藥的迅速降解,很快喪失藥效,土壤酶參與上述過程,被稱為“激活生物降解”[6]。土壤酶降解土壤中的有機化合物的機理,一般認為涉及幾個過程:降解、聚合、合成和偶聯的酶促反應,形成腐殖質復合體,從而減少土壤中有害有機物的聚積。
咪唑乙煙酸是在1984年由美國氰胺公司開發的咪唑啉酮類除草劑[7],化學名稱為(RS)-5-乙基-2-(4-異丙基-4-甲基-5-1H-2-咪唑啉-2-基)煙酸[8],該類除草劑具有殺草普廣、活性高和選擇性強等優點,在農藥市場有重要地位[9-10]。咪唑乙煙酸合成抑制劑具有支鏈型氨基酸,它能阻止乙酞羚酸合成酶,防止蛋白質合成,從而達到除草的目的[11]。咪唑乙煙酸能有效的防除豆科農田里的雜草,與環境的相容性較好[12]。但是咪唑乙煙酸在土壤中的殘留時間很長,會對后茬作物造成嚴重的藥害問題[13],由于咪唑乙煙酸具有長殘效性,能造成土壤環境的污染,因此,監測咪唑乙煙酸施用后對土壤酶活性的影響成為評價咪唑乙煙酸生態環境安全性的重要指標。
土壤蔗糖酶可水解蔗糖,反映土壤有機碳轉化能力[14],與土壤中有機質、氮、磷含量,微生物數量及土壤呼吸強度有關,其酶促作用產物直接關系到作物的生長[15]。土壤過氧化氫酶是生物呼吸、生物代謝過程,以及土壤動物、植物根系分泌及殘體分解中的重要酶類,與土壤性質關系密切,是較好的土壤微生態環境指示因子[16-17],其活性可表示土壤氧化過程的強度,并能有效防止土壤及生物體在新陳代謝過程中產生的過氧化氫所造成的毒害[18-19]。
本文分別以土壤蔗糖酶和過氧化氫酶為指標,設計盆栽試驗,通過在土壤中添加短密木霉(高效降解菌),明確短密木霉及短密木霉、大豆和咪唑乙煙酸互相作用對土壤酶活性的影響,為應用短密木霉改善土壤生態環境,為修復農藥污染土壤的研究提供理論依據。
1材料與方法
1.1試驗材料
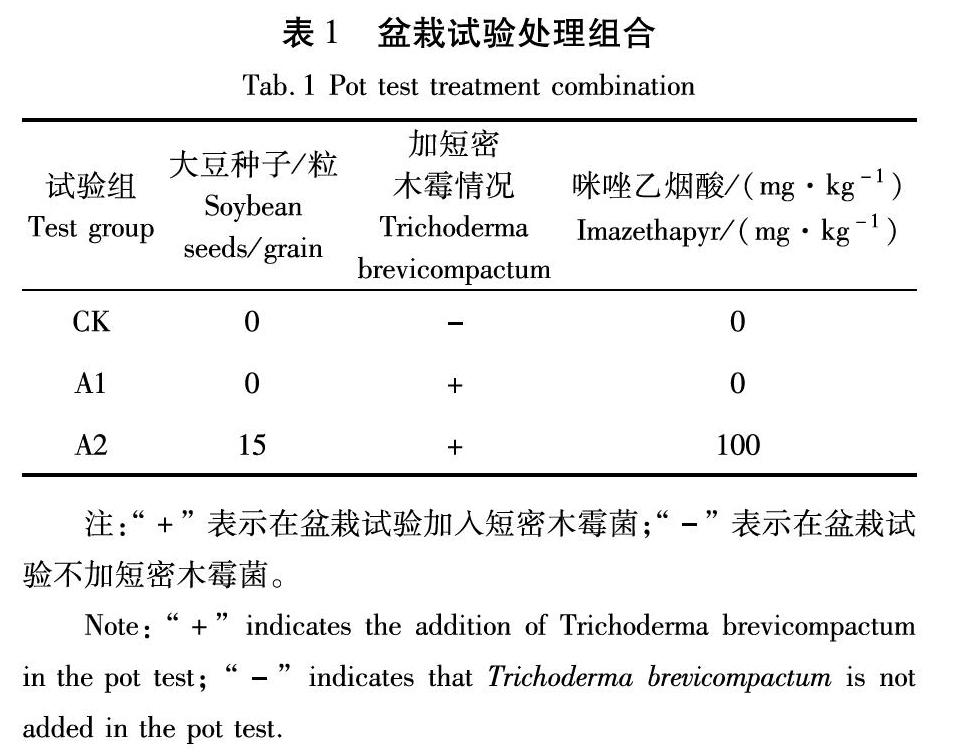
盆栽試驗土壤為m(草炭)∶m(沙子)∶m(土)=5∶3∶2的比例進行混合所得。大豆品種為黑農48。菌種是課題組前期馴化得到的高效降解菌株短密木霉(Trichoderma brevicompactum)。
培養真菌的培養基采用孟加拉紅培養基:蛋白胨5 g、葡萄糖10 g、磷酸二氫鉀1 g、硫酸鎂0.5 g、瓊脂20 g、1/3000孟加拉紅溶液100 mL、蒸餾水1 000 mL、氯霉素0.1 g。
保存菌株采用PDA培養基:馬鈴薯200 g、葡萄糖20 g、瓊脂15~20 g、蒸餾水1000 mL。
1.2盆栽試驗
將短密木霉接種于60個PDA平板中,放入培養箱,在溫度為25 ℃、黑暗條件下培養5 d。待菌株大量產孢后,將菌絲連同孢子刮下,加入到盛有無菌水的燒杯中,放入少量的吐溫80,用玻璃棒充分的攪拌后均勻地混入部分試驗用土壤中。再將部分試驗用土壤加入5%咪唑乙煙酸水劑,制成咪唑乙煙酸質量分數為100 mg/kg的污染土。選擇籽粒飽滿、均勻、無病蟲的大豆種子,每盆放入15個顆粒,覆土2.0 cm,放在盆栽內自然生長。
以短密木霉為降解菌,按表1設計盆栽試驗。試驗組在處理后5、10、20、30、40 d分別用五點法取土樣,風干,過10目篩,放入冰箱4 ℃保存待用。
1.3酶活性的測定
土壤蔗糖酶活性測定采用3,5-二硝基水楊酸法[20],過氧化氫酶活性檢測采用高錳酸鉀滴定法[21]。
土壤酶活性的抑制率(激活率)計算公式為:
抑制率或激活率(%)= [(A-B)/A]×100。
式中:A為空白對照的土壤酶活性;B為不同處理所得的土壤酶活性;結果為正值時表示激活率,為負值時表示抑制率。
1.4數據分析
用Excel2010對數據進行計算;運用SPSS16.0軟件進行差異性分析,并采用鄧肯方法進行顯著性差異分析(P<0.05);圖表中數據為平均值±標準差。
2結果與分析
2.1短密木霉及短密木霉、大豆和咪唑乙煙酸三者相互作用對土壤蔗糖酶活性的影響
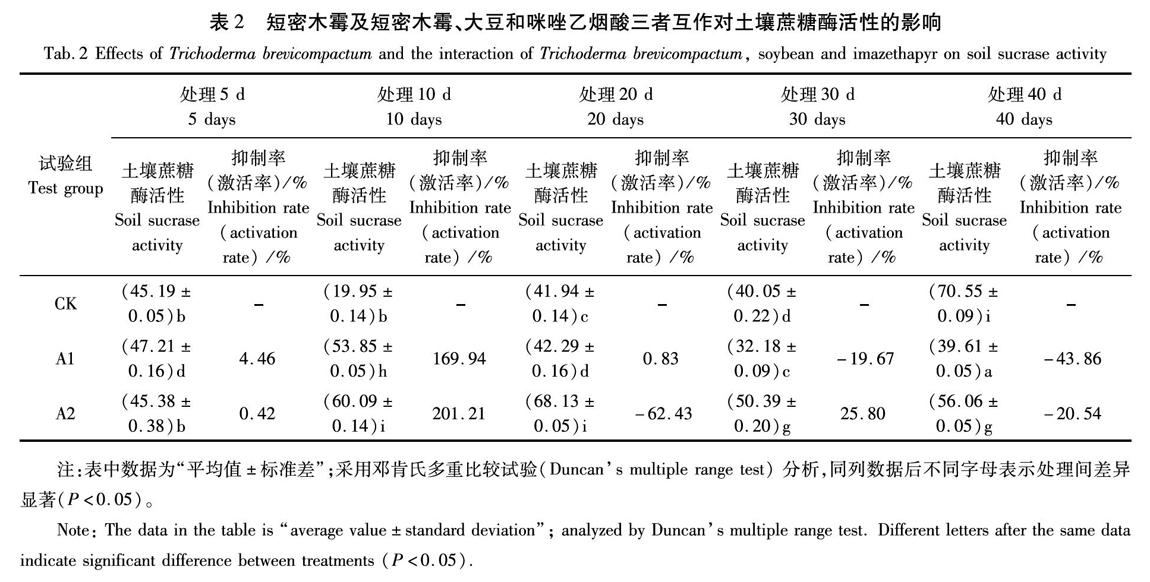
由表2可知,在土壤中加入短密木霉后,土壤蔗糖酶活性呈現出激活—恢復—抑制的趨勢。在培養期間,A1組與CK組的蔗糖酶活性差異性顯著(P<0.05),土壤蔗糖酶活性在5 d時顯著高于對照組,開始有顯著的激活趨勢,到10 d時蔗糖酶活性最高為53.85 mg/kg,激活率達到169.94%,20 d時基本恢復到對照水平,30 d后呈現抑制狀態,直到試驗結束。
在土壤中種植大豆、加入100 mg/kg的咪唑乙煙酸,再加入短密木霉后,土壤蔗糖酶呈現激活—恢復—激活—抑制的趨勢,5 d時蔗糖酶活性與對照組基本持平,在10 d時,活性被激活,土壤蔗糖酶活性為60.09 mg/kg,激活率最高達201.21%,在20 d時,蔗糖酶活性被抑制,蔗糖酶活性為68.13 mg/kg,抑制率最高達62.43%,在30 d,活性逐漸恢復后,在40 d又得到抑制。三者互作后,蔗糖酶活性均與對照組均有顯著的差異性(P<0.05)。
2.2短密木霉及短密木霉、大豆和咪唑乙煙酸三者相互作用對土壤過氧化氫酶活性的影響
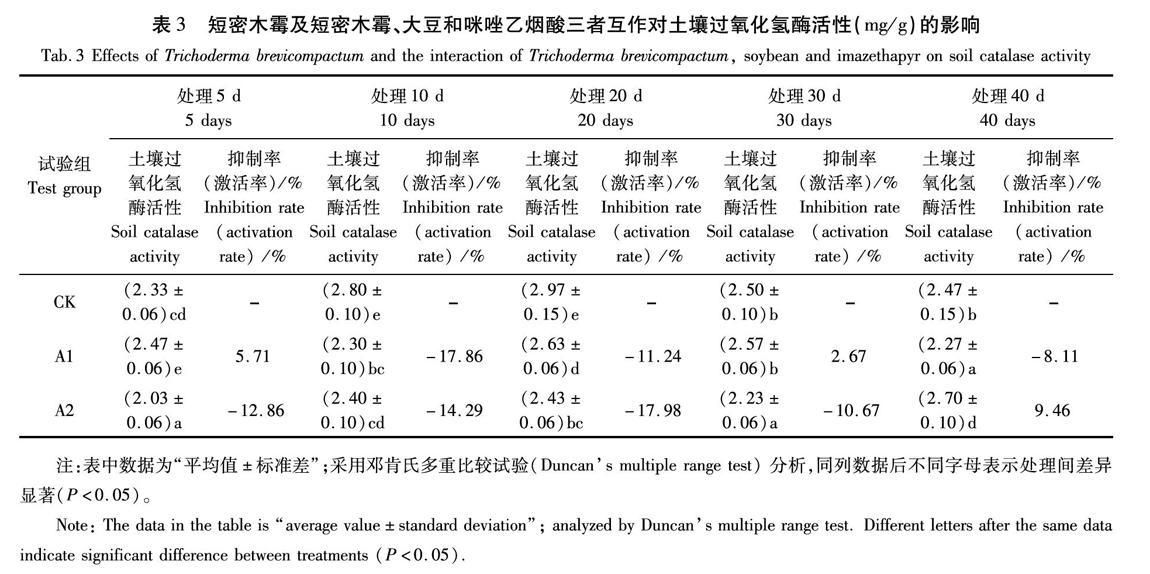
由表3可知,在土壤中加入短密木霉后,土壤過氧化氫酶活性呈現出激活—抑制—恢復的趨勢。在培養期間,與CK組的過氧化氫酶活性均差異性顯著(P<0.05)。5 d時顯著高于對照組,土壤過氧
化氫酶活性為2.47 mg/g,激活率達5.71%,但到10~20 d時,過氧化氫酶活性得到了抑制,酶活性最低達2.30 mg/g,抑制率最高達到17.86%,30 d時基本恢復到對照水平后又開始出現抑制現象。
在土壤中種植大豆、加入100 mg/kg的咪唑乙煙酸,再加入短密木霉后,土壤過氧化氫酶活性基本呈現抑制—恢復—激活的趨勢。5~30 d時土壤過氧化氫酶活性呈現抑制狀態,而后恢復至對照水平,并有激活趨勢, 20 d時土壤過氧化氫酶活性最低為2.43 mg/g,抑制率最高達到17.98%,40 d時土壤過氧化氫酶活性最高達2.70 mg/g,激活率最高達到9.46%。
3結論與討論
本研究表明:在土壤中加入短密木霉后,土壤蔗糖酶活性呈現出激活—恢復—抑制的趨勢,且與對照組差異顯著(P<0.05)。過氧化氫酶活性呈現激活—抑制—恢復的趨勢,且與對照組差異顯著(P<0.05)。根據課題組前期研究結果,加入短密木霉后,10 d時短密木霉數量最多,其后占比逐漸下降,且土壤中的真菌總數量恢復到對照水平[22]。上述結果與短密木霉在土壤中的數量變化有直接關系。這與陳建愛等[23]的研究結果基本一致,黃綠木霉T1010制劑處理日光溫室番茄連作土壤,可有效提高土壤酶活性,改善土壤生態環境。
在土壤中種植大豆、加入短密木霉,再加入100 mg/kg的咪唑乙煙酸三者相互作用后,土壤蔗糖酶活性呈現激活—恢復—激活—抑制的趨勢,土壤過氧化氫酶活性呈現抑制—恢復—激活的趨勢,且兩種土壤酶活性均與對照組有一定的差異性(P<0.05)。
【參考文獻】
[1]GARCIAGIL J C, PLAZA C, SOLERROVIRA P, et al. Long-term effects of municipal solid waste compost application on soil enzyme activities and microbial biomass[J]. Soil Biology and Biochemmistry, 2000, 32(13): 1907-1913.
[2]BURGER M, JACKSON L E. Microbial immobilization of ammonium and nitrate in relation to ammonification and nitrification rates inorganic and conventional cropping systems[J]. Soil Biology and Biochemistry, 2003, 35(1): 29-36.
[3]張莉莉,陳利軍,劉桂芬,等.污染土壤的酶學修復研究進展[J].應用生態學報,2003,14(12):2342-2346
ZHANG L L, CHEN L J, LIU G F, et al. Advance in enzymological remediation of polluted soils[J]. Chinese Journal of Applied Ecology, 2003, 14(12): 2342-2346.
[4]崔薈萍,趙桂琴,劉歡.除草劑對燕麥田土壤脲酶和堿性磷酸酶活性的影響[J].中國草地學報,2014,36(1):37-43.
CUI H P, ZHAO G Q, LIU H. Effects of herbicide on the activities of urease and alkaline phosp hatase in oat field[J]. Chinese Journal of Grassland, 2014, 36(1): 37-43.
[5]莫晶,閆文德,劉曙光,等.油茶-花生間作土壤酶活性與養分的關系[J].中南林業科技大學學報,2017,37(6):89-95.
MO J, YAN W D, LIU S G, et al. Soil enzyme activities and their relations with soil fertility in Camellia oleifera peanut intercropping[J]. Journal of Central South University of Forest & Technology, 2017, 37(6): 89-95.
[6]曾巧云,莫測輝,蔡全英.農業土壤中鄰苯二甲酸酯的污染現狀與危害[J].廣東農業科學,2009,45(7):90-92.
ZENG Q Y, MO C H, CAI Q Y. Current situation and harmfulness of phthalic acid esters in agricultural soil[J]. Guangdong Agricultural Sciences, 2009, 45(7): 90-92.
[7]程志明,顧保權.咪唑啉酮類除草劑──咪草煙的合成[J].農藥,2001,40(9):9-12.
CHENG Z M, GU B Q. The synthesis of herbicides imazethapyr[J]. Agrochemicals, 2001, 40(9): 9-12.
[8]史史偉.咪唑乙煙酸對土壤微生物、酶活性的影響及其降解真菌的篩選[D].北京:中國農業科學院, 2010.
SHI W. Effects of imazethapyr on soil microorganism, enzyme activity and isolation of imazethapyr degrading fungi[D]. Beijing: Chinese Academy of Agricultural Sciences, 2010.
[9]PERUCCI P, SCARPONI L. Effects of the herbicide imazethapyr on soil microbial biomass and various soil enzyme activities[J]. Biology and Fertility of Soils, 1994, 17(3): 237-240.
[10]張昌朋,劉新剛,徐軍,等.咪唑乙煙酸對土壤微生物生態的影響[J].農藥,2010,49(2):117-119.
ZHANG C P, LIU X G, XU J, et al. Effect of imazethapyr on soil microbial ecology[J]. Agrochemicals, 2010, 49(2): 117-119.
[11]劉維屏,鄭巍,宣日成,等.除草劑咪草煙在土壤上吸附-脫附過程及作用機理[J].土壤學報,1998,35(4):475-481.
LIU W P, ZHENG W, XUAN R C, et al. Adsorption-desorption process and interaction mechanism of herbicide imazethapyr with soils[J]. Acta Pedologica Sinica, 1998, 35(4): 475-481.
[12]唐慶紅,張一賓.除草劑咪草煙的合成方法探討[J].上海化工,1998,23(13):31-33.
TANG Q H, ZHANG Y B. The method for synthesizing imazethapyr[J]. Shanghai Chemical Industry, 1998, 23(13): 31-33.
[13]孫建光,姜瑞波,任天志,等.我國農田和水體污染及微生物修復前景[J].中國農業資源與區劃,2008,29(1):41-47.
SUN J G, JIANG R B, REN T Z, et al. Prospect for farmland and water pollution and microorganism repair in China[J]. Chinese Journal of Agricultural Resources and Regional Planning, 2008, 29(1): 41-47.
[14]范昆,王開運,王東,等.1,3-二氯丙烯對土壤脲酶和蔗糖酶活性的影響[J].農藥學學報,2006,8(2):139-142.
FAN K, WANG K Y, WANG D, et al. The effect of 1, 3-dichloropropene on activities of soil urease and invertase[J]. Chinese Journal of Pesticide Science, 2006, 8(2): 139-142.
[15]曹慧,孫輝,楊浩,等.土壤酶活性及其對土壤質量的指示研究進展[J].應用與環境生物學報.2003,9(1):105-109.
CAO H, SUN H, YANG H, et al. A review soil enzyme activity and its indication for soil quality[J]. Chinese Journal of Applied and Environmental Biology, 2003, 9(1): 105-109.
[16]BANDICK A K, DICK R P. Field management effects on soil enzyme activities[J]. Soil Biology and Biochemistry, 1999, 31(11): 1471-1479.
[17]ZIMMERMANN S, FREY B. Soil respiration and microbial properties in an acid forest soil: effects of wood ash[J]. Soil Biology and Biochemistry, 2002, 34(11): 1727-1737.
[18]劉昌玲,王國慶.細菌過氧化氫酶的分離、結晶及性質[J].生物化學與生物物理進展,1990,17(5):380-383.
LIU C L, WANG G Q. Isolation, crystallization and properties of bacterial catalase[J]. Progress in Biochemistry and Biophysics, 1990, 17(5): 380-383.
[19]黃永洪,花慧,沈國強,等.豬肝過氧化氫酶提取條件的研究[J].生物技術通訊,2005,16(1):40-42.
HUANG Y H, HUA H, SHEN G Q, et al. Study on extraction of catalase from pig liver[J]. Letters in Biotechnology, 2005, 16(1): 40-42.
[20]關松蔭.土壤酶及其研究法[M].北京:農業出版社,1986.
GUAN S Y. Soil enzymes and its methodlog[M]. Beijing: Agricultural Press, 1986.
[21]周禮愷.土壤酶學[M].北京:科學出版社, 1987.
ZHOU L K. Soil enzymology[M]. Beijing: Science Press, 1987.
[22]李志國,霍璐陽,劉宇彤,等.短密木霉、大豆和咪唑乙煙酸對土壤真菌多樣性及農藥殘留的影響[J].東北林業大學學報.2018,46(3):87-91.
LI Z G, HUO L Y, LIU Y T, et al. Effects of Trichoderma brevicompactun, soybean, and imazethapr on soil fungal diversity and pesticide residues[J]. Journal of Northeast Forestry University, 2018, 46(3): 87-91.
[23]陳建愛,陳為京,楊煥明,等.黃綠木霉T1010對日光溫室耕層土壤酶活性的調控效應[J].天津農業科學.2013,19(1):20-23.
CHEN J A, CHEN W J, YANG H M, et al. Regulating effect of Trichoderma aureoviride 1010 on enzyme activity in the solar-greenhouse soil[J]. Tianjin Agricultural Sciences, 2013, 19(1): 20-23.

