擠壓協同淀粉酶法制備高粱蛋白及其組成分析
周劍敏 尹方平 于 晨 湯曉智
(南京財經大學食品科學與工程學院;江蘇省現代糧食流通與安全協同創新中心;江蘇高校糧油質量安全控制及深加工重點實驗室,南京 210023)
高粱籽粒中富含淀粉與蛋白質,其中淀粉質量分數65%~70%,蛋白質質量分數8%~11%。高粱中淀粉比重很高,是我國白酒釀造工業中的重要原料[1]。高粱蛋白質量分數僅次于淀粉,作為釀酒工業中的副產物,其開發利用相對較少。目前報道的高粱蛋白提取方法主要有有機溶劑法[2]、還原劑法[3]、超聲波輔助提取法[4]和堿法[5]等。這些方法普遍存在的問題是蛋白質提取率和蛋白質純度較低,其原因主要與高粱蛋白在高粱中的存在形式和結合結構息息相關。DUODO等[6]和SCHOBER等[7]指出高粱醇溶蛋白位于球形的蛋白質體內,該蛋白質體包埋在谷蛋白基質內,同時周圍環繞著淀粉顆粒。這種淀粉-蛋白質的包埋體系限制了高粱蛋白的提取和利用,也導致了高粱蛋白的消化率低,溶解性差。
已有研究證明,擠壓技術可以通過破壞淀粉-蛋白質的包埋體系,提升高粱蛋白的消化率和溶解性。FAPOJUWO等[8]報道指出擠壓處理能夠將高粱蛋白的體外消化率提升至30%。Dahlin等[9]在物料含水量20%,擠壓溫度為177 ℃,喂料速度為345 kg/h的條件下擠壓高粱,結果表明高粱醇溶蛋白在乙醇溶液中的溶解性顯著提高,蛋白消化率也增加18%。劉明等[10]研究了雙螺桿擠壓機處理白高粱粉,研究表明在擠壓溫度150 ℃,物料水分17%,喂料速度300 g/min,螺桿轉速275 r/min條件下,產品的體外蛋白質消化率達到最大值。在擠壓過程中,高溫、高壓、高剪切的條件使淀粉糊化和部分降解[11],同時打破淀粉-蛋白質的緊密包埋結構[12],因此有可能進一步通過淀粉酶的處理,有效提取高粱蛋白。
本研究主要探究在擠壓過程中物料含水量、擠壓溫度以及酶處理時高溫α-淀粉酶活力對高粱粉中高粱蛋白提取率和純度的影響,同時利用正交實驗優化高粱蛋白的提取工藝,并對提取的高粱蛋白組分進行氨基酸組成測定、營養評價和亞基分析,為高粱蛋白的深度開發利用提供參考。
1 材料與方法
1.1 材料與試劑
高粱、高溫α-淀粉酶(40 000 U/g)、Braford蛋白測定試劑盒。
氫氧化鈉、鹽酸、石油醚、十二烷基磺酸鈉(SDS)和2-巰基乙醇均為分析純。
1.2 儀器與設備
JXFM110型錘式旋風磨;DSE-20型雙螺桿擠壓機;SpectraMax M2e酶標儀;D-3紫外檢測儀;Cence H850R高速冷凍離心機;KjelFlex K-360凱氏定氮儀;日立L-8900型全自動氨基酸分析儀;MINI-4垂直電泳儀。
1.3 方法
1.3.1 擠壓實驗
將過60目篩后的微細高粱粉分裝后,物料含水量分別調至15%、17%、19%、21%、23%,混合均勻,放入自封袋中平衡過夜。
采用雙螺桿擠壓機,長徑比30∶1,螺桿直徑20 mm,模孔直徑4 mm。擠壓機套筒溫度分別設定為Ⅰ區40 ℃、Ⅱ區60 ℃、Ⅲ區100 ℃、Ⅳ區120 ℃,Ⅴ區溫度分別設定為 120、135、150、165、180 ℃,喂料器轉速恒定為14 r/min,螺桿轉速恒定為150 r/min。擠壓機啟動30 min穩定后,按設定的條件對混合樣品進行實驗。擠出樣品放置于40 ℃烘箱干燥24 h,分別磨粉過60目篩用于后續實驗。
1.3.2 淀粉酶法制備高粱蛋白
將未經擠壓的高粱粉和擠壓后的高粱粉按照料液比1∶6(高粱粉∶超純水)于90 ℃恒溫水浴鍋中攪拌,添加適量的高溫α-淀粉酶(0.4、0.8、1.2、1.6、2.0、2.4和2.8 U/g淀粉),反應2 h后,5 000 r/min,4 ℃下離心15 min,傾倒上清液后取沉淀,反復水洗沉淀并離心3次,直至上清液澄清,將沉淀冷凍干燥即得高粱蛋白粉。
1.3.3 高粱蛋白的提取率和純度的計算
稱量冷凍干燥后的高粱蛋白粉的質量,使用Braford蛋白濃度測定試劑盒測定高粱蛋白粉中蛋白質質量分數,計算提取率和純度,根據式(1)計算:
(1)
式中:m1是冷凍干燥后的所提取高粱蛋白粉質量/g,C1是冷凍干燥后的高粱蛋白粉中蛋白質質量分數/%,即高粱蛋白純度,C0是高粱或擠壓高粱粉中蛋白質質量分數/%,m是高粱或擠壓高粱粉質量/g。
1.3.4 正交優化實驗設計
根據單因素實驗結果,設計L9(33)正交實驗。以物料含水量、擠壓溫度、淀粉酶活力為實驗因素,以蛋白質純度為響應值,因素水平設計見表1。所有實驗重復3次取平均值。

表1 正交實驗因素與水平
1.3.5 氨基酸分析
準確稱取 0.1 g高粱蛋白于水解管中,加入10 mL 6 mol/L HCl,(減壓條件下) 密封水解管放入烘箱,110 ℃水解24 h。將水解后的樣品過濾,放入圓底燒瓶中旋蒸去除鹽酸。殘留樣品用0.02 mol/L HCl定容至50 mL,吸取稀釋后的水解液經0.22 μm濾膜過濾,裝入進樣瓶中通過氨基酸分析儀測定。采用堿水解的方法測定色氨酸質量分數。
1.3.6 營養價值評價
氨基酸評分(AAS)=
(2)
式中:以1973年FAO/WHO推薦的模式(學齡前兒童)為參考蛋白。
(3)
預測的蛋白質功效比值(PER):
PERⅠ=-0.684+0.456(Leu)-0.047(Pro)
(4)
PERⅡ=-0.468+0.454(Leu)-0.105(Try)
(5)
PERⅢ=-1.816+0.435(Met)+0.780(Leu)+0.211(His)-0.944(Try)
(6)
1.3.7 SDS-PAGE凝膠電泳
稱取50 mg高粱蛋白,加入1 mL緩沖溶液中(0.05 mL 2-ME、0.67 mL 去離子水和0.28 mL混合液,其中含有0.2 mol/L的HCl、7% SDS、30%甘油和4% Pyronin Y),充分混勻。加入蛋白質樣品,150 mA下保持18 h電泳結束[13]。使用考馬斯亮藍染液搖床染色過夜,脫色,掃描凝膠圖像。
1.3.8 數據處理和統計分析
采用Origin 8.0和SPSS 17.0數據處理軟件對數據進行分析,并用Tukey法進行顯著性分析,結果以X±SD表示。
2 結果與分析
2.1 α-淀粉酶法提取高粱蛋白
如表2所示,對未經擠壓處理的高粱粉直接進行α-淀粉酶水解處理,發現蛋白提取表現出高提取率和低蛋白質純度。這說明在高粱中,直接使用α-淀粉酶無法完全水解淀粉。這與高粱中淀粉和蛋白質的結合方式有關。高粱淀粉與蛋白質結合形成包埋結構,淀粉酶難以有效接觸淀粉,使得產物中蛋白質依舊與淀粉緊密結合,導致最終產物的提取率高,但蛋白質純度極低。

表2 淀粉酶法提取高粱蛋白
2.2 擠壓協同淀粉酶提取高粱蛋白
2.2.1 物料水分對于高粱蛋白質提取率和純度的影響
由圖1可知,當擠壓溫度為150 ℃,淀粉酶活力為2.0 U/g淀粉時,高粱粉經擠壓協同α-淀粉酶處理后,蛋白質提取率81.48%~83.90%,純度65.44%~75.77%。相對于α-淀粉酶直接處理,蛋白質純度提升了4.2~5.2倍。同時提取率保持在較高水平。這與淀粉在擠壓機機桶內的糊化和降解相關。淀粉在溫度、壓力和剪切力的共同作用下發生糊化和降解。淀粉糊化過程中分子間氫鍵斷裂,致密有序的淀粉結構變得松散無序,內部空間增大,在酶水解過程中有利于α-淀粉酶的進入,導致酶解效率增強。這一過程使得高粱中淀粉-蛋白質包埋結構被完全瓦解,蛋白質得以釋放,從而能夠通過離心沉淀的方式分離得到純度較高的高粱蛋白。
如圖1所示,高粱蛋白的提取率隨物料含水量增加呈現先上升后下降的趨勢,當物料含水量從 17%上升至19%時,提取率急劇上升。當物料含水量超過19%時,提取率不斷降低。蛋白質純度隨物料含水量的變化趨勢與提取率的變化趨勢一致。在物料含水量19%的條件下,蛋白質提取率與純度有最大值,分別為83.90%和75.77%。在擠壓過程中,物料含水量增加,淀粉充分吸水,淀粉糊化度增加[14],擠壓過程使得淀粉結構松散,從而對α-淀粉酶更加敏感,酶解過程中易于生成小分子量的易溶于水的物質,蛋白質因此在離心過程中沉淀并與淀粉分離開來。同時,水分在機筒中對淀粉等物質有塑化作用[15],改善物料的流動性,因此,當物料水分含量進一步升高,機械能下降,淀粉的降解程度有所降低,α-淀粉酶水解效率降低,導致提取率降低,蛋白質純度下降。
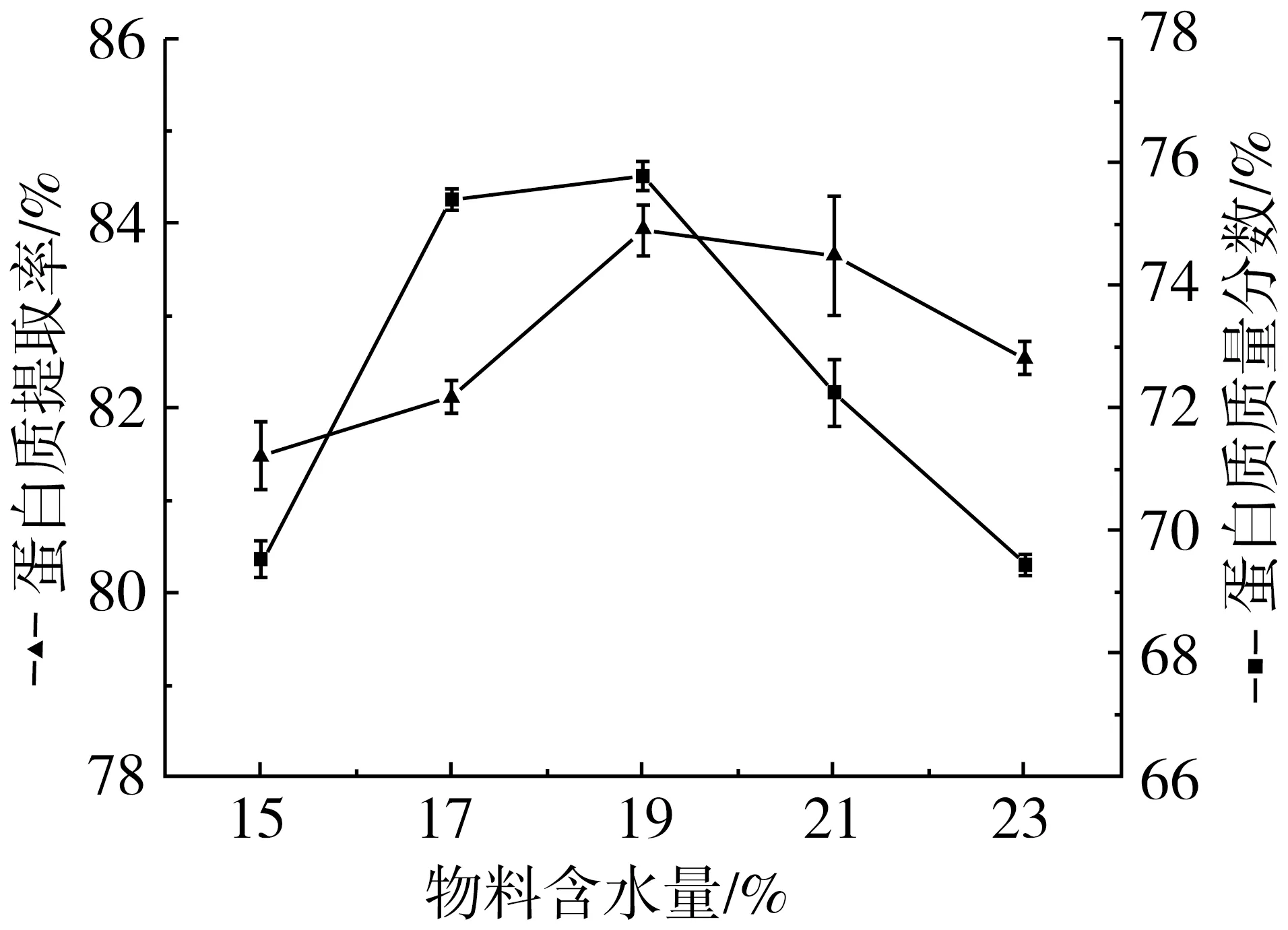
圖1 物料含水量對蛋白質提取率和純度的影響
2.2.2 擠壓溫度對于高粱蛋白質提取率和純度的影響
如圖2所示,當物料水分為17%,淀粉酶活力為2.0 U/g淀粉時,隨擠壓溫度的增加,蛋白質提取率和純度都呈先上升后下降的變化趨勢。擠壓溫度是影響淀粉糊化和降解程度的重要因素。擠壓溫度增加,淀粉糊化度增加,α-淀粉酶水解淀粉的效率也隨之增大,淀粉-蛋白質包埋結構的破壞程度增加,因此可以得到較高純度的蛋白質,提取率也升高。在擠壓溫度150 ℃的條件下,蛋白質提取率達到82.12%,純度達到75.38%。 但當溫度高于150 ℃時,蛋白質提取率和純度呈下降趨勢。過高的擠壓溫度有可能導致淀粉與脂肪、蛋白質的結合[16],不利于淀粉酶的水解作用;此外,PHILIPP 等[17]認為擠壓溫度的增加降低了機筒內熔融體的黏度,物料受到的剪切力下降,擠壓過程中淀粉的降解程度降低,α-淀粉酶水解效率降低,蛋白質提取率和純度降低。隨著擠壓溫度上升到180 ℃,機筒內蛋白質變性程度增加,蛋白質的水溶性降低,還可能產生淀粉的焦化現象,引起蛋白質提取率和純度的快速下降。
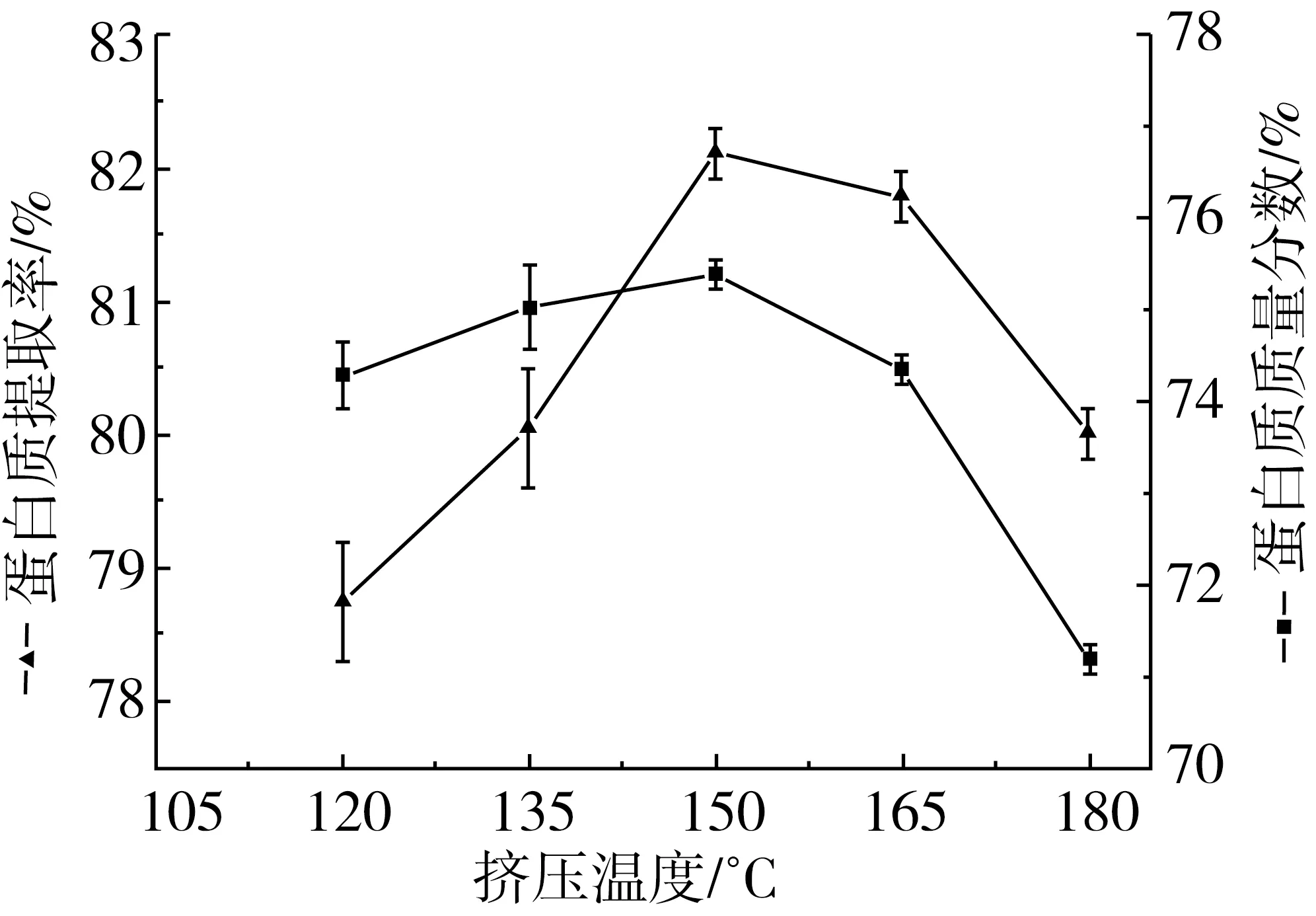
圖2 擠壓溫度對蛋白質提取率和純度的影響
2.2.3 α-淀粉酶活力對于高粱蛋白質提取率和純度的影響
如圖3所示,當擠壓溫度為150 ℃,水分為17%時,隨著酶活力的增加,蛋白質提取率和純度呈上升趨勢,當酶活力達到 2.0 U/g淀粉之后,蛋白質提取率和純度變化不大,趨于穩定。α-淀粉酶通過水解蛋白質周圍的淀粉,使得更多的蛋白質暴露出來。經過擠壓后,糊化的淀粉更易于被α-淀粉酶水解,轉化為可溶于水的小分子物質。當底物(淀粉)的量一定時,酶活力的增加提升了淀粉酶與淀粉的接觸概率,催化了更多的淀粉水解,從而破壞淀粉分子間結構以及淀粉與蛋白質的包埋結構,導致蛋白質提取率和純度增加。當淀粉酶活力為2.0 U/g淀粉時,酶與底物的結合達到飽和,繼續增加酶活力,蛋白質純度和提取率趨于穩定。

圖3 淀粉酶活力對蛋白質提取率和純度的影響
2.2.4 擠壓協同α-淀粉酶提取高粱蛋白條件優化
根據單因素實驗結果設計正交實驗,以蛋白質純度為測定指標。實驗結果見表3。

表3 正交實驗結果
由表4的方差分析結果可知,F0.1

表4 SPSS 正交實驗方差分析
2.3 高粱蛋白的氨基酸組成分析及營養學評價
由表5可知,擠壓協同淀粉酶法提取的高粱蛋白中除了蘇氨酸、色氨酸、賴氨酸,其他的氨基酸的AAS均大于1,均能滿足FAO/WHO推薦的學齡前兒童的氨基酸需求。賴氨酸、色氨酸等氨基酸的質量分數低是由高粱蛋白的必需氨基酸組成合理性欠缺所引起;蘇氨酸的質量分數低與擠壓過程有關。在擠壓過程中,高溫高壓條件使得氨基酸殘基暴露,并與原料中存在的某些還原糖或羰基化合物發生美拉德反應或非酶促褐變反應,使得氨基酸質量分數下降。相對于杜金娟[5]的研究而言,此法提取的高粱蛋白中亮氨酸、谷氨酸和丙氨酸等氨基酸質量分數均顯著提高。這可能是由于杜金娟采用提取方法為堿法提取,其中的蛋白質組成成分主要為高粱谷蛋白,而淀粉酶法提取主要去除高粱粉中的淀粉,提取的高粱中的蛋白質相對較完全。
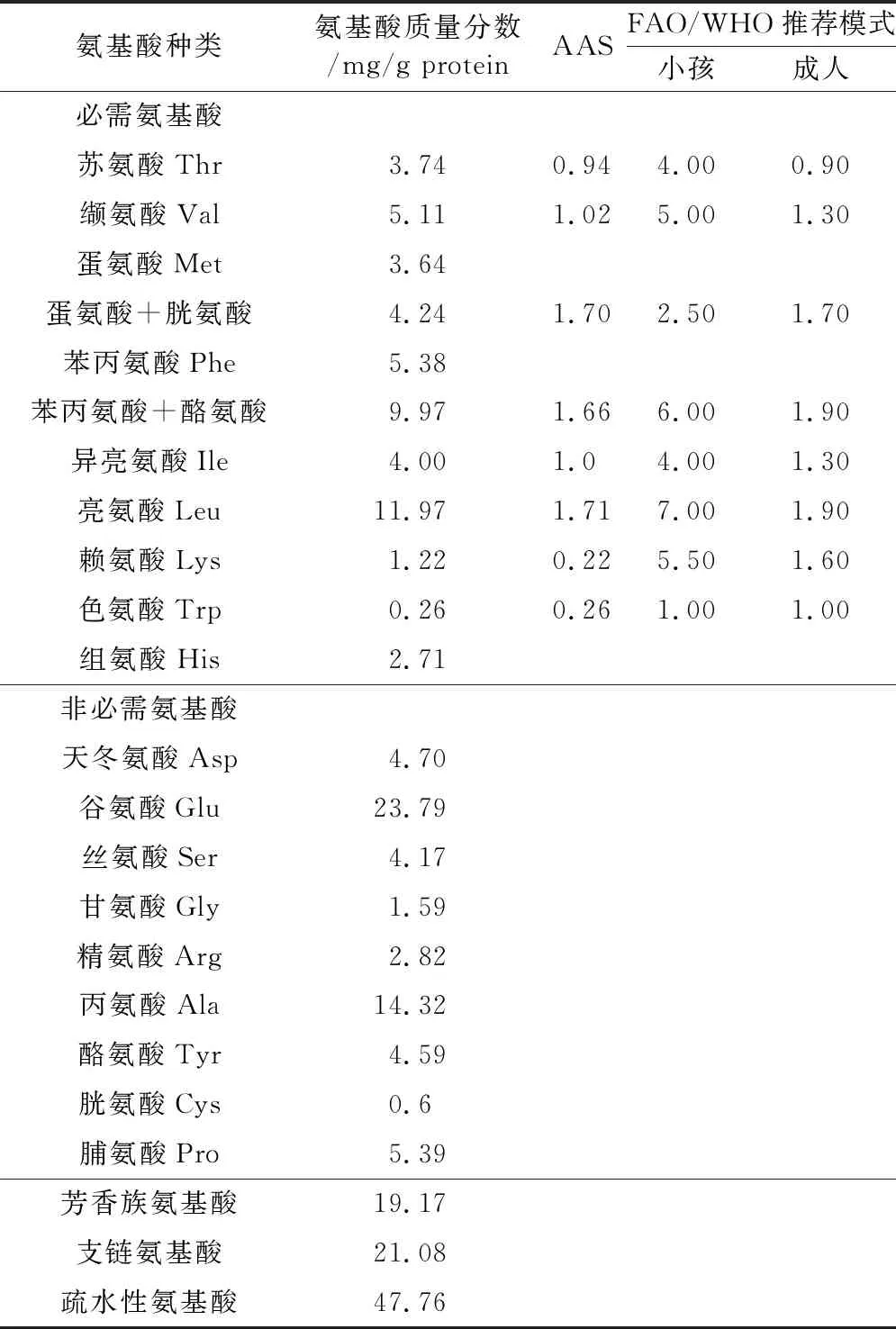
表5 高粱蛋白氨基酸組分分析
從表6中高粱蛋白的營養評價可知,擠壓協同淀粉酶法提取的高粱蛋白中必需氨基酸與總量的比例為38.03%,高于FAO/WHO推薦標準,表現出良好的氨基酸平衡。PER常作為蛋白質吸收利用的評價指標,PER越大其吸收利用越高。擠壓協同淀粉酶法提取的高粱蛋白PERⅠ、PERⅡ和PERⅢ均大于2.0,說明本法提取的高粱蛋白氨基酸利用率較高,可以被認為是一種優質蛋白質資源。

表6 高粱蛋白的營養評價
2.4 高粱蛋白的相對分子質量分析
擠壓協同淀粉酶法提取的蛋白質(SP2)經過考馬斯亮藍R250染色后的電泳圖譜見圖4。與Marker對比可以發現,SP2主要有4個條帶,其中1條相對分子質量位于24~31 ku,其余3條相對分子質量分別為43、37、15 ku。24~31 ku處的條帶范圍廣,說明此范圍內蛋白質亞基較為集中。高粱中醇溶蛋白主要分為3種:α-醇溶蛋白(23~25 ku)、β-醇溶蛋白(16~20 ku)和 γ-醇溶蛋白(28 ku)。這說明SP2 中24-31 ku的條帶幾乎包含所有的醇溶蛋白組分。Vivas等[18]對蒸煮前后高粱中的谷蛋白進行SDS-PAGE凝膠電泳實驗,發現蒸煮前后的高粱中谷蛋白均能在36、45 ku處得到條帶,這說明SP2中43、37 ku的條帶代表谷蛋白。杜金娟等[19]利用堿法提取甜高粱中的谷蛋白,電泳圖在15.1 ku處出現條帶并推斷此條帶是谷蛋白降解所致。所以SP2中的15 ku同樣代表了高粱蛋白中的谷蛋白。由此可知,擠壓協同淀粉酶法制備的高粱蛋白包含醇溶蛋白和谷蛋白。
現在常用的高粱蛋白提取法有有機溶劑法、還原劑法、超聲波輔助提取法和堿法。對這些方法提取的高粱蛋白進行相對分子量分析[19-22],圖譜中均缺少SP2中位于43和37 ku處的條帶。這說明相對于現行的高粱蛋白提取方法,擠壓協同淀粉酶法能夠更加完全的提取出高粱中存在的蛋白質組分。
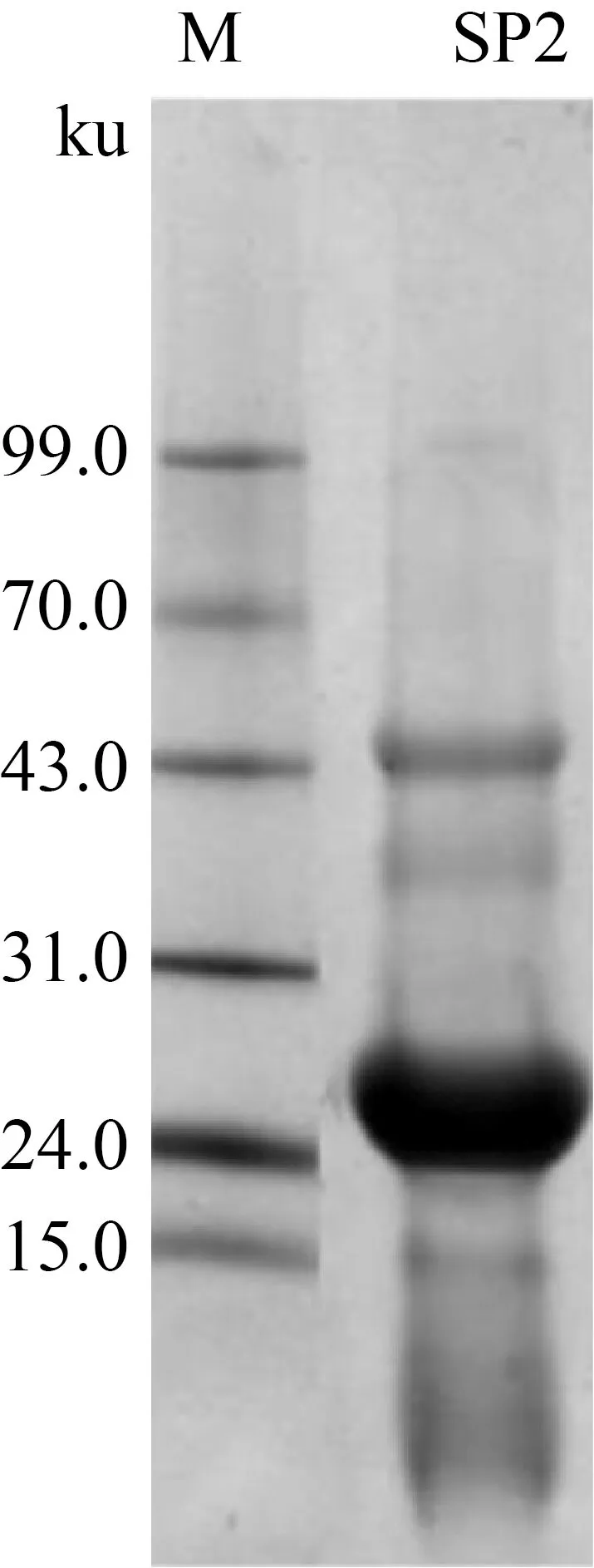
圖4 高粱蛋白的SDS-PAGE圖譜
3 結論
研究物料含水量、擠壓溫度和淀粉酶活力對于擠壓協同淀粉酶法制備高粱蛋白的提取率和純度的影響,并以此為基礎,利用正交實驗對高粱蛋白的提取工藝進行優化。采用氨基酸分析儀和SDS-PAGE凝膠電泳儀分析本法提取的高粱蛋白。結果發現,隨著物料含水量或溫度的增加,蛋白提取率和純度均先上升后下降,在物料含水量19%或150 ℃時有最大值;隨著酶活力的增加,提取率和純度也隨之增加,當酶活力2.0 U/g淀粉時趨于平緩。在最佳工藝條件(物料含水量19%,擠壓溫度165 ℃和淀粉酶活力2.0 U/g淀粉)時,高粱蛋白提取率83.2%,純度79.23%。本法提取的高粱蛋白包含高粱醇溶蛋白和谷蛋白,并且具有良好的氨基酸平衡和較高的氨基酸利用率。與傳統提取工藝相比,擠壓協同淀粉酶法綠色高效,有更好的工業化前景。

