老年男性2型糖尿病患者雙下肢微循環病變與骨質疏松的相關性
趙晟珣 劉菊 陳輝
武漢市第一醫院老年病科,湖北 武漢 430000
隨著生活習慣、飲食結構等因素的變化,2型糖尿病(type 2 diabetes,T2DM)的發病率日益增加,它是以胰島素抵抗為主的一組代謝性疾病,常伴有血脂、尿酸、同型半胱氨酸等多種代謝因素的異常,共同影響著血管、神經及骨的代謝。有研究顯示,骨質疏松與微循環病變作為T2DM的并發癥,可能有類似的病理生理機制[1-2],但具體機制尚未研究明確,需更多的臨床試驗數據來證明。經皮氧分壓可作為微循環功能包括血管、神經綜合水平的檢查手段,因此,本研究擬分析TcpO2值與骨質疏松的相關指標,進一步探討老年男性T2DM患者雙下肢微循環病變與骨質疏松的相關性,為糖尿病并發癥早期預防提供新的診療思路。
1 資料與方法
1.1 研究對象
選取2016年9月至2017年8月在武漢市第一醫院老年病科住院的老年男性T2DM患者(年齡≥60歲)120例,通過醫院無創經皮氧分壓測定足背基線值TcpO2,分為3組:足背基線值TcpO2>40 mmHg為正常組(A組);足背基線值TcpO2<40 mmHg為輕度異常組(B組);足背基線值TcpO2<20 mmHg為重度異常組(C組);其中A組42例,B組42例,C組36例。
診斷標準:DM根據《中國2型糖尿病防治指南(2017年版)》診斷標準[3];骨質疏松癥符合世界衛生組織原發性骨質疏松癥診斷標準[4](即雙能X線測得骨密度值≤青年健康人群骨密度-2.5SD)。剔除標準:腫瘤、肝腎功能衰竭、心腦血管疾病、多器官功能障礙、藥物影響(長時間激素服用史)及手術、創傷、糖尿病急性并發癥、急性感染等急性應激狀態患者。
1.2 研究方法
1.2.1臨床資料收集:收集入選患者的年齡,測量身高、體重、計算體質量指數(body mass index,BMI)=體重(kg)/身高(m)2,采集空腹8 h以上的肘靜脈血,用奧林巴斯AU400全自動生化儀檢測糖化血紅蛋白(HbA1c)、低密度脂蛋白膽固醇(low density lipoprotein cholesterol,LDL-C)、血鈣(Ca)指標。
1.2.2經皮氧分壓(TcpO2)檢測:采用吉安得爾經皮氧分壓檢測儀,患者取仰臥位,將傳感器貼于患者足部皮膚表面,測量出血氧分壓值及變化曲線。
1.2.3骨密度測定:應用法國 DMS 公司生產的雙能 X 線骨密度測定儀檢測患者腰椎(L1~5)、全髖部、股骨頸、股骨轉子間BMD,自動測出的T值,骨密度分析系統可自動獲得 BMD 結果。
1.3 統計學分析
采用SPSS 23.0軟件進行數據分析,多組間均數比較用方差分析,兩組間均數比較用t檢驗,非正態分布資料組間比較用非參數秩和檢驗,率之間比較用χ2檢驗,P<0.05表示差異有統計學意義。
2 結果
2.1 各組間臨床資料比較
三組間數據結果顯示,與正常組相比,輕度異常組、重度異常組病程均大于正常組,血鈣兩組均低于正常組,差異有統計學意義(P<0.05)。余年齡、BMI、LDL-C、HbA1c比較,差異無統計學意義(P>0.05),詳見表1。
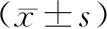
表1 各組間一般資料及生化指標比較Table 1 Comparison of general data and biochemical indicators among the groups
注:與正常組相比,**P<0.01。
2.2 各組間骨密度比較
三組間數據結果顯示,與正常組相比,輕度異常組、重度異常組L5、全髖部骨密度均低于正常組,差異有統計學意義(P<0.05)。而三組間L1~4、股骨頸、股骨轉子間骨密度值比較差異無統計學意義(P>0.05),詳見表2。
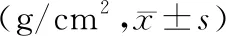
表2 各組間骨密度比較Table 2 Comparison of bone mineral density among the groups
注:與正常組相比,**P<0.01,*P<0.05。
2.3 老年男性T2DM患者雙下肢TcpO2值與骨密度的Pearson相關性分析
老年男性T2DM患者TcpO2值與L4、L5、全髖部骨密度呈正相關(r值分別為0.254、0.343、0.202),差異有統計學意義(P<0.05);TcpO2值與余L1、L2、L3、股骨頸、股骨轉子間骨密度無明顯相關性,差異無統計意義(P>0.05),詳見表3。
表3雙下肢TcpO2與骨密度的Pearson相關性分析
Table3Correlation between TcpO2 and bone mineral density of the lower limbs

變量r值P值L1 -0.3600.695L2 -0.4600.615L3 0.0650.482L4 0.2540.005*L5 0.3430.000**全髖部 0.2020.027*股骨頸 -0.0650.479股骨轉子 -0.0440.635
注:**P<0.01,*P<0.05。
3 討論
有文獻報道,骨質疏松與微循環病變作為T2DM的并發癥,是兩種多因素退行性病變,可能具有相同的危險飲食和病理生理機制。T2DM患者體內存在的胰島素抵抗、腸道菌群紊亂[5],脂質代謝紊亂、高血糖介導的炎癥反應[6-7]、尿微量白蛋白水平等在骨質疏松、微循環病變進展中均參與、促進了其疾病過程[8]。
TcpO2 檢測毛細血管中釋放出來的氧氣(值)作為評估糖尿病微循環病變的金指標之一,已作為TASCⅡ專家共識指南。局部皮膚微循環是反映全身微循環的一個窗口,De Meifer 等推薦 TcpO2可作為T2DM患者早期發生血管病變的一種檢查手段。現國內外有關T2DM患者的雙下肢TcpO2值與骨密度方面的研究較少,本研究重在以經皮氧分壓TcpO2值作為老年男性T2DM患者雙下肢微循環病變指標,分析其與骨質疏松的相關性,為臨床工作者提供更多的證據。
本研究結果顯示,老年男性T2DM患者TcpO2 值輕度異常組、重度異常組中病程均高于正常組,血鈣值低于正常組,差異有統計學意義。此結果說明糖尿病病程、鈣代謝異常共同參與了微循環病變及骨質疏松的發生發展。與此相關的國內外文獻報道也曾多方闡述了此觀點,機制可能為機體在長期高血糖狀態下,體內糖基化終末產物(AGEs)生產會增多,并作用于平滑肌細胞、單核細胞和巨噬細胞表面的炎性配體RAGE,擴大炎性反應,損傷內皮細胞,促進血管壁彈性下降,加速脂質沉積,促使血管動脈粥樣硬化的形成[9]。另外,機體長期處于高血糖狀態下,骨骼蛋白可發生非酶促糖基化,損害骨質量[10],且高血糖引起的滲透性利尿可以導致大量鈣、磷從尿中丟失[11],從而引起骨質疏松。Solida等[12]發現鈣代謝異常是骨質疏松、血管硬化的共同機制,血鈣的異常易誘發炎癥反應及氧化應激,促使血栓形成,脂質的沉積,導致血管鈣化的發生。當細胞內鈣濃度低于正常時,可通過壓力信號通路激活相關凋亡基因,促使血管及神經病變的發展[13]。此外,血漿鈣離子濃度的升高主要受甲狀旁腺激素(parathyroid hormone,PTH)、1,25(OH)2D3的調節,當血鈣降低時,PTH 可促進骨細胞溶解骨鈣的作用,并使破骨細胞吸收骨基質的作用增強,從而導致骨鈣從骨組織中不斷釋出,引起骨質疏松,這些文獻報道均與本研究數據相符。
本研究結果另外一組數據表明,老年男性T2DM患者TcpO2 值輕度異常組、重度異常組L5、全髖部骨密度均低于TcpO2 值正常組,Pearson相關分析僅證明了老年男性T2DM患者TcpO2值與L4、L5、全髖部骨密度呈正相關,而與L1、L2、L3、股骨頸、股骨轉子間骨密度無明顯相關性。此研究結果分析可能與本研究樣本量較小有關,但仍然說明老年男性T2DM患者雙下肢微循環病變與骨質疏松之間可能存在相關性,可能是導致OP發生的危險因素,但還需較大樣本量的研究進一步證明兩者的關系。
總之,本研究證明及早發現糖尿病下肢微循環病變有助于及早預防骨質疏松疾病。

