海洋源低溫微生物產蘋果酸脫氫酶發酵條件優化
遲乃玉,肖景惠,倪瑞琪,于 爽,張慶芳*
(1.大連大學 生命科學與技術學院,遼寧 大連 116622;2.遼寧省海洋微生物生物工程技術研究中心,遼寧 大連 116622)
蘋果酸脫氫酶(malate dehydrogenase,MDH)EC 1.1.1.37普遍存在于動物、植物和微生物中,可以催化草酰乙酸(oxaloacetic acid,OAA)可逆地還原為蘋果酸[1]。MDH參與檸檬酸循環、乙醛酸循環、蛋白質合成、糖異生等代謝活動[2]。在生物科學進化分析領域,MDH廣泛應用于系統發育、遺傳多樣性、個體發育和種間雜種分析的研究過程[3]。在農業監測領域,MDH被用作植物抗病性和易感性的早期鑒定和診斷標記[4]。在食品工業領域,MDH被作為指示酶用以檢測L-蘋果酸[5]、醋酸[6]、檸檬酸[7]在食品中的含量。在醫藥衛生領域,MDH臨床診斷試劑盒應用于急性肝損傷、肝癌、肺癌等疾病的早期診斷[8]。鑒于MDH具有以上重要的應用價值,其制備工藝一直備受國內外研究人員的關注。現階段MDH的來源主要有兩個方面:一方面是從動物肝臟、心肌組織中直接分離提取;另一方面是從微生物的發酵產物中提取。
目前,產MDH菌株多來源于陸生環境[9-11],海洋作為一個獨特的生物環境,從其中篩選得到的MDH具有耐高鹽、適合低溫條件下應用等優勢。本課題組從大連地區渤海海泥中分離得到一株高產MDH的墓畫大洋芽孢桿菌(Oceanobacillus picturae)XJH-11,為了進一步考察該菌株的潛在應用價值,提高其產MDH的能力,本研究通過單因素試驗和響應面設計試驗優化菌株XJH-11產MDH的發酵條件,討論了各因素對其產MDH能力的影響,從而為深入研究該菌株及后續的中試放大試驗奠定基礎。
1 材料與方法
1.1 材料與試劑
墓畫大洋芽孢桿菌(Oceanobacillus picturae)XJH-11(Genbank NO.:MK050016):分離于大連渤海海泥,遼寧省海洋微生物工程技術研究中心保藏。
牛肉膏、蛋白胨、Trition X-100、二硫蘇糖醇(dithiothreitol,DTT)、酵母膏、葡萄糖、硫酸鎂、瓊脂粉(均為生化試劑或分析純):生物工程上海股份有限公司。
裂解溶液(0.1 mol/L,pH8 Tris-HCl、0.5 mol/L NaCl、1%Trition X-100、30 μmol/L DTT):本實驗室配制。
種子培養基:牛肉膏3 g/L,蛋白胨10 g/L,海水配制,pH7.4,0.1 MPa滅菌20 min。
發酵培養基:葡萄糖5g/L,蛋白胨10g/L,硫酸鎂0.08g/L,海水配制,pH8.0,0.1 MPa滅菌20 min。
1.2 儀器與設備
CRY-2112立式恒溫搖床:上海茸研儀器有限公司;LTI-700低溫恒溫培養箱:上海愛朗儀器有限公司;YXQ-75SII立式壓力蒸汽滅菌器:上海博訊實業有限公司醫療設備廠;SCIENTZ-650E超聲波細胞粉碎機:寧波新芝生物科技股份有限公司;CR21N高速冷凍離心機:株式會社日立制作所;Multiskan GO全波長酶標儀:美國賽默飛世爾科技公司。
1.3 方法
1.3.1 種子液、粗酶液制備
將斜面保藏菌株墓畫大洋芽孢桿菌(Oceanobacillus picturae)XJH-11接種到裝液量為125 mL/500 mL的種子培養基中,并在25℃、150r/min搖床中振蕩培養36h,作為種子液。再將其以5%接種量接種到裝液量為125 mL/500 mL的發酵培養基中,相同的條件培養36 h。
取發酵液于4℃、8 000 r/min離心10 min,棄去上清液,取濕菌體經0.1mol/LTris-HCl緩沖液(pH8.0)洗滌3次以上,直至菌體洗凈為止。將洗凈后的菌體重懸于裂解溶液中,冰浴條件下超聲波破碎,能量30%,每次破碎8 s,間隙9 s,破碎40 min。將破碎的菌液4℃、12 000 r/min離心20 min,上清液為粗酶液。
1.3.2 菌株產蘋果酸脫氫酶發酵條件優化單因素試驗[13-15]
(1)發酵培養基優化
碳源種類優化:將可溶性淀粉、麩皮、秸稈粉、麥芽糖、葡萄糖、乳糖、微晶纖維素作為單一碳源加入發酵培養基中,添加量為5 g/L,考察碳源種類對MDH酶活的影響;碳源含量優化:確定最佳碳源種類后,調整發酵培養基碳源含量分別為2.5 g/L、5.0 g/L、7.5 g/L、10.0 g/L、12.5 g/L,考察碳源含量對MDH酶活的影響。
氮源種類優化:確定最優碳源的條件下,將蛋白胨、牛肉膏、磷酸二氫銨、氯化銨、酵母膏、牛肉膏+蛋白胨、尿素、磷酸氫二銨作為單一氮源加入發酵培養基中,添加量為10 g/L,考察氮源種類對MDH酶活的影響。氮源含量優化:確定最佳氮源種類后,調整發酵培養基氮源含量分別為5 g/L、10 g/L、15 g/L、20 g/L、25 g/L,考察氮源含量對MDH酶活的影響。
無機鹽種類優化:在確定最優碳源、氮源的條件下,將CuSO4、KCl、MgSO4、NaCl、ZnCl2作為單一無機鹽離子加入發酵培養基中,添加量為0.8 g/L,考察無機鹽種類對MDH酶活的影響。無機鹽含量優化:確定最佳無機鹽種類后,調整發酵培養基無機鹽含量分別為0.06 g/L、0.08 g/L、0.10 g/L、0.12 g/L、0.14 g/L,考察無機鹽含量對MDH酶活的影響。
發酵培養基初始pH值優化:分別調整發酵培養基初始pH值為6.5、7、7.5、8、8.5、9,考察發酵培養基初始pH值對酶活的影響。
(2)培養條件優化
在確定最佳發酵培養基條件下,固定其他條件不變,分別調整發酵溫度為10℃、15℃、20℃、25℃、30℃、35℃、40 ℃,轉速為140 r/min、150 r/min、160 r/min、170 r/min、180 r/min、200 r/min,裝液量為50 mL/500 mL、75 mL/500 mL、100 mL/500 mL、125 mL/500 mL、150 mL/500 mL、175 mL/500 mL、200 mL/500 mL,接種量分別為2%、3%、4%、5%、6%、7%、8%;培養36 h后測定MDH酶活。
1.3.3 Plackett-Burman試驗設計
在單因素試驗的基礎上,選取8個影響因子作為研究對象,以MDH酶活(Y)為響應值,Plackett-Burman(PB)設計的試驗次數N=12,PB試驗設計的因素和水平如表1所示。
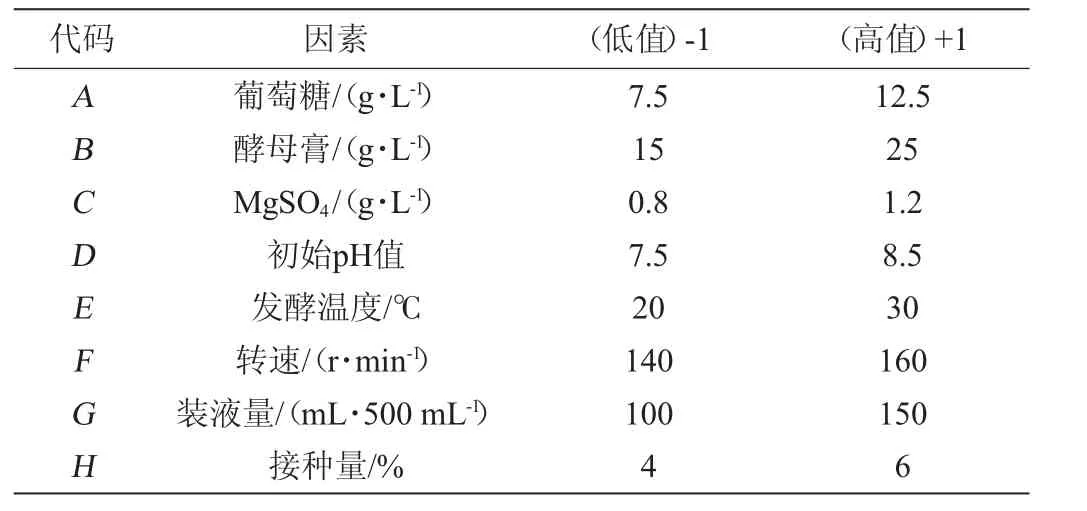
表1 Plackett-Burman試驗因素及水平Table 1 Factors and levels of Plackett-Burman experiments
1.3.4 最陡爬坡試驗設計
根據Plackett-Burman測試結果中每個顯著影響因素效應的大小,設定步長和變化方向,找出峰值,并快速逼近最佳值區域。
1.3.5 中心組合試驗設計
根據最佳爬坡試驗的結果,將具有最高酶活的一組用作中心組合試驗的中心點,運用Design-Expert 8.0.6軟件進行Box-Behnken試驗設計,響應面分析法用于優化產酶條件參數的分析。運用Design-Expert8.0.6軟件分析得到最優結果,最后對預測值進行驗證。每個處理做3個平行。
1.3.6 測定方法
按照參考文獻[12]的方法測定MDH酶活。
2 結果與分析
2.1 菌株產蘋果酸脫氫酶發酵條件優化單因素試驗
2.1.1 培養基碳源種類的優化
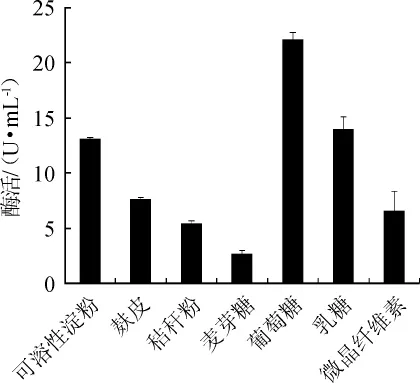
圖1 不同碳源種類對蘋果酸脫氫酶活力的影響Fig.1 Effect of different carbon sources on malic dehydrogenase activity
由圖1可知,當葡萄糖為單一碳源時,菌株XJH-11產生的MDH酶活最高,為22.07 U/mL。乳糖、可溶性淀粉和麩皮次之,微晶纖維素、秸稈粉、麥芽糖作為碳源時,酶活很低。因此,葡萄糖是菌株XJH-11產MDH的最適碳源。
2.1.2 葡萄糖添加量的優化
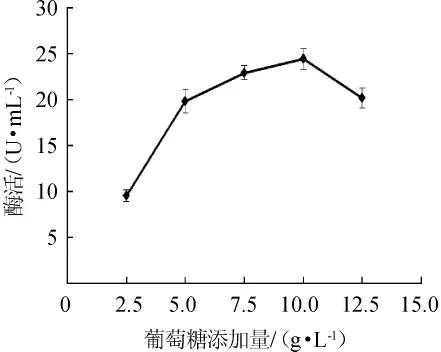
圖2 葡萄糖添加量對蘋果酸脫氫酶活力的影響Fig.2 Effect of glucose addition on malic dehydrogenase activity
由圖2可知,葡萄糖添加量從2.5g/L升至10g/L時,MDH酶活隨葡萄糖添加量的增加而增加,當葡萄糖添加量達到10 g/L時,MDH的酶活最高,為24.46U/mL。當葡萄糖添加量>10g/L之后,酶活降低,說明葡萄糖濃度的增加抑制了菌株XJH-11對葡萄糖的利用。因此,最適葡萄糖添加量為10g/L。
2.1.3 培養基氮源種類的優化
由圖3可知,當無機氮源用作唯一的氮源時,菌株XJH-11產MDH的酶活較低。當利用酵母膏、牛肉膏、蛋白胨以及牛肉膏+蛋白胨時,酶活很高。因此,菌株XJH-11產MDH優先利用有機氮源。其中酵母膏作為氮源時酶活最高,為24.52U/mL。因此,酵母膏是菌株XJH-11產MDH的最適氮源。
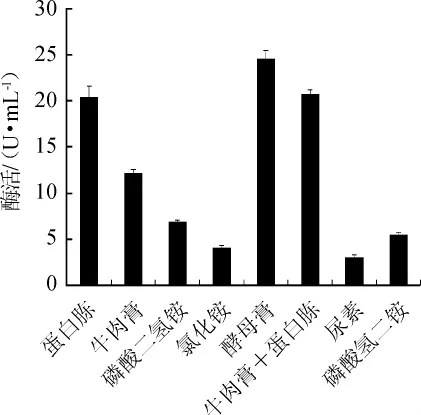
圖3 不同氮源種類對蘋果酸脫氫酶活力的影響Fig.3 Effect of different nitrogen sources on malic dehydrogenase activity
2.1.4 酵母膏添加量的優化
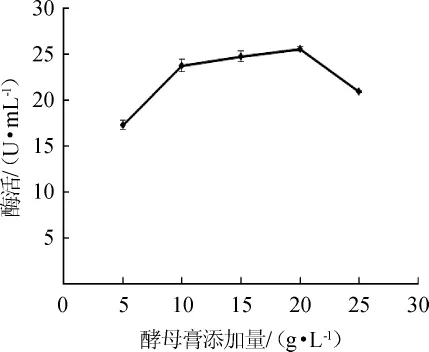
圖4 酵母膏添加量對蘋果酸脫氫酶活力的影響Fig.4 Effect of yeast extract addition on malic dehydrogenase activity
由圖4可知,酵母膏添加量為5~20 g/L時,酶活也隨之增加。當酵母膏添加量達到25 g/L時,酶活下降。這表明過量濃度的酵母膏對菌體的生長有一定抑制作用,進而影響MDH的合成。當酵母膏添加量達到20 g/L時,酶活最高,為25.61 U/mL。因此,最適酵母膏添加量為20 g/L。
2.1.5 培養基無機鹽種類的優化
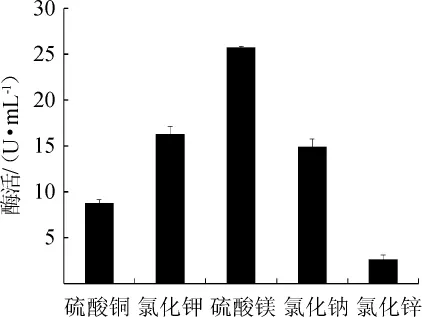
圖5 不同無機鹽種類對蘋果酸脫氫酶活力的影響Fig.5 Effect of different inorganic salts on malic dehydrogenase activity
由圖5可知,以硫酸鎂作為無機鹽時,菌株XJH-11產MDH酶活最高,為25.64 U/mL。原因可能是鎂離子參與穩定酶的構象,使其更易與底物接觸[16]。而氯化鉀和氯化鈉次之;原因可能是其有利于維持菌體細胞膜內外的滲透壓,能夠使菌體XJH-11更好的生長[17]。因此,硫酸鎂是菌株XJH-11產MDH的最適無機鹽。
2.1.6 硫酸鎂添加量的優化
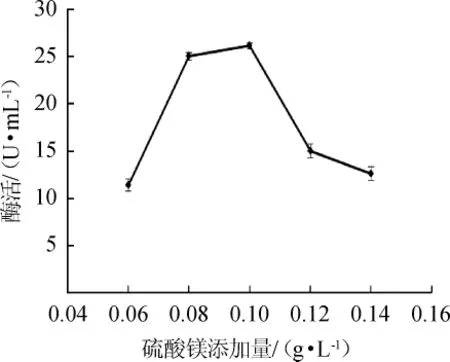
圖6 硫酸鎂添加量對蘋果酸脫氫酶活力的影響Fig.6 Effect of magnesium sulfate addition on malic dehydrogenase activity
由圖6可知,當硫酸鎂添加量為0.1 g/L時,MDH酶活最高,為26.13U/mL;硫酸鎂添加量為0.06g/L和0.14 g/L時,酶活分別為11.39 U/mL和12.59 U/mL;這表明硫酸鎂濃度過低或過高都會對菌體生長產生一定的抑制作用,從而影響酶的合成。因此,最適硫酸鎂添加量為0.1 g/L。
2.1.7 培養基初始pH值優化
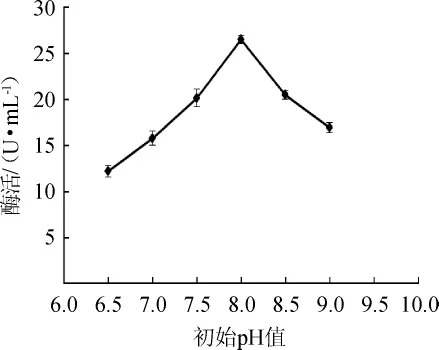
圖7 初始pH值對蘋果酸脫氫酶活力的影響Fig.7 Effect of initial pH value on malic dehydrogenase activity
由圖7可知,當發酵培養基初始pH值為6.5~8.0時,菌株XJH-11產MDH酶活也隨之增高;當初始pH值為8.0時,酶活最高,為26.47U/mL;當初始pH為8.5~9.0時,酶活雖有所下降,但仍具有較高的酶活,說明菌株XJH-11在堿性條件下,適合其產MDH。因此,發酵培養基最適初始pH值為8.0。
2.1.8 發酵溫度的優化
由圖8可知,當發酵溫度為10~25℃時,MDH酶活逐漸上升;發酵溫度為25℃時,MDH酶活最高,為26.87 U/mL;發酵溫度為30~40℃時,酶活隨之降低。因此,最適發酵溫度為25℃。
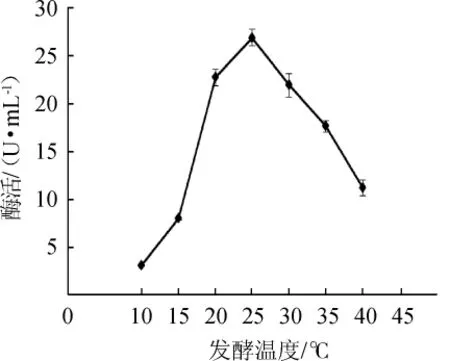
圖8 發酵溫度對蘋果酸脫氫酶活力的影響Fig.8 Effect of fermentation temperature on malic dehydrogenase activity
2.1.9 轉速的優化
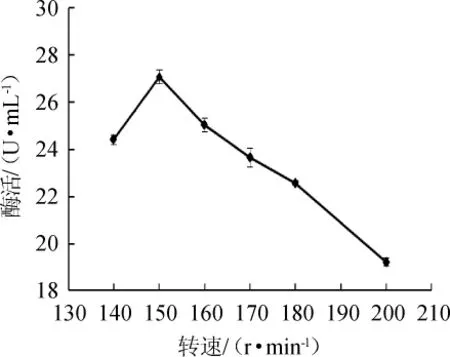
圖9 轉速對蘋果酸脫氫酶活力的影響Fig.9 Effect of shaking speed on malic dehydrogenase activity
由圖9可知,MDH酶活隨轉速在140~150r/min范圍內的增加而增高;當轉速為150r/min時,酶活最高,為27.06 U/mL;轉速>150 r/min之后,酶活隨之降低,可能是過高的轉速影響菌體的生長。因此,最適轉速為150 r/min。
2.1.10 裝液量的優化
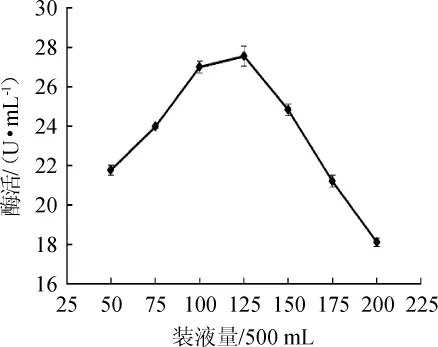
圖10 裝液量對蘋果酸脫氫酶活力的影響Fig.10 Effect of liquid loading volume on malic dehydrogenase activity
由圖10可知,當裝液量為(50~125)mL/500 mL時,菌株XJH-11產生的MDH酶活呈增加趨勢;當裝液量為125 mL/500 mL時,酶活最大,為27.54 U/mL;當裝液量為(150~200)mL/500mL時,酶活隨之下降。裝液量主要影響菌株對溶氧量的需求[18]。當裝液量為125 mL/500 mL時,實現了菌株XJH-11溶氧量的最佳值,促進了菌株的生長,并進一步提高了菌株產酶量。因此,最適裝液量為125mL/500mL。
2.1.11 接種量的優化
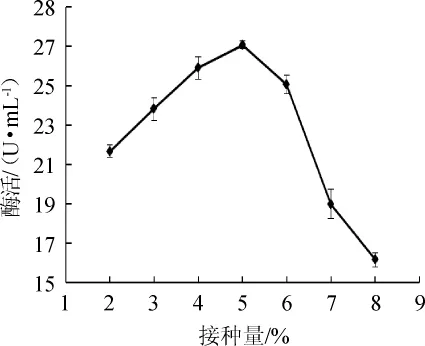
圖11 接種量對蘋果酸脫氫酶活力的影響Fig.11 Effect of inoculum on malic dehydrogenase activity
由圖11可知,當接種量為2%~5%時,菌株MDH隨著接種量的增加而增加;當接種量為5%時,酶活達到最大值,為27.08U/mL;當接種量>5%之后,酶活反而下降。這是因為培養基中的營養物質是有限的,培養基中菌體數目過多也會影響菌株的生長,進而影響菌株產酶。因此,最適接種量為5%。
2.2 Plackett-Burman設計篩選顯著因子[19-21]
基于單因素試驗,Plackett-Burman(N=12)試驗考察影響MDH發酵工藝中8個因素的顯著性。試驗的設計和結果如表2所示,主效應分析采用Design-Expert8.0.6軟件進行,結果如表3所示。
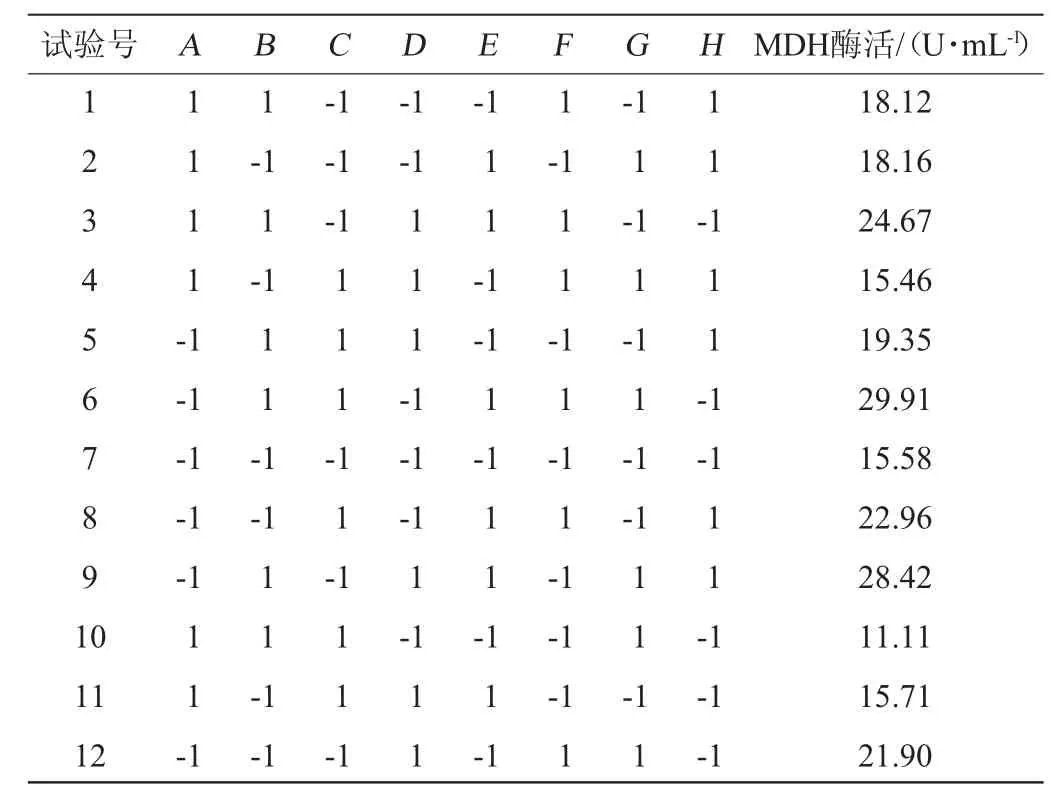
表2 Plackett-Burman試驗設計與結果Table 2 Design and results of Plackett-Burman experiments
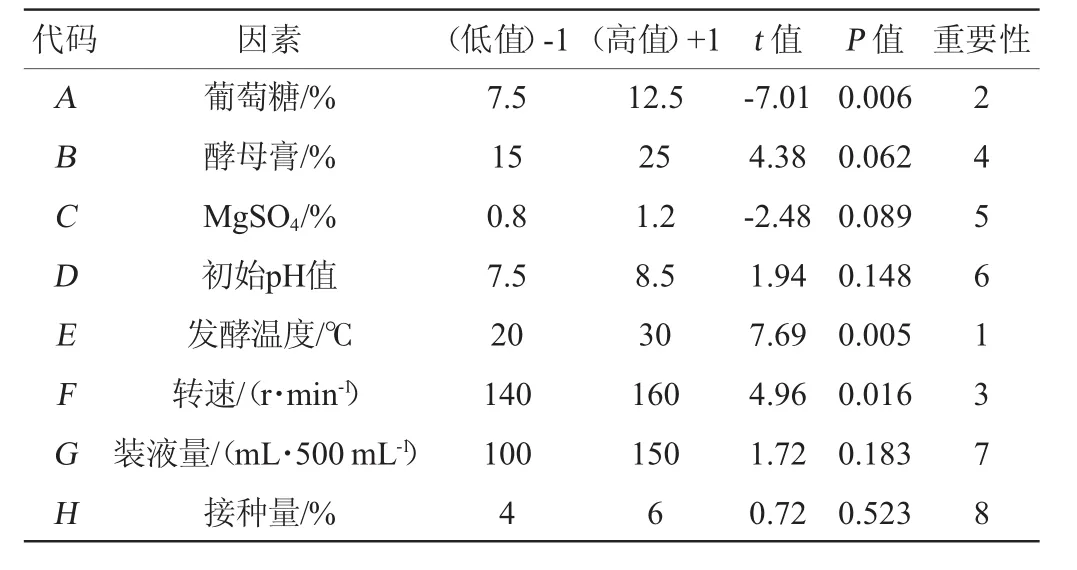
表3 Plackett-Burman設計的各因素水平及主效應分析Table 3 Factors,levels and main effects analysis of Plackett-Burman design
由表3可知,發酵溫度、葡萄糖添加量、轉速的P值分別為0.005、0.006、0.016,均<0.05,因此,發酵溫度、葡萄糖添加量和轉速這3個因素對試驗結果的影響均達到顯著水平,在所選因素中對試驗結果影響較大。發酵溫度與轉速具有正效應,葡萄糖具有負效應。因此,選擇發酵溫度、葡萄糖添加量和轉速設計響應面試驗。
2.3 最陡爬坡試驗
最陡爬坡試驗是確定逼近中心點的顯著影響因素的取值以及提高MDH的產量,發酵溫度、葡萄糖添加量、轉速這3個因素的變化方向和步長的試驗設計及結果如表4所示。由表4可知,3個顯著影響因素的中心點在第2組試驗附近,因此確定第2組的水平作為響應面試驗的中心點,即發酵溫度25℃、葡萄糖添加量10 g/L、轉速150 r/min。

表4 最陡爬坡試驗設計及結果Table 4 Design and results of the steepest ascent experiments
2.4 響應面試驗
利用上述Plackett-Burman試驗結果,基于PB試驗和最陡爬坡試驗確定的3因素3水平,以MDH酶活(Y)作為響應值,采用Design-Expert 8.0.6軟件進行設計,相關設計及結果見表5~表7。

表5 菌株XJH-11產蘋果酸脫氫酶條件優化響應面試驗因素與水平Table 5 Factors and levels of response surface experiments for malic dehydrogenase production conditions optimization by strain XJH-11
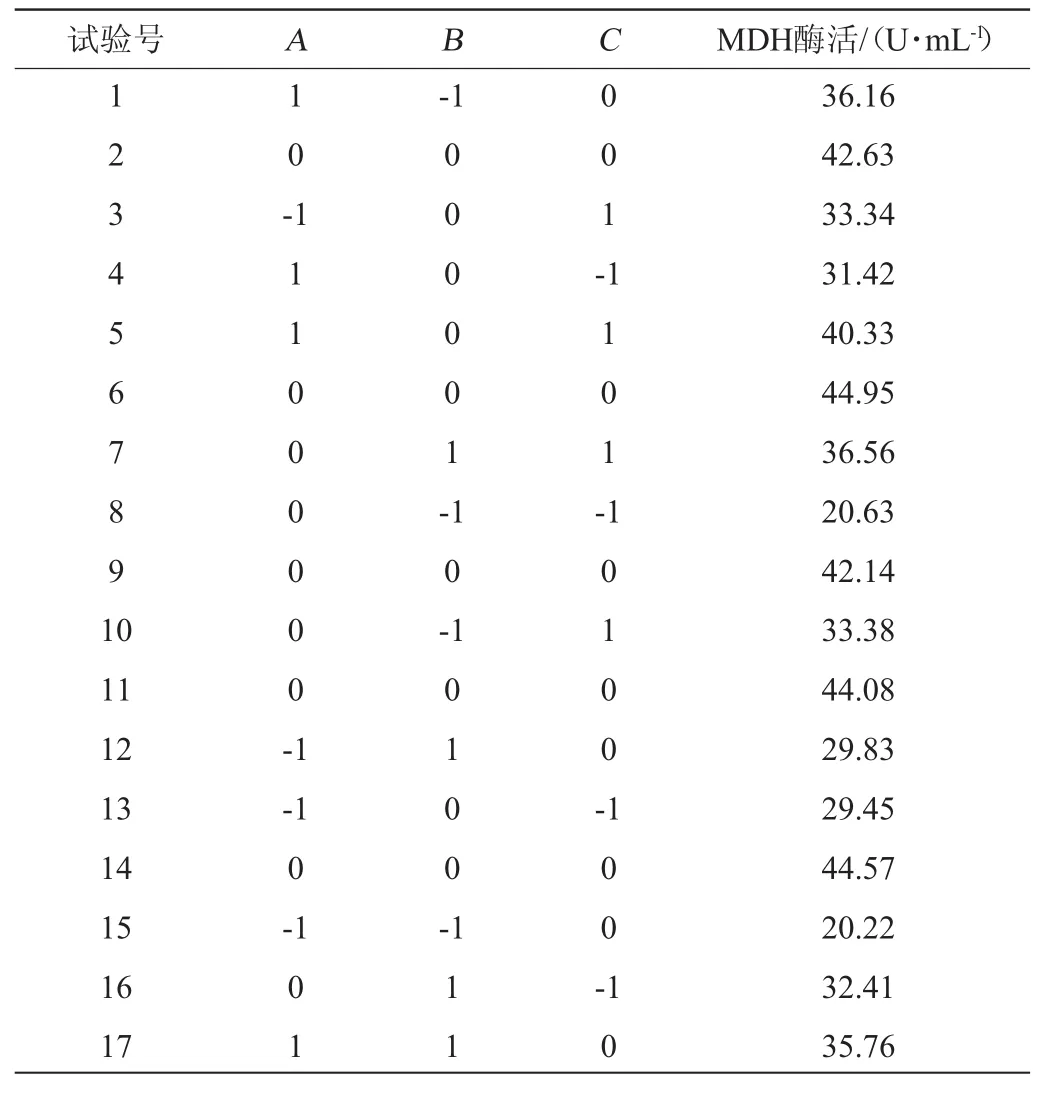
表6 菌株XJH-11產蘋果酸脫氫酶條件優化Box-Behnken試驗設計及結果Table 6 Design and results of Box-Behnken experiments for malic dehydrogenase production conditions optimization by strain XJH-11
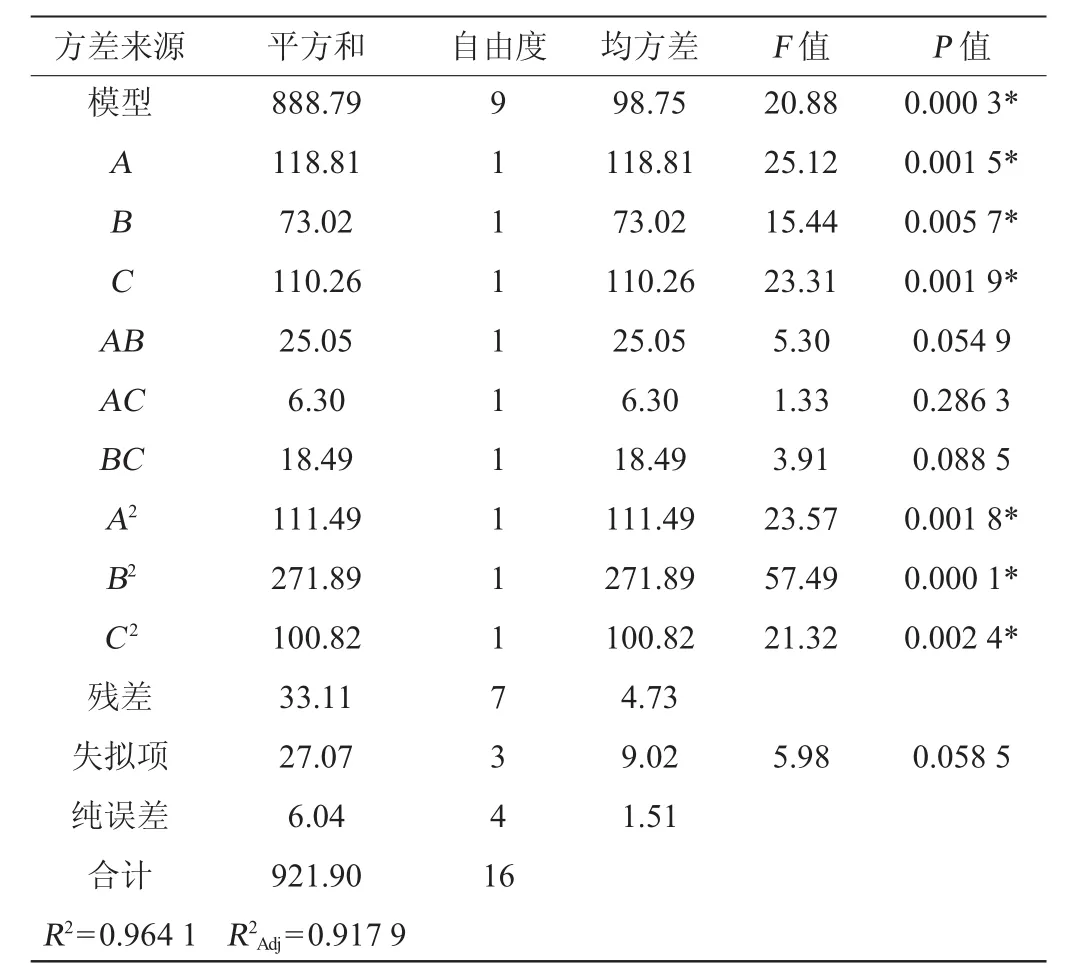
表7 回歸模型方差分析Table 7 Variance analysis of the quadratic model
由表7可知,所選回歸模型的P值<0.01,表明整體模型對試驗結果具有極顯著的影響,具有可信度;失擬項的P值為0.058 5>0.05,失擬項的檢驗不顯著,模型選擇適當。該模型的決定系數R2為0.9641,校正決定系數R2Adj為0.9179,表明模型可信度很高。MDH酶活性(Y)對發酵溫度(A)、葡萄糖添加量(B)、轉速(C)的多元二次方程為:Y=43.67+3.85A+3.02B+3.71C-2.50AB+1.25AC-2.15BC-5.15A2-8.04B2-4.89C2。該回歸方程可用于代替試驗實際點進行初步分析和預測[22-24]。
利用Design-Expert8.0.6軟件繪制響應面曲線圖,結果見圖12。由圖12可知,經軟件分析,響應值存在最大值,得出最適發酵條件為發酵溫度27.04℃,葡萄糖添加量10.2 g/L,轉速154.18r/min,軟件分析預測最大酶活為45.34U/mL。為了便于試驗操作,將發酵條件修改為發酵溫度27℃,葡萄糖添加量10g/L,轉速150r/min。在此條件下進行5次驗證試驗,平均酶活為43.67 U/mL,接近理論值,表明響應面法得到的最佳條件準確可靠。優化后的酶活比優化前的22.07 U/mL提高了197.87%。
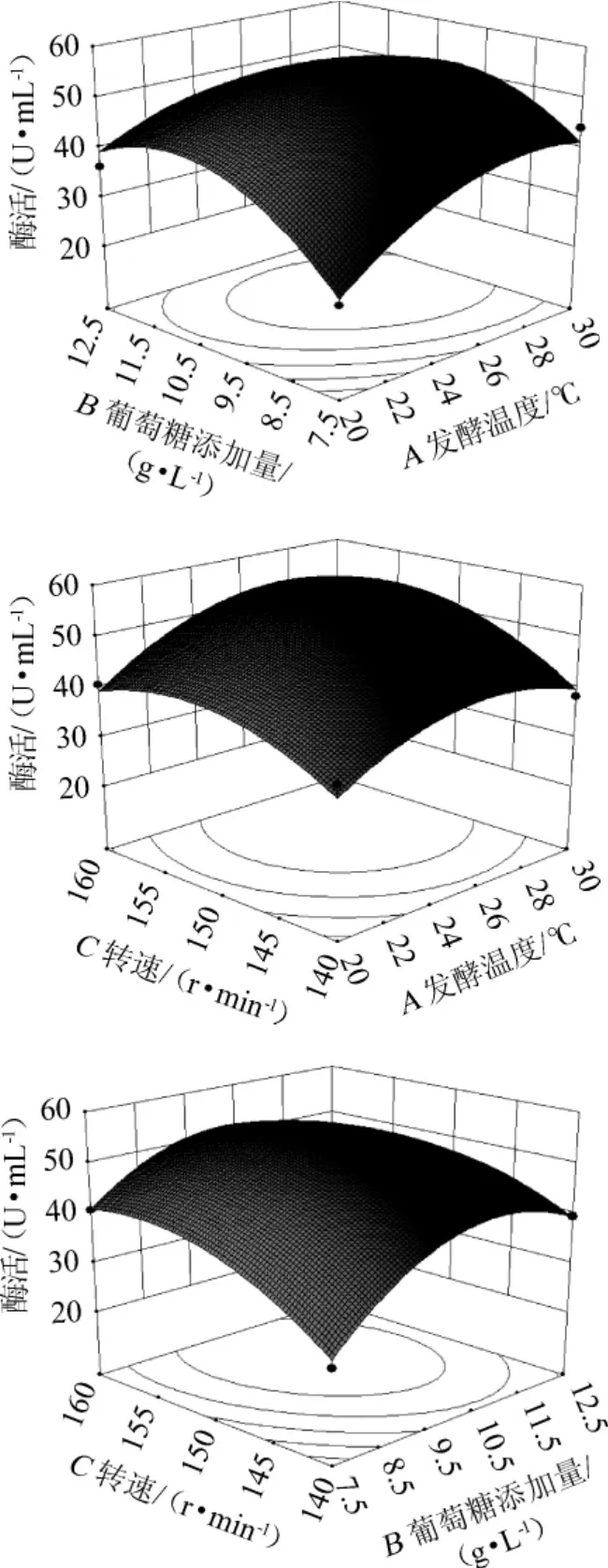
圖12 發酵溫度、葡萄糖添加量和轉速交互作用對蘋果酸脫氫酶活力影響的響應曲面與等高線Fig.12 Response surface plots and contour line of effects of interaction between fermentation temperature,glucose addition and shaking speed on MDH activity
3 結論
本研究以單因素為基礎,采用響應面試驗對墓畫大洋芽孢桿菌(Oceanobacillus picturae)XJH-11產MDH發酵條件進行研究,得到最佳發酵條件:發酵培養基為葡萄糖10 g/L、酵母膏20 g/L、硫酸鎂0.1 g/L、初始pH值為8.0,最優發酵條件為發酵溫度27℃、搖床轉速150 r/min、接種量5%、裝液量125 mL/500 mL。在此優化條件下,MDH酶活為43.67 U/mL,比優化前提高了197.87%。

