花椰菜松散型胚性愈傷組織的誘導
史滟滪 劉艷軍 楊靜慧 牟坤

摘 ? ?要:本研究采用花椰菜組培苗不同外植體誘導愈傷組織,從中篩選出理想外植體類型;將誘導出的愈傷組織轉移到不同培養基上進行松散型愈傷組織的誘導,從中篩選出理想的培養基配方;將誘導出的花椰菜松散型愈傷組織轉接到不同的胚性愈傷組織誘導培養基上,找到理想的培養基配方。試驗結果表明,選用花椰菜組培苗莖段為外植體,在MS+0.5 mg·L-1BA+1.0 mg·L-12,4-D+30 g·L-1蔗糖的培養基上進行愈傷組織誘導,可以獲得松散型愈傷組織;在MS+1 mg·L-1BA+1 mg·L-12,4-D+30 g·L-1蔗糖的培養基上通過3~4次繼代培養,可以誘導出花椰菜松散型胚性愈傷組織。
關鍵詞:花椰菜;外植體;胚性愈傷組織;激素
中圖分類號:S635.3 ? ? ? ? ?文獻標識碼:A ? ? ? ? ? DOI 編碼:10.3969/j.issn.1006-6500.2019.05.003
Induction of Loose Embryogenic Callus in Cauliflowe
SHI Yanyu1, LIU Yanjun1, YANG Jinghui1, MU Kun2
(1.Department of ?Horticulture, Tianjin Agricultural University, Tianjin 300384, China;2. Tianjin Yuanda Landscape Engineering Company Limited, Tianjin 301600, China)
Abstract: In this study, the callus was induced by different explants of cauliflower tissue culture seedlings, and the ideal explant type was selected. The induced callus was transferred to different media for the induction of loose callus; The induced cauliflower loose callus was transferred to different embryogenic callus induction medium to find the ideal medium formula. The results showed that the stem segments of cauliflower tissue culture seedlings were used as explants on MS+0.5 mg·L-1BA+1.0 mg·L-12,4-D+30 g·L-1sucrose medium for callus induction, and loose callus was obtained. The cauliflower loose embryogenic callus could be induced by 3~4 subcultures on MS+1 mg·L-1BA+1 mg·L-12,4-D+30 g·L-1sucrose medium.
Key words: cauliflower; explants; embryogenic callus; hormone
花椰菜也叫菜花,是一種廣泛種植的蔬菜品種,其營養豐富受到消費者的普遍歡迎。近年來,有關花椰菜的育種研究較多[1-5],培育了許多好的品種。但隨著社會的發展,對新的種質資源需求越來越多,采用傳統的雜交技術已經不能滿足育種的需求,誘變育種和基因轉化等新的育種手段相繼出現,這些育種技術的應用都需要離體再生技術的輔助,因此建立高效的體細胞再生體系十分必要。
松散型胚性愈傷組織由于其結構松散,不但可以提高誘變和轉化效率[6-11],而且胚性愈傷組織易于再生,可在短時間內獲得大量的再生植株,從而加快突變株或轉化株的成苗率,為體細胞離體誘變和基因轉化研究奠定基礎。本研究旨在通過選用不同外植體和不同的誘導培養基進行花椰菜松散型胚性愈傷組織誘導,建立高效的花椰菜再生體系。
1 材料和方法
1.1 材 料
本試驗所用的花椰菜品種雪劍4號由天津市耕耘種業有限公司提供,經過種子消毒,獲得無菌苗。在實驗室中繼代培養,為試驗提供外植體。
1.2 方 法
1.2.1 采用不同花椰菜組培苗部位為外植體誘導愈傷組織 在超凈臺中剪取花椰菜組培苗的葉片、葉柄和莖段作為外植體。其中葉片用剪刀前成大小2 cm的小塊,葉柄兩端造成傷口,莖段不要帶有側芽。將處理好的外植體接種到事先配制好的愈傷組織誘導培養基上。培養基的配方為:MS+2 mg·L-12,4-D+30 g·L-1蔗糖,加入7 g·L-1的瓊脂粉,pH值調節到5.8。將接過種的三角瓶放置到培養室中進行愈傷組織誘導。愈傷組織誘導條件為:24 h連續光照,采用1 000~2 000 Lux的光照強度,培養溫度設置為25 ℃。
1.2.2 誘導愈傷組織的培養基配方篩選 將前一步驟誘導出的花椰菜愈傷組織從外植體上切下,在培養皿中用解剖刀將其分割成直徑為2~3 mm大小的顆粒。將分割好的愈傷組織接種到事先配制好的含有不同激素的愈傷組織誘導培養基上,培養基編號依次為1、2、3、4、5、6、7。其具體配方為:1.MS+0.5 mg·L-12,4-D+30 g·L-1蔗糖;2.MS+1.0 mg·L-12,4-D+30 g·L-1蔗糖;3.MS+0.5 mg·L-1BA+30 g·L-1蔗糖;4.MS+0.5 mg·L-12,4-D+0.5 mg·L-1BA +30 g·L-1蔗糖;5.MS+0.5 mg·L-12,4-D+1 mg·L-1BA +30 g·L-1蔗糖;6.MS+1 mg·L-12,4-D+0.5 mg·L-1BA +30 g·L-1蔗糖;7.MS+2 mg·L-12,4-D+1 mg·L-1BA +30 g·L-1蔗糖。愈傷組織培養條件與步驟1相同,接種后大約30 d統計試驗結果。
1.2.3 花椰菜胚性愈傷組織的誘導 將上一步驟誘導出的愈傷組織在超凈臺再次進行分割,并接種到事先配制好的胚性愈傷組織誘導培養基上,培養基編號依次為8、9、10、11、12、13、14、15、16、17。其具體配方為:8.MS+0.5 mg·L-12,4-D+0.5 mg·L-1BA+30 g·L-1蔗糖;9.MS+0.5 mg·L-12,4-D+1 mg·L-1BA+30 g·L-1蔗糖;10.MS+1 mg·L-12,4-D+0.5 mg·L-1BA+30 g·L-1蔗糖;11.MS+1 mg·L-12,4-D+1 mg·L-1BA+30 g·L-1蔗糖;12.MS+1 mg·L-12,4-D+2 mg·L-1BA+30 g·L-1蔗糖;13.MS+0.5 mg·L-12,4-D+0.5 mg·L-1KT+30 g·L-1蔗糖;14.MS+1 mg·L-12,4-D+1 mg·L-1KT+30 g·L-1蔗糖;15.MS+1 mg·L-12,4-D+2 mg·L-1KT+30 g·L-1蔗糖;16.MS+1 mg·L-1BA+30 g·L-1蔗糖;17.MS+1 mg·L-1KT+30 g·L-1蔗糖。在培養過程中采用每14 d繼代培養1次,繼代用培養基都與前面所用相同,培養條件為:24 h連續光照,采用2 000~3 000 Lux的光照強度,培養溫度設置為23 ℃。經過大約3~4次繼代培養,對愈傷組織的結構與性質進行鑒定,先采用顯微鏡觀察愈傷組織細胞結構,判斷愈傷組織類型;另外采用轉接愈傷組織到無激素的MS培養基上,通過愈傷組織的再生情況來判斷愈傷組織的胚性。
2 結果與分析
2.1 不同外植體對花椰菜愈傷組織誘導的影響
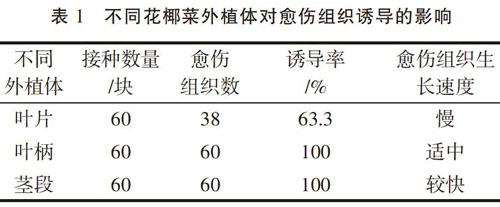
將不同花椰菜外植體接種到愈傷組織誘導培養基上,經過7 d時間,在部分外植體的傷口部位長出少量的愈傷組織,隨著培養時間的延長,愈傷組織的數量也在增加,經過30 d的培養,大部分外植體上長出了愈傷組織,具體情況見表1。
從表1的結果可以看出,大部分外植體都可以誘導出愈傷組織,說明花椰菜容易獲得愈傷組織。從愈傷組織誘導率來看,除了葉片外,莖段和葉柄愈傷組織誘導率均為100%;從愈傷組織生長速度來看,從葉片上誘導出的愈傷組織生長速度很慢,一般是靠近葉柄部位才有少量愈傷組織長出;葉柄一端誘導出的愈傷組織較多,愈傷組織生長速度也較快,但和莖段相比,愈傷組織生長速度不如莖段,說明莖段是理想的愈傷組織誘導外植體。
2.2 不同激素組合對花椰菜愈傷組織生長的影響
由于上一步驟誘導出的花椰菜愈傷組織多為白色或半透明的緊密型類型,這類愈傷組織生長速度慢,一般很難繼續誘導出胚性愈傷組織,為此本試驗采用不同激素組合的愈傷組織誘導培養基對這類愈傷組織繼續培養,目的是獲得理想的愈傷組織類型。愈傷組織經過大約30 d的培養,在不同培養基中愈傷組織的生長情況明顯不同,具體結果見表2。
從表2可以看出,不同激素配比花椰菜愈傷組織生長速度和生長質量不同。單獨使用2,4-D時(1號和2號培養基)愈傷組織生長緩慢,誘導出的愈傷組織為白色緊密型愈傷組織,這類愈傷組織很難再生和胚性化,是一種不能繼續分化的愈傷組織類型;在2,4-D與BA的比值較低時,即高濃度的BA和低濃度的2,4-D配合使用時(3號、4號和5號培養基),愈傷組織生長緩慢,愈傷組織質地較硬,為綠色或白色愈傷組織,這類愈傷組織雖然可以再生,但只是愈傷組織外圍少數細胞可以再生,在其內部多數進行組織分化,形成維管組織并纖維化,最后木質化后細胞死亡。這類愈傷組織也不是我們需要的類型;在2,4-D與BA的比值較高時(6號和7號培養基),誘導出的愈傷組織生長速度較快,愈傷組織結構也變得松散,多為淡綠色愈傷組織,這類愈傷組織一般很容易再生,可以進一步培養成胚性化愈傷組織,并且其結構松散,再生效率變得更高,這類愈傷組織正是我們需要誘導的愈傷組織類型。綜合以上試驗結果,MS+0.5 mg·L-1BA+1 mg·L-12,4-D+30 g·L-1蔗糖的培養基為理想的花椰菜愈傷組織誘導培養基。
2.3 不同培養基配方對花椰菜愈傷組織胚性化的影響
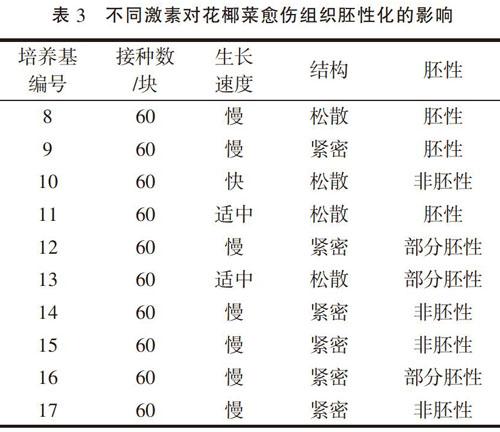
將上一步驟獲得的松散型花椰菜愈傷組織,轉接到胚性化愈傷組織誘導培養基上,進行愈傷組織胚性化的誘導。經過大約60 d時間,4次繼代培養,每次繼代時通過對愈傷組織的選擇,每種培養基獲得的愈傷組織生長效果不同,具體情況見表3。
從表3可以看出,采用不同分裂素與2,4-D配合使用對花椰菜愈傷組織結構、生長速度和胚性化影響較大(8、11、13號培養基)。具體來看,在單獨使用分裂素時,愈傷組織生長變慢,愈傷組織質地變得緊密,經過BA的處理后,愈傷組織變成綠色,并隨著培養時間的延長,在愈傷組織表面出現芽原基和再生出不定芽,只是數量較少,而采用KT時,隨著培養時間的延長,愈傷組織開始褐變并逐漸死亡。這說明單獨使用分裂素會促進愈傷組織提早分化,并且KT可能對花椰菜產生了毒害作用,不但不能促進花椰菜愈傷組織分化,反而加快了愈傷組織老化、死亡;采用KT與2,4-D配合使用時(14、15號培養基),在較低濃度的KT時愈傷組織生長正常,只是不能出現胚性化,而在較高濃度的KT時,不但不能出現胚性化現象,相反,愈傷組織生長緩慢,變得緊密,并出現褐變情況,說明KT對花椰菜胚性化沒有作用,高濃度還會造成愈傷組織褐變死亡;當采用BA與2,4-D配合使用時,在適合的濃度配比下(1 mg·L-1BA+1 mg·L-12,4-D)(11號培養基),愈傷組織結構松散,生長速度適中,而且所有愈傷組織都呈現出胚性化現象,說明BA是誘導花椰菜胚性愈傷組織的理想分裂素。因此,綜合以上試驗結果,選擇MS+1 mg·L-1BA+1 mg·L-12,4-D+30 g·L-1蔗糖的培養基上通過3~4次繼代培養,可以誘導出花椰菜胚性愈傷組織。
3 結論與討論
3.1 不同分裂素與2,4-D的比值對于愈傷組織結構特性的影響
在本試驗中,通過采用不同分裂素與2,4-D的使用濃度的比值,可以獲得理想的愈傷組織結構類型,主要原理是:一般情況下,2,4-D對于愈傷組織細胞的分裂與增大生長有較強的促進作用,并可以維持細胞的結構特點,即細胞液泡較大、細胞比較薄,細胞質濃度較低;因此,單一使用2,4-D會維持愈傷組織類型不變,但對于細胞的分化不利。一些質地較硬、結構松散的愈傷組織是由一些個體較小、分裂旺盛、液泡較小,細胞壁增厚的細胞類型組成,因此,在培養基中加入適當的分裂素就會改變細胞的類型,從而獲得理想的愈傷組織,但并不是簡單加入分裂素就可以起到對愈傷組織結構進行有目的的調整,應該采用適當的比例,才能控制愈傷組織不會向著極端方向轉變,如試驗中出現的結果,是在適合的比值下才會獲得理想的結果。
3.2 不同分裂素種類對愈傷組織胚性化的影響
通常情況下,在分裂素水平較高的情況下可以促進細胞的分化,也就是可以改變愈傷組織細胞的性質,向著胚性化方向或其他組織分化方向轉變,而2,4-D是一種維持細胞的愈傷組織特性和促進細胞生長的一種激素,因此,獲得胚性化的愈傷組織的必要條件就是分裂素配合一定濃度的2,4-D。但并不是所有分裂素都能促進愈傷組織細胞的胚性化,如本試驗中采用的KT分裂素就不能使花椰菜愈傷組織胚性化,相反還對愈傷組織有一定的毒害作用,這說明不同植物對激素的選擇是不一樣的,通過選擇不同的分裂素,觀察其對愈傷組織生長的影響來判斷選擇的正確性,因此,本試驗采用BA可以獲得理想的花椰菜胚性愈傷組織。
通過以上試驗,筆者獲得了雪劍菜花松散型胚性愈傷組織誘導方法,現將其操作步驟總結如下:選用花椰菜組培苗莖段為外植體,將其剪成小段,不帶腋芽;在MS+0.5 mg·L-1BA+1.0 mg·L-12,4-D+30 g·L-1蔗糖的培養基上進行愈傷組織的誘導。經過大約30 d時間可以誘導出花椰菜結構良好的愈傷組織;再將誘導出的愈傷組織切成小塊,在MS+1 mg·L-1BA+1 mg·L-12,4-D的培養基上進行培養,通過3~4次繼代培養,可以誘導出花椰菜胚性松散型胚性愈傷組織。
參考文獻:
[1]邰翔.花椰菜非毛花基因RAPD標記轉SCAR標記[C]// 中國園藝學會.中國園藝學會2015年學術年會論文摘要集,2015.
[2]樓玨,張小玲,羅天寬,等.利用SSR和SRAP標記分析花椰菜自交系的遺傳多樣性[J].分子植物育種,2015,13(3):605-614.
[3]胡立敏,陶興林,朱惠霞,等.花椰菜新品種圣雪3號的選育[J].中國蔬菜,2015(1):55-56.
[4]林琿,朱海生,陳敏氡,等.花椰菜游離小孢子培養技術研究進展[J].中國農學通報,2014,30(13):71-75.
[5]黃俊軒,劉艷軍,李建科,等.以花椰菜花球為外植體的離體再生體系的建立[J].北方園藝,2014(5):88-90.
[6]嚴小峰,劉艷軍,黃俊軒,等.冰燈玉露松散型胚性愈傷組織的誘導方法[J].天津農業科學,2017,23(7):21-24,36.
[7]國秀麗.棉花根系形態和磷效率對土壤鹽度、供磷強度和AM真菌的響應[D].北京:中國農業大學,2017.
[8]史滟滪,楊靜慧,劉婷,等.馬鈴薯松散型胚性愈傷組織的誘導[J].天津農業科學,2016,22(12):20-23.
[9]劉艷軍,張超,楊靜慧,等.塔楊松散型均質胚性愈傷組織培養體系[J].植物研究,2016,36(1):123-128,133.
[10]苗博瑛,劉艷軍,楊靜慧.黑莓松散型胚性愈傷組織的誘導[J].山西農業科學,2014,42(3):209-212,216.
[11]賴鐘雄,黃淺,林秀蓮,等.荔枝胚性懸浮細胞系的快速建立及其體胚植株的再生[J].中國農學通報,2007(1):28-32.

