食管癌細胞株Eca109中cdc42基因啟動子區CpG島甲基化調控報告基因的表達
劉 玲,陳 艷,李 卉,張法煌,李依珂,伊麗達娜·斯提瓦爾地,喻 亮,李惠武
表觀遺傳學是指在不改變基因序列的前提下對基因表達的調控,最常見的修飾是DNA甲基化[1]。其通過S-腺苷甲硫氨酸(S-adenosyl methionine, SAM)將甲基添加到胞嘧啶的基因組上[2]。甲基化狀態的增減,脫甲基化,會使相關基因的功能改變,導致細胞變化,包括癌癥、自體免疫反應和衰老相關的變化[3]。在子宮內膜癌[4]、腎透明細胞癌[5]、胃癌[6]中均存在基因的啟動子區甲基化改變。腫瘤抑制基因啟動子區域的甲基化引起基因表達的紊亂也存在于食管癌變過程[7-8]。
細胞周期分裂蛋白42(cell division cycle 42,cdc42)是小GTP酶,屬Rho家族的成員,可以調節細胞骨架組織和膜運輸等生理過程[9]。其啟動子區CpG島甲基化的變化對基因表達的調控尚未見報道。該研究應用分子克隆及薄層層析技術,構建cdc42基因啟動子區CpG島DNA序列連接報告基因氯霉素乙酰基轉移酶(cdc42-chloramphenicol acetyl transferase,cdc42-CAT)的表達載體,經CpG島的DNA序列甲基化修飾,轉染食管癌細胞株Eca109后,檢測含CpG島甲基化修飾與未甲基化修飾DNA片段對下游CAT的影響,為確定cdc42基因啟動子區CpG島甲基化變化參與cdc42表達的調控提供直接證據。
1 材料與方法
1.1 引物設計及載體構建
1.1.1引物設計 在基因數據庫(GenBank)中查詢候選基因cdc42和任意一段不含CpG島的DNA序列(Random),應用Primer 5.0軟件設計引物,引物序列及熔解溫度(melting temperature,Tm)見表1。
1.1.2PCR擴增 PCR反應條件見表2。
1.1.3電泳及測序鑒定 2%的瓊脂糖凝膠電泳鑒定PCR產物cdc42及random序列。并將PCR產物20μl送上海生工測序鑒定其正確性。
1.1.4PCR片段與pUCm-T載體(pUCm-T Vector)重組體的構建及轉化 ① PCR產物的添A:利用添A試劑盒,加入以下試劑至EP管中:10×A tailing Buffer 5 μl,dATP mix 1 μl,Taq DNA聚合酶1 μl,PCR產物30 μl,ddH2O 13 μl,置PCR儀72 ℃保溫10 min。② 添A產物的回收:將添A產物經2%瓊脂糖電泳后,紫外燈下割膠回收,再經膠回收試劑盒得到純化的PCR產物。③ PCR產物與pUCm-T載體重組體的構建及轉化:按說明書將甲基化酶缺陷的大腸桿菌ER1793及可維持甲基化狀態的大腸桿菌JM109 37 ℃制備為感受態細胞。PCR產物與pUCm-T載體通過連接試劑盒連接,16 ℃作用12 h后,分別轉化至感受態細胞。

表1 cdc42及任意一段序列擴增引物序列

表2 PCR反應條件
1.1.5陽性克隆的篩選及陽性克隆菌載體的測序鑒定 ① 通過藍白斑篩選陽性克隆菌后,經質粒提取試劑盒提取質粒。② 以提取的質粒為模板,分別采用雙酶切進行酶切。cdc42用KpnⅠ及BglⅡ酶切(加bufferⅠ及KpnⅠ酶切30 min后,再加bufferⅡ和BglⅡ酶切30 min),Random用XhoⅠ及BglⅡ37 ℃酶切1 h。③ 酶切產物通過2%瓊脂糖凝膠電泳,紫外燈下切膠并用膠回收試劑盒回收,電泳鑒定。PCR擴增目的片段。④ 并將篩選的含陽性克隆的菌液送上海生物工程服務公司測序鑒定其正確性。
1.1.6甲基化修飾試劑盒修飾 將酶切后的PCR產物分組,一組進行甲基化修飾,一組不進行任何處理。其中SAM為活性甲基供體。將甲基化修飾體系充分混勻(上下顛倒6次)。置37 ℃ 孵育1 h。65 ℃加熱20 min使修飾反應停止。反應終止后,在該體系中加入異丙醇1 ml沉淀甲基化修飾的PCR片段,離心,晾干,加20 μl 三羥甲基氨基甲烷-乙二胺四乙酸(Tris-EDTA,TE)溶解DNA。甲基化酶修飾體系見表3。

表3 甲基化修飾體系
1.1.7目的片段與雙酶切后的p氯霉素乙酰基轉移酶3-增強子(p chloramphenicol acetyl transferase 3-Enhancer, pCAT3-Enhancer)重組載體的構建 將pCAT3-Enhancer載體雙酶切,經電泳后膠回收試劑盒回收。將未甲基化修飾的3個目的片段與pCAT3-Enhancer連接,與pCAT3-Enhancer空載體分別轉化至E.coliER1793中(甲基化酶缺陷),將甲基化修飾的3個目的片段與pCAT3-Enhancer連接,與pCAT3-Enhancer空載體分別轉化至E.coliJM109中(維持甲基化狀態)。E.coliJM109經氨芐抗性及藍白斑篩選陽性克隆,ER1793經氨芐抗性篩選,質粒提取試劑盒提取重組載體,酶切及PCR擴增鑒定,送測序鑒定其正確性。
1.2 重組載體分組與轉染將獲得的重組載體分6組,在大腸埃希菌E.coliJM109中轉化的重組體有:cdc42甲基化啟動子區、甲基化修飾的任意片段以及pCAT3-Enhancer載體。在E.coliER1793中轉化的重組體有:cdc42啟動子區、任意片段及pCAT3-Enhancer空載體。將6種載體轉染至食管癌細胞株Eca109中。將食管癌細胞株Eca109 2 ml接種于6孔板中,24 h后吸去培養液,加入1.5 ml 無抗培養液。加入轉染試劑Opti-MEM及載體,完成后輕輕旋轉混勻,37 ℃孵育6 h后,換為常規培養液,37 ℃孵育42 h。
1.3 CAT表達產物的提取及活性檢測、定量
1.3.1CAT表達產物的提取 移去培養液,用1× PBS buffer輕洗3次,加入200 μl 1× reporter lysis buffer,輕搖浸沒細胞。室溫靜置15 min。用新的細胞刮刀刮擦板孔,傾斜6孔板,將細胞溶解產物轉移到新的EP管中,旋轉混勻10 ~15 s(冰浴),部分樣品(用于CAT酶檢測)60 ℃水浴鍋放置10 min(目的是將內源性乙酰化酶失活)。13 000 r/min離心2 min,上清轉移至新的EP管中。其余樣品置于低溫冰箱中。
1.3.2CAT活性檢測 在新的EP管中加入細胞提取物100 μl,加入CAT活性檢測試劑(n-丁酰CoA 5 μl,氯霉素0.75 μl),加雙蒸水至125 μl。設立陽性、陰性以及空白對照。37 ℃水浴鍋放置6 h,之后置于高速離心機12 000 r/min瞬時離心。離心后加入500 μl乙酸乙酯,渦旋混勻1 min,12 000 r/min離心3 min,轉移上層有機相至另一新的EP管中。開蓋室溫放置12 h,用以干燥樣品。干燥后的樣品中加入30 μl乙酸乙酯,反復吹吸懸浮樣品,加樣于層析板上,薄層層析,結束后將層析板用塑料紙包裹,然后在X線片下曝光。
1.3.3放射自顯影檢測 通過在層析板上出現的自顯影的斑點數及位置來檢測CAT催化氯霉素乙酰化的能力高低。斑點數越多及位置越靠前,代表CAT催化氯霉素乙酰化的能力越高。
1.3.4CAT活性的定量分析 Bio-Rad Quantityone軟件分析,灰度掃描后得到各乙酰化的氯霉素點的吸光度(optical density,OD)值,以吸光度為參數比較各組差異。
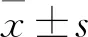
2 結果
2.1cdc42啟動子區CpG島及一不含CpG的Random序列PCR擴增結果電泳結果顯示,通過PCR擴增,得到cdc42啟動子區CpG島(標注1),片段大小853 bp;以及一不含CpG的Random序列(標注2),片段大小317 bp。見圖1。

圖1 cdc42啟動子區CpG島及一不含CpG的Random序列PCR擴增圖
M:Marker;1為cdc42啟動子區CpG島,片段大小853 bp;2為任意一段不含CpG的Random 序列,片段大小317 bp
2.2 甲基化修飾結果在體外將cdc42及Random片段CpG位點進行甲基化修飾,之后進行甲基化檢測,甲基化修飾結果見表4。
2.3 對構建的重組體進行酶切酶切電泳結果見圖2。結果顯示,甲基化后cdc42啟動子區CpG島-pCAT3-Enhancer 重組體大小5 120 bp(標注1), 甲基化后cdc42啟動子區CpG島-pCAT3-Enhancer 重組體酶切,大片段為載體4 273 bp,小片段為cdc42啟動子區CpG島847 bp(標注2),非甲基化cdc42啟動子區CpG島-pCAT3-Enhancer重組體(標注3),非甲基化cdc42啟動子區CpG島-pCAT3-Enhancer 重組體酶切,大片段為載體4 273 bp,小片段為cdc42啟動子區CpG島847 bp(標注4),甲基化后Random-pCAT3-Enhancer 重組體4 548 bp(標注5),非甲基化的Random-pCAT3-Enhancer重組體(標注6),甲基化后Random-pCAT3-Enhancer 重組體酶切,大片段為載體4 273 bp,小片段為Random311 bp(標注7),非甲基化的Random-pCAT3-Enhancer 重組體酶切,大片段為載體4 273 bp,小片段為Random311 bp(標注8)。

表4 cdc42及Random甲基化修飾程度表

圖2 重組載體及酶切電泳圖
M:Maker;1:甲基化的cdc42啟動子區CpG島-pCAT3-Enhancer重組質粒;2:甲基化的cdc42啟動子區CpG島-pCAT3-Enhancer重組質粒酶切,大片段為4 273 bp的載體,小片段為853 bp的cdc42啟動子區CpG島;3:非甲基化的cdc42啟動子區CpG島-pCAT3-Enhancer重組質粒;4:非甲基化的cdc42啟動子區CpG島-pCAT3-Enhancer重組質粒酶切,大片段為4 273 bp的載體,小片段為853 bp的cdc42啟動子區CpG島;5:甲基化的Random-pCAT3-Enhancer重組質粒;6:非甲基化的Random-pCAT3-Enhancer重組質粒;7:甲基化的Random-pCAT3-Enhancer 重組質粒酶切,大片段為4 273 bp的載體,小片段為317 bp的Random;8:非甲基化的Random-pCAT3-Enhancer重組質粒酶切,大片段為4 273 bp的載體,小片段為317 bp的Random
2.4 CAT表達的薄層層析結果薄層層析結束后將層析板用塑料紙包裹,在X線片下曝光后結果,2號、7號及9號樣品在14碳氯霉素斑點的前面出現第2個乙酰化氯霉素斑點,2號,9號樣品出現第3個二乙酰化氯霉素斑點。斑點的數目與CAT活性成正比。見圖3。

圖3 薄層層析法檢測CAT的活性圖
1:空白對照,2:陽性對照;3:陰性對照;4:Random甲基化重組體;5:Random非甲基化重組體;6:cdc42甲基化重組體;7:cdc42非甲基化重組體;8:甲基化pCAT3-Enhancer載體;9:非甲基化pCAT3-Enhancer載體
2.5 薄層層析分析報告基因CAT活性薄層層析后將X線片在凝膠成像儀中拍照,用Bio-Rad Quantityone軟件分析,獲得各乙酰化氯霉素點的OD值,見圖4。經方差分析,多組均數比較得到F=1 081 214.623。與空白對照組比較,各組OD值差異有統計學意義(P<0.01),Random甲基化重組載體與Random非甲基化重組載體組比較,表達差異無統計學意義(P>0.05),cdc42甲基化重組載體與cdc42非甲基化重組載體比較,表達顯著增高,差異有統計學意義(P<0.01)。

圖4 CAT活性OD值比較圖
1:空白對照,2:陽性對照;3:陰性對照;4:Random甲基化重組體;5:Random非甲基化重組體;6:cdc42甲基化重組體;7:cdc42非甲基化重組體;8:甲基化pCAT3-Enhancer載體;9:非甲基化pCAT3-Enhancer載體;與空白對照組比較:**P<0.01;與cdc42非甲基化重組體比較:##P<0.01
3 討論
人類基因組DNA甲基化狀態會受到體內外環境因素的影響而變化,其中包括內外環境因素,例如理化因素、生物因素等。當甲基化時,染色體變得穩定,活性降低。基因表達受到兩種不同機制的甲基化抑制[10]。第一種方法是直接抑制,甲基化的染色體阻止轉錄酶的進入而阻止轉錄。第二種方法是間接抑制,兩種類型的蛋白質甲基化結合蛋白——CpG島甲基化結合結構域和組蛋白去乙酰化酶被募集到染色體中,從而引起DNA甲基化和基因沉默[11]。
當前甲基化調控研究集中在甲基化抑制劑5-氮雜-2′-脫氧胞苷(5-aza-2′-deoxy-citydine,5-aza-dC)引起的甲基化水平降低,導致腫瘤抑制基因表達重新激活,進一步對細胞增殖產生抑制。甲基化抑制劑可以使甲基化的腫瘤抑制基因CpG島去甲基化,從而治療或減緩腫瘤的復發,5-aza-dC可用作潛在的治療指導[10]。關于DNA甲基化和DNA甲基化調控基因表達復雜性的研究仍很少。Chou et al[12]研究表明肺腺癌轉錄轉移相關因子通過競爭性結合微小RNA-1(microRNA-1,miR-1)從而影響cdc42的表達來調節乳腺癌細胞的遷移和侵襲。Shi et al[13]研究顯示miR-29a、b、c過度表達通過靶向作用于cdc42并隨后降低磷酸化的P21激活激酶1、2、3,LIM激酶1 和2, 絲切蛋白來抑制神經膠質瘤細胞遷移和侵襲,此外,cdc42表達與膠質瘤等級呈正相關,但與miR-29a/b/c表達和患者生存率呈負相關。目前暫無報道顯示基因啟動子區中CpG島DNA序列的甲基化程度的改變直接參與基因表達的調節。課題組之前的研究結果表明,癌組織中cdc42的水平顯著高于遠端正常組織,且35%的標本與腫瘤轉移相關。這些結果表明,cdc42參與腫瘤細胞侵襲和轉移調控與先前的研究結果一致,但cdc42基因的表達改變是否與啟動子CpG島甲基化的改變有關并不明確[14]。
真核生物的基因調控機制很復雜,直接測定某基因上游調控元件的活性較難實現。若將該基因與一個易檢測到活性的基因連接在一起構建成重組體,通過檢測上游基因活性可間接監測下游基因的調控機制。當前應用最多的實驗,是將目的基因的調控元件和報告基因構建在一起。本實驗應用cdc42CpG島pCAT3-Enhancer重組體(經甲基化修飾及未甲基化修飾的)轉染至食管癌細胞株中,甲基化修飾的重組體與未甲基化修飾相比,CAT酶的活性顯著降低,說明在Eca109中,cdc42啟動子區CpG島的甲基化降低了下游報告基因CAT酶的活性。cdc42基因啟動子區低甲基化或未甲基化,可能參與了其在腫瘤組織中的高表達。
綜上所述,在食管癌細胞株中,cdc42基因啟動子區甲基化狀態的改變,參與調控了該基因表達的高低。

