利拉魯肽對肥胖小鼠腎小球足細胞的保護及其機制研究
葉勇健,李 娜,潘天榮,鐘 興
當下,隨著肥胖人群的急劇增多,與之相關的肥胖相關性腎病(obesity-related glomerulopathy,ORG)的患病率顯著增加。ORG的形態學改變主要為腎小球硬化和肥大,合并有足細胞形態和結構的損傷[1]。足細胞損傷在ORG的起病和進展中發揮著重要作用[2]。新型的胰高血糖素樣肽1(glucagon-like peptide 1,GLP-1)受體激動劑利拉魯肽(liraglutide,Lira)不僅可以有效降糖,在人體的各組織中也發揮著一定的保護作用。近年來一些研究[3-5]顯示GLP-1受體激動劑對腎臟病變有一定的治療效果,Fujita et al[6]研究表明GLP-1受體激動劑不僅能夠明顯改善患者的腎功能指標,同時也明顯改善腎臟病理學病變,從而對糖尿病腎病的發展起到有效的減緩作用。在ORG中,GLP-1受體激動劑對腎小球足細胞的作用尚不十分明確,該研究旨在探討GLP-1受體激動劑Lira對高脂飲食(high-fat diet,HFD)誘導的肥胖小鼠腎小球中足細胞的作用及其可能存在的作用機制。
1 材料與方法
1.1 材料
1.1.1實驗動物與飼養環境 SPF級C57BL/6J雄性小鼠34只,體質量(19.04±0.37)g;整個實驗中,各組小鼠標準鼠籠飼養,每籠4~5只,自由進食水,鼠籠溫度控制在20~25 ℃,給予12/12 h光照黑暗循環(光照時間07:00~19:00)。
1.1.2主要藥物、器材與試劑 Lira購自丹麥諾和諾德公司;ELISA測定試劑盒購自上海源葉生物科技有限公司;Western blot試劑盒購自上海碧云天生物技術有限公司;ADVIA 2400全自動生化分析儀購自德國西門子公司。
1.2 實驗方法
1.2.1實驗模型的建立 對34只小鼠進行適應性喂養,持續10 d后,在其中隨機選取12只小鼠作為正常對照(control,CON)組,使用普通飼料喂養;剩余22只小鼠作為HFD組,使用高脂飼料(配方:膽固醇2%,豬油6%,蛋黃粉10%,膽鹽0.2%,基礎飼料81.1%)喂養。高脂喂養12周后,在高脂組及正常對照組隨機各選取2只小鼠處死,腎臟病理提示高脂組造模成功。將高脂組小鼠隨機分為Lira組10只及HFD對照組10只,并繼續予以高脂飲食,其中Lira組予腹部皮下注射Lira 0.6 mg/(kg·d),高脂對照組予腹部皮下注射生理鹽水0.6 mg/(kg·d)。固定每周對小鼠進行體質量測量,根據小鼠前后的體質量數值變化相應的調整藥物的使用劑量,共干預12周。
1.2.2樣本收集 通過代謝籠收集小鼠24 h尿液,統計各小鼠尿液總量,并對其離心后取上清液測得小鼠24 h尿白蛋白總量。干預至12周末,稱取小鼠體質量,內眥取血,離心后取上清液,采用斷頭法將小鼠處死,取出雙側腎臟,對右腎濕重進行稱量,同時取部分腎臟組織進行病理切片,其余腎臟組織放置﹣80 ℃冰箱。
1.2.3指標測定 取部分1 mm3邊緣腎皮質,室溫下予2.5%戊二醛固定30 min,制作成超薄切片,利用電子顯微鏡觀看所取腎組織的足細胞的結構及形態。采用全自動生化分析儀測定小鼠血脂,包括三酰甘油(triglyceride,TG)、膽固醇(cholesterol,CHO);采用ELISA法測定血清腫瘤壞死因子α(tumor necrosis factorα,TNF-α)和尿白蛋白指標;采用Western blot法檢測腎臟組織TNF-α蛋白、氨基末端激酶(c-Jun N-terminal kinase,JNK)及細胞外調節蛋白激酶(extracellular signal regulating kinase,ERK)蛋白表達量。
2 結果
2.1 小鼠體質量、右腎濕重、血脂以及尿白蛋白變化HFD對照組小鼠體質量、右腎濕重及較CON組顯著增加(P<0.05),而在Lira干預后,上述指標較HFD對照組明顯下降(P<0.05)。與CON組比較,ELISA檢測HFD對照組尿白蛋白排泄明顯升高(P<0.05);而Lira干預后,小鼠尿白蛋白排泄較HFD對照組明顯降低(P<0.05)。與CON組比較,ELISA檢測HFD對照組血清TNF-α水平顯著升高,Lira組血清TNF-α水平較HFD對照組明顯降低,差異有統計學意義(P<0.05)。見表1。
2.2 各組小鼠腎臟組織病理變化電子顯微鏡下可見:CON組腎小球足細胞的結構清晰,足突無融合;HFD對照組出現足細胞細胞核邊集、核膜間隙增寬、線粒體空泡變性、足突融合以及基底膜增厚等;Lira組較HFD對照組,足細胞核染色質邊集情況好轉、核膜間隙寬度縮小、線粒體空泡變性減少、足突融合情況改善、基底膜厚度減小。見圖1。
2.3 各組小鼠腎組織TNF-α、JNK以及ERK蛋白表達量HFD對照組腎組織中TNF-α、JNK和ERK蛋白的表達較CON組明顯升高,差異有統計學意義(P<0.05);Lira組腎組織中TNF-α、JNK和ERK蛋白的表達較HFD對照組明顯下降,差異有統計學意義(P<0.05)。見圖2。
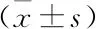
表1 各組小鼠24 h尿白蛋白、體質量、右腎濕重及血清TNF-α的變化
與CON組比較:*P<0.05;與HFD對照組比較:#P<0.05

圖1 各組小鼠腎組織足細胞的病理學變化 鈾鉛染色×2 000

圖2 各組小鼠腎臟組織TNF-α、JNK及ERK蛋白變化
3 討論
ORG主要的病理改變表現為單純性腎小球肥大及腎小球肥大合并有局灶節段性腎小球硬化,其中前者又被稱之為肥胖相關性腎小球肥大(obesity-associated glomendomegaly,OB-GM),后者又被稱之為肥胖相關性局灶節段性腎小球硬化癥(obesity-associated focal segmental glomerulosclerosis with glomemlomegaly,OB-FSGS)[7]。OB-FSGS病變較OB-GM更為嚴重,其不僅僅表現為腎小球肥大,還伴有腎臟血管節段性硬化及玻璃樣變,最重要的是伴有足細胞的損傷:OB-FSGS電鏡下可見足突融合、足細胞的腫脹以及足細胞與周圍基質的分離等。本研究及前期研究[8]結果顯示,HFD誘導的肥胖小鼠體質量、右腎濕重及尿白蛋白排泄較對照組均明顯升高,足細胞核出現邊集、核膜出現分離、足突出現腫脹融合現象;Lira干預12周后,小鼠體質量、右腎濕重及尿白蛋白較HFD對照組均顯著下降,足細胞的病理損害得到顯著改善,提示Lira可改善肥胖小鼠尿白蛋白排泄和減輕足細胞損傷。
炎癥因子在ORG足細胞的損傷中發揮著重要作用。在肥胖患者體中,TNF-α、白細胞介素-6(interleukin-6,IL-6)、單核細胞趨化蛋白-1、瘦素等炎癥因子的分泌明顯增多,從而使得炎癥反應水平顯著上升。此外,IL-10和脂聯素等抗炎因子的分泌減少,體內炎癥的動態平衡被打破,導致形成持續的微炎癥狀態,參與腎臟等多臟器的損傷[9],其中TNF-α已被證實可以參與足細胞損傷及凋亡的過程[10]。同時有研究[11]顯示,TNF-α能抑制活性氧(reactive oxygen species ,ROS)-p38絲裂原活化蛋白激酶(mitogenactivated protein kinases,MAPK)通路,導致足細胞損傷。Ikezumi et al[12]研究表明巨噬細胞分泌的TNF-α可通過激活p38 MAPK和JNK信號通路抑制足細胞特有蛋白nephrin和podocin的活性,誘導足細胞損傷,增加尿蛋白的排泄,加重腎臟損害。MAPK是由ERK、JNK及P38蛋白組成的絲氨酸蛋白激酶家族,介導細胞外信號向細胞內的傳導,再通過磷酸化活化細胞內的各種轉錄因子,發揮各自的生理學效應。其中ERK、JNK 蛋白在炎癥反應、先天缺陷、腫瘤等多種疾病的發生發展中起著重要作用。
GLP-1受體激動劑對ORG保護作用是多方面的,其可能通過改善腎小球血流動力、抗炎、抗氧化應激及改善胰島素抵抗等途徑產生作用從而對腎臟進行保護。文獻[13]報道肥胖的2型糖尿病患者在使用GLP-1受體激動劑Lira干預治療后,其體內炎癥因子水平顯著降低,如TNF-α、IL-6等,提示利Lira可以有效改善體內微炎癥狀態。Dai et al[14]研究顯示Lira顯著抑制高糖誘導下腎小球系膜細胞中TNF-α的表達,從而減輕炎癥反應,對腎臟病變起到一定的改善作用。此外有研究[15]顯示,Lira可以顯著改善糖尿病大鼠的腎臟病變,其可能的機制為作用于ERK、JNK/核轉錄因子通路,抑制其介導的炎癥反應。本研究選取高脂誘導的肥胖小鼠作為研究對象,結果顯示與對照組相比,高脂誘導的肥胖小鼠血清TNF-α含量、腎組織TNF-α蛋白以及MAPK通路中JNK蛋白、ERK蛋白表達均明顯升高,Lira干預12周后,血清TNF-α排泄、腎組織TNF-α蛋白含量以及MAPK通路中JNK蛋白、ERK蛋白明顯下降,提示Lira可能通過抑制TNF-α介導的JNK及ERK通路發揮其對足細胞的保護作用。
綜上所述,Lira可以顯著改善高脂誘導的肥胖小鼠的腎臟病變,尤其是足細胞病變,其機制可能與Lira抑制炎癥因子TNF-α介導的MAPK通路有關,但確切的機制有待進一步研究深入探討。

