同型半胱氨酸對核因子-κB活性及白三烯E4和前列腺素E2合成水平的影響
王 晶,梅詠玉,丁少楨,袁靜靜,梅 俏,許建明
炎癥性腸病(inflammatory bowel disease, IBD)是一種病因未明的腸道炎癥性疾病。核轉錄因子-κB(nuclear factor kappa B, NF-κB)是一類與炎癥相關的轉錄調節因子,參與炎癥進程的發生[1]。NF-κB是調節腸道炎癥應答的關鍵靶點,維持腸上皮細胞功能和黏膜完整性[2]。研究[3]表明IBD患者腸黏膜上皮細胞內存在大量激活的NF-κB。IBD患者腸黏膜中白三烯E4(leukotriene E4, LTE4)和前列腺素E2(prostaglandin E2, PGE2)水平明顯升高[4-5]。LTE4和PGE2是經典的炎癥介質,參與炎癥的發生發展。同型半胱氨酸(homocysteine, Hcy)是一種含巰基氨基酸,可促進炎癥介質釋放,引起細胞的氧化損傷。Hcy可引起NF-κB發生活化[6-7]。既往研究[8]表明,Hcy可損傷腸上皮細胞功能,引起腸黏膜通透性增加,加重腸道炎癥損傷,但Hcy引起腸上皮細胞損傷具體作用機制尚不明確。因此,該研究采用Hcy處理人結腸腺癌(human colon adenocarcinoma,Caco-2)細胞,觀察細胞內NF-κB活性及LTE4和PGE2水平變化,探討Hcy是否通過活化NF-κB信號通路,促進LTE4和PGE2的合成,導致腸黏膜炎癥損傷。
1 材料與方法
1.1 主要試劑和器材Caco-2細胞購自中科院上海細胞所,胎牛血清購自杭州四季青公司,TEMED(四甲基乙二胺)、Hcy和MTT均購自美國Sigma公司,乙二胺四乙酸(EDTA)、蛋白酶抑制劑購自美國Gibco公司,DMEM高糖培養基購自美國Hyclone公司,胞質-核蛋白抽提試劑盒、BCA蛋白濃度測定試劑盒及非放射性試劑盒均購自美國Pierce公司,乳酸脫氫酶(lactate dehydrogenase,LDH)試劑盒購自南京建成生物工程研究所,LTE4及PGE2ELISA試劑盒購自武漢新啟迪生物科技公司,Transwell小室購自美國Corning公司,細胞電阻儀購自美國Millipore公司。
1.2 實驗方法
1.2.1細胞培養 待Caco-2貼壁細胞生長至覆蓋培養皿底面積80%~90%時,棄上清液,加入1 ml 0.25%胰蛋白酶消化;收集細胞混懸液,1 000 r/min離心5 min,棄上清液;在Transwell小室或培養板中重懸細胞,置于37 ℃、5% CO2的培養箱中培養。每隔2 d更換培養基,待4~5 d后觀察Caco-2細胞生長情況。
1.2.2給藥方法 Hcy臨用前以生理鹽水溶解,調定pH至7.4,用DMEM完全培養基配制Hcy濃度。

表1 不同濃度Hcy作用不同時間對Caco-2細胞活性的影響
與對照組比較:*P<0.05

表2 不同濃度Hcy作用不同時間對Caco-2細胞LDH水平的影響
與對照組比較:*P<0.05
實驗分為對照組,不同濃度Hcy(10、20、50 μmol/L)處理組,藥物作用時間分別為1、3、6 h。
1.2.3Caco-2細胞生長檢測 將用不同濃度(10、20、50 μmol/L)Hcy處理的Caco-2細胞分別作用1、3、6 h后加入20 μl MTT,4 h后棄上清液,加入150 μl DMSO振蕩,根據MTT試劑盒說明方法,檢測490 nm處吸光度;將用不同濃度(10、20、50 μmol/L)Hcy處理的Caco-2細胞分別作用1、3、6 h后收集培養液,根據LDH試劑盒說明書方法,檢測450 nm處吸光度。
1.2.4Caco-2細胞通透性檢測 采用跨膜電阻(transepithelial electrical resistance, TEER)和熒光素-5-異硫氰酸酯(fluorescein-5-isothiocyanate, FITC)跨膜轉運量來檢測;按實驗分組將用Hcy處理的Caco-2細胞分別作用1、3、6 h后,TEER按照細胞電阻儀說明書進行操作;實驗開始后,每隔30 min記錄一次TEER,并取樣于8 ℃冰箱保存,直至6 h結束,采用熒光分光光度計檢測425 nm處樣品中FITC的熒光值,計算FITC跨膜轉運量。
1.2.5Caco-2細胞NF-κB活性檢測 細胞生長融合度達到80%時,使用1 ml胰酶消化,以每孔5×105個細胞密度接種,加入1 ml細胞懸液于培養箱(37 ℃、5% CO2),倒置顯微鏡觀察細胞貼壁后進入實驗分組。設對照組,實驗組分別為10、20、50 μmol/L Hcy處理組,Hcy處理1、3、6 h后提取細胞核蛋白;根據BCA試劑盒說明方法檢測核蛋白濃度;非放射性試劑盒進行電泳遷移率改變實驗(electrophoretic mobility shift assay,EMSA)。
1.2.6Caco-2細胞上清液LTE4和PGE2的測定 實驗設對照組,實驗組分別為10、20、50 μmol/L Hcy處理組,Hcy處理1、3、6 h后收集細胞上清液,按照LTE4和PGE2試劑盒操作說明測定兩者濃度。

2 結果
2.1 Hcy對Caco-2細胞生長的影響與對照組比較,Hcy處理組Caco-2細胞MTT吸光度明顯下降(P<0.05),見表1,LDH吸光度明顯增加(P<0.05),見表2,均具有濃度依賴性。不同濃度(10、20、50 μmol/L)Hcy對Caco-2生長均具有一定程度的抑制作用,且抑制程度與濃度和作用時間呈正相關性。
2.2 不同濃度Hcy對Caco-2細胞通透性的影響與對照組比較,隨著Hcy濃度的增加,FITC的滲透量明顯增加(P<0.05),見圖1;TEER的值明顯降低(P<0.05),見圖2。不同濃度(10、20、50 μmol/L)Hcy均能影響Caco-2細胞通透性。

圖1 不同濃度Hcy作用Caco-2細胞FITC滲透量的變化

圖2 不同濃度Hcy作用Caco-2細胞TEER的變化
2.3 50 μmol/L Hcy對Caco-2細胞NF-κB活性的影響與對照組比較,Hcy組細胞NF-κB的DNA結合活性升高(P<0.05);隨作用時間的延長,細胞NF-κB的DNA結合活性升高(P<0.05),見圖3。

圖3 Hcy處理Caco-2細胞不同時間NF-κB活性改變
2.4 不同濃度Hcy對Caco-2細胞產生LTE4及PGE2水平的影響與對照組比較,Hcy處理組LTE4和PGE2水平升高,不同濃度組間比較顯示,隨著Hcy濃度的升高,LTE4和PGE2水平隨之升高,見表3。
2.5 Hcy作用不同時間對Caco-2細胞合成LTE4及PGE2水平的影響50 μmol/L Hcy促進Caco-2細胞合成LTE4和PGE2,且在0~6 h內呈一定的時間依賴性(P<0.05),見表4。
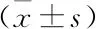
表3 不同濃度Hcy對Caco-2細胞合成LTE4及PGE2水平的影響
與對照組比較:*P<0.05;與10 μmol/L Hcy比較:#P<0.05;與20 μmol/L Hcy比較:△P<0.05
3 討論
IBD存在腸上皮損傷伴上皮屏障功能失調[9]。NF-κB是真核細胞的一種核轉錄因子。正常情況下,NF-κB二聚體因與其抑制性亞單位(IκB)結合,以無活性形式存在于細胞質。當被炎癥介質及內毒素等刺激后,IκB經過化學修飾作用被蛋白酶水解,NF-κB與IκB解離移至細胞核,與炎癥相關物質DNA特定的κB序列結合,啟動靶基因轉錄。NF-κB信號通路是腸道炎癥的重要調節機制,參與維持腸上皮屏障功能的完整性[2]。5-脂氧合酶(5-lipoxygenase, 5-LOX)和環氧合酶-2(cyclooxygenase-2, COX-2)是NF-κB重要的作用靶點。當NF-κB受刺激被激活后,促進5-LOX和COX-2過表達,使LTE4和PGE2生成增加,引起炎性活動持續發生[10]。IBD是腸道的一種慢性炎癥病變。既往研究[4-5]表明,IBD患者尿液中LTE4和PGE2水平較正常對照組明顯升高,一定程度上LTE4可反映腸道炎癥程度,PGE2升高程度反映疾病活動度。LTE4和PGE2與炎癥關系密切,促進炎癥進程的發展。LTE4能引起腸黏膜血管通透性和腸黏液分泌增加,促進腸道炎癥的級聯放大[11]。PGE2在腸道炎癥時,影響腸黏膜血液循環,增加腸黏膜通透性,降低腸黏膜吸收,導致血便和腹瀉的發生[5]。

表4 Hcy作用不同時間對Caco-2細胞合成LTE4和PGE2水平的影響
與對照組比較:*P<0.05
Hcy參與蛋氨酸代謝過程,可引起NF-κB活性增強,促進氧化損傷,影響血管內皮細胞屏障,引起炎癥介質釋放增加,加速動脈粥樣硬化的發展[7,12]。此外,Hcy可誘導機體產生白介素-6(interleukin-6, IL-6)[13]和 IL-8等[14]炎性因子對宿主起免疫監視作用。Lazzerini et al[15]發現在類風濕性關節炎(rheumatoid arthritis, RA)中,Hcy通過激活NF-κB,刺激IL-6和IL-8合成,參與RA免疫炎癥損傷。朱建華等[6]發現在動脈粥樣硬化中,Hcy激活NF-κB促進血管平滑肌細胞IL-6合成增加。本研究表明Hcy作用于Caco-2細胞,激活NF-κB,Caco-2細胞中FITC增加和細胞的TEER降低,且呈一定的濃度依賴性,提示Hcy可通過活化NF-κB信號通路,引起Caco-2細胞黏膜屏障功能受損,導致腸黏膜通透性增加。同時,本研究結果顯示Hcy作用于Caco-2細胞激活NF-κB,引起LTE4和PGE2合成增加,與課題組前期動物實驗結果一致,提示Hcy通過促進炎癥介質釋放調節腸道炎癥過程。
綜上所述,Hcy可通過活化NF-κB信號通路,引起Caco-2細胞黏膜通透性增加,促進炎癥介質LTE4和PGE2的合成,加重腸黏膜功能損傷,為Hcy在IBD病理生理機制中的作用提供實驗依據。同時也為尋找Hcy拮抗劑為臨床IBD的診療提供新思路。但NF-κB轉錄因子是否受其上游其他信號通路調控,有待進一步深入研究。

