基于EPID的鼻咽癌容積旋轉調強放療計劃的三維劑量驗證的研究
張 朋,閆 冰,薛旭東,劉 磊,吳愛林,吳愛東,
國際輻射單位和計量委員會24號報告指出,腫瘤原發灶根治劑量的準確性應好于±5%,如果根治劑量偏離最佳劑量,就有可能出現腫瘤原發灶局部復發或放射并發癥增加,從而導致腫瘤治療失敗,因此放療的療效主要取決于照射劑量的準確性[1]。與常規調強放射治療相比,容積旋轉調強放療(volumetric modulated arc therapy,VMAT)在機架旋轉出束的同時,多葉準直器位置、射束劑量率和機架旋轉速度都在發生動態變化,對放療實施精度要求更高, 因此在VMAT計劃實施前,必須在加速器上對治療計劃進行實際的三維劑量驗證,以保證治療計劃的準確實施[2]。Delta4、Compass和ArcCHECK是當前最常用的VMAT計劃三維劑量驗證系統,這些三維驗證設備不但價格昂貴,而且使用也相對不便,而作為加速器自帶的電子射野影像裝置(electronic portal imaging device,EPID),由于具有良好的劑量學特性、分辨率高、使用方便等優點,目前在臨床劑量驗證中的應用也越來越廣泛[3]。該研究主要運用Delta4、ArcCHECK和基于電子射野影像裝置的EDose三維劑量驗證系統分別對鼻咽癌(nasopharyngeal carcinoma,NPC)VMAT計劃進行驗證測量,研究基于EPID的EDose 5.0系統用于鼻咽癌VMAT計劃驗證的可行性。
1 材料與方法
1.1 病例資料與計劃設計隨機選擇安徽醫科大學附屬省立醫院放療科2018年3~10月已行VMAT的14例NPC患者,所有VMAT計劃在Pinnacle 9.10放療計劃系統(treatment planning system,TPS)設計完成,計劃采用同步加量雙弧照射技術,治療床角度為0°,機架先逆時針從179°旋轉至181°,再由181°至179°順時針方向旋轉照射,準直器角度為±10°,治療控制點間隔是4°,為保證治療計劃驗證精度,劑量計算網格設置為2 mm,所有計劃均滿足臨床靶區處方劑量和危及器官劑量限量的需求[4]。
1.2 實驗設備
1.2.1基于EPID的EDose 5.0系統 研究選用Synergy直線加速器(購自瑞典 ELEKTA公司)自帶的非晶硅電子射野影像系統(a-Si EPID),該EPID有效探測面積為41 cm×41 cm,測量矩陣1 024×1 024,最小分辨率為0.04 cm×0.04 cm[5]。EDose 5.0系統是廣州瑞多思醫療公司開發的一款基于EPID的劑量驗證與在體劑量監測軟件,在放射治療計劃照射(有患者或無患者)時,利用EPID測得的實時透射圖像或照射劑量圖像與患者電子計算機斷層掃描圖像(computed tomography,CT)相結合重建出患者體內的三維劑量分布,再與治療計劃系統計算結果進行比較,檢測患者實際治療中的三維劑量偏差。
1.2.2Delta4瑞典ScandiDos公司生產的p型半導體三維劑量驗證系統,該設備由兩個正交的半導體陣列嵌在一個22 cm×40 cm圓柱型聚甲基丙烯酸甲酯模體中,共有1 069個尺寸為0.78 mm2半導體探頭構成,中心6 cm×6 cm的區域半導體探頭間距為0.5 cm,超過中心區域半導體探頭之間距離為1 cm,有效探測范圍為20 cm×20 cm[6]。
1.2.3ArcCHECK 美國Sun Nuclear公司生產的N型半導體三維劑量驗證系統,半導體探頭以螺旋狀分布在長和直徑均為21 cm圓柱型PMMA模體中,探頭之間距離為1 cm,尺寸是0.64 mm2,共有1 386個半導體探頭組成,可測量射線的入射和出射劑量[7]。
1.3 實驗方法
1.3.1基于EPID的EDose 5.0系統三維劑量驗證測量 測量時EPID平板源皮距為160 cm,為確保劑量圖像的采集質量,測量前需先對EPID平板進行本底和增益校準,以消除探測器內部的暗電流,保證所有測量點響應性一致。在無模體條件下采集患者VMAT放療計劃實施中的射野劑量圖像,根據測得的劑量圖像在EDose軟件系統中利用反卷積和卷積算法在患者的CT定位圖像中重建患者體內的三維劑量分布,并與TPS計算的三維劑量分布進行比較,得到不同γ分析標準下的驗證通過率。
1.3.2Delta4和ArcCHECK三維劑量驗證測量 在計劃系統中將14例患者的鼻咽癌VMAT計劃分別移植到Delta4和ArcCHECK的CT掃描模體中,選擇2 mm的網格分辨率計算相應模體的三維劑量分布;驗證測量時將兩種探測器分別擺放在加速器治療床上,激光燈擺位,然后在相應的測量軟件中進行患者計劃驗證數據的采集,并與TPS計算的三維模體劑量分布進行比較,得到不同γ分析標準下的驗證通過率。
2 結果
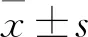
2.1 不同三維驗證系統的通過率EDose 5.0、Delta4和ArcCHECK在3%/3 mm、最小閾值10%的標準下,14例鼻咽癌VMAT計劃的平均通過率均大于95%,分別是(97.09±1.40)%、(96.24±1.52)%、(97.40±1.68)%,所有計劃驗證通過且滿足臨床治療需求。而在其他更為嚴格的評價標準下,三種三維劑量驗證系統的γ通過率都有所下降,標準越嚴格,通過率變化就越明顯,見表1。
2.2 三種三維驗證系統在不同γ通過率下的比較結果14例患者三種三維驗證系統在不同γ通過率標準下兩兩配對t檢驗結果見表2。由表2可知,EDose 5.0與Delta4系統在3%/3 mm、3%/2 mm、2%/2 mm、2%/1 mm的γ分析標準下,兩種驗證系統的結果差異無統計學意義(P>0.05);EDose 5.0與ArcCHECK的配對t檢驗結果表明,僅在3%/1 mm分析標準下驗證結果差異有統計學意義(P<0.05),Delta4與ArcCHECK的配對t檢驗結果見表2。
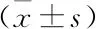
表1 三種三維劑量驗證系統在不同γ分析標準下的通過率
表2 EDose 5.0、Delta4和ArcCHECK相互行兩兩配對t檢驗結果

分析標準EDose 5.0 vs Delta4t值P值EDose 5.0 vs ArcCHECKt值P值Delta4 vs ArcCHECKt值P值3%/3 mm2.080.060.720.48-2.100.063%/2 mm0.150.88-1.320.21-1.270.233%/1 mm-2.250.04-2.650.02-0.900.392%/3 mm3.000.01-0.090.93-2.670.022%/2 mm2.030.06-0.710.49-2.630.022%/1 mm0.450.66-2.050.06-2.510.031%/3 mm2.490.030.680.51-2.090.061%/2 mm2.340.040.870.40-1.360.201%/1 mm2.360.03-0.520.61-2.550.02
3 討論
EPID最初的設計目的是驗證患者擺位的準確性,但由于EPID具有較好的劑量學響應、測量重復性、長期穩定性及使用方便等優點,很多研究[8-9]將它用于二維和三維劑量驗證并取得良好效果。而且與Delta4和ArcCHECK等三維驗證系統相比,EPID除上述優點外,還具有自動化程度高、不需要擺放驗證模體、分辨率高且沒有探頭角度依賴性、溫度和氣壓的影響等優點,可有效提高驗證工作效率和驗證精度,使得EPID在臨床劑量驗證中的應用越來越廣泛[3]。朱金漢 等[10]在基于EPID的VMAT二維劑量驗證中,在3%/3 mm和2%/2 mm的分析標準下,EPID與德國PTW 公司Seven29、Matrixx二維驗證系統的驗證結果相比較,表明EPID可以很好地用于調強放療二維劑量驗證。黎旦 等[11]在直腸癌VMAT計劃劑量驗證中,顯示在3%/3mm的γ分析標準下,ArcCHECK和基于EPID的Portal Dosimetry軟件的驗證結果沒有明顯差異。Warkentin et al[12]通過采用反卷積算法,基于EPID獲取的射野圖像在均勻固體水模擬中重建出劑量分布,與TPS計算的劑量相比表現出良好的一致性。
選擇不同的調強計劃驗證γ通過率標準可以檢測治療計劃的偏差來源及其影響,美國醫學物理師協會TG-119[13]建議:使用3%/3 mm和10%最小閾值的評價標準,γ通過率為 95%是理想的通過狀態,通過率88%為最低標準, 此標準也被其他很多報告和文獻所采用, 但最新出版的AAPM TG-218號報告[14]將 3%/3 mm的推薦標準提高為3%/2 mm,認為這樣更適合臨床需求。本研究的EDose 5.0系統是基于EPID獲取的射野劑量圖像反投影得到入射通量并結合患者定位CT解剖圖像重建患者體內劑量分布三維驗證系統,在不同的γ分析標準下,基于EPID的EDose 5.0與其他兩種三維驗證系統的驗證結果相比,在3%/3 mm、3%/2 mm和2%/2 mm的γ標準下,EDose 5.0系統與其他兩種三維驗證系統的驗證結果兩兩比較差異無統計學意義,在臨床使用上效果相當,這與黎旦 等[11]和劉書朋 等[15]研究結果一致。由于ArcCHECK與Delta4兩種探測器設計原理、探頭分辨率和結構不盡相同,兩者在不同的γ分析標準下,兩者的驗證結果對比的差異也不盡相同。
綜上所述,基于EPID的EDose 5.0系統與其他兩種常用三維劑量驗證系統一樣,均能滿足臨床對計劃驗證的要求,可很好地用于鼻咽癌VMAT計劃的三維劑量驗證。

