環狀RNA與頭頸部腫瘤
姜 濤,雷芳紅,黃 蘊,黃衛國
(南華大學衡陽醫學院腫瘤研究所,腫瘤細胞與分子病理學湖南省重點實驗室,湖南 衡陽 421001)
頭頸部腫瘤(head and neck cancer,HNC)是世界上第六大常見癌癥,具有高發病率和死亡率,其最常見的誘發因素包括吸煙和酗酒。除手術切除,放射和標準細胞毒性化療干預之外的治療選擇很少。盡管治療方法在不斷改進,但HNC的存活率并未顯著提高,仍只有50%左右。由于頭頸部的精細和復雜的解剖結構,使根治性切除手術難以實現,迫使人們不斷找尋新的治療方法。與傳統的線性RNA相比,環狀RNA(Circular RNA,circRNA)不具有5′和3′末端,而是形成共價閉合的連續環。不易被核酸外切酶降解,半衰期長達48h,比線性RNA更加穩定,具有高度的保守性,組織特異性,在腫瘤診斷和治療靶點上存在潛在的價值[1]。
1 環狀RNA的形成
1971年,研究者首次在植物中發現環形植物類病毒,其基因組由閉合的單鏈RNA分子組成[2]。先前的觀點認為,環狀RNA是錯誤拼接的產物,并不具有生理功能。隨著高通量技術的發展,越來越多的環狀RNA分子被發現。目前發現的環狀RNA主要來源于基因外顯子,內含子也很大程度參與了其形成。目前對環狀RNA的產生機制尚不明確,研究表明環狀RNA通過特殊的可變剪切產生,可變形式也多種多樣。外顯子環化形成的環狀RNA有兩種模型,一種是由基因外顯子共價結合構成環化的“套索驅動環化”;另一種是由雙內含子互補配對形成環狀結構的 “內含子配對驅動環化”,再通過剪接體剪切剩余內含子形成不同的環狀RNA分子[3]。另外,由RNA結合蛋白(RNA Binding Protein,RBP)和反式作用因子也可以促進環狀RNA的形成。根據環狀RNA成環方式不同,環狀RNA可分為僅具內含子的ciRNA;外顯子來源的circRNA;由外顯子和內含子共同組成的ElciRNA。此外,前體tRNA可以被切割成環以形成tricRNA。另外發現在白血病早幼粒白血病/維甲酸受體(PML/RARα)基因的染色體易位中發現了兩個融合環狀RNA,體內試驗發現其能促進細胞轉化和腫瘤生長[4]。
2 環狀RNA的生物學功能
近年,隨著研究的不斷增多,環狀RNA的各種生物學功能不斷被發現,內源性環狀RNA通過不同的機制參與基因表達調控,發揮不同的功能。見圖1。
2.1 調控線性RNA的表達
環狀RNA的形成方式多種多樣,基因組同一位置可轉錄出mRNA和環狀RNA分子,同一基因位點又可以轉錄出不同的環狀RNA分子。環狀RNA可以通過非經典剪切方式,與前體mRNA形成的經典剪切方式相互競爭,影響mRNA的表達。此外,通過內含子序列間競爭互補配對可以形成不同的環狀RNA分子,這些環狀RNA分子間存在競爭性平衡關系可影響到mRNA的表達。
2.2 調控親本基因的轉錄
不同的環狀RNA分子通過不同的途徑調控其親本基因的轉錄。分布在細胞核中且僅具有內含子的ciRNA可直接與DNA聚合酶II (pol II)結合促進其親本基因的轉錄;保留內含子和外顯子的ElciRNA首先與核糖體U1小核RNA(SnRNPs)結合形成復合物,進一步與Pol II結合促進親本基因的轉錄。在細胞質中富集且僅具外顯子的circRNA,可以吸附miRNA間接來調控其親本基因的表達。
2.3 發揮內源性競爭RNA(ceRNA)的作用
研究發現,一些高度富集的環狀RNA能起到ceRNA的作用。CDR1基因來源的環狀RNA CiRs-7具有70個miR-7結合位點,能夠大量吸附miR-7來影響哺乳動物興奮性突觸傳遞功能[6]。此外,circRNA_036186 通過circRNA_036186/miR-193b-3p/14-3-3ζ信號軸發揮ceRNA作用來影響頭頸部腫瘤的發生發展。但是,大多數環狀RNA的表達水平很低,而且只有少數環狀RNA具有多個結合位點來結合一個特定的miRNA。并且環狀RNA的大部分功能還未知,作為miRNA海綿可能并不是環狀RNA的主要作用。
2.4 通過相關蛋白起作用
環狀RNA 可以與不同的RBP結合后可影響相關蛋白的功能。多功能蛋白甘露糖結合凝集素(mannose binding lectin,MBL)可以調控circMBL及其線性mRNA的產生,讓其達到一種平衡。此外,circFoxo3與ID-1,E2F1,FAK和HIFα多種蛋白結合共同作用影響其抗衰老作用。
2.5 翻譯蛋白質
環狀RNA結構的特殊性使其翻譯蛋白的方式不同于線性RNA分子。環狀RNA分子通過翻譯啟動元件(Internal Ribosome Entry Site,IRES)和開放閱讀框(Open Reading Frame,ORF)翻譯蛋白質。初步研究顯示,circ-ZNF609通過IRES可直接翻譯蛋白并參與肌肉的發生過程[7]。此外,基于核糖體印跡分析發現果蠅大腦中也存在大量可翻譯蛋白的環狀RNA。
2.6 通過融合環狀RNA發揮作用
基因的突變過程可以產生大量的融合基因,并普遍存在于癌癥基因組中。研究發現,環狀RNA也參與了這一過程,協同其他致癌因素如融合蛋白發生異常融合,促進腫瘤的發生發展[4]。
2.7 作為疾病診斷標志物
環狀RNA的生物學特性,使得環狀RNA在外泌體、血漿、尿液、唾液中比mRNA、miRNA,長鏈非編碼RNA(long non-coding RNA,LncRNA)更穩定。環狀RNA有望成為疾病診斷的生物標志物(表1)。
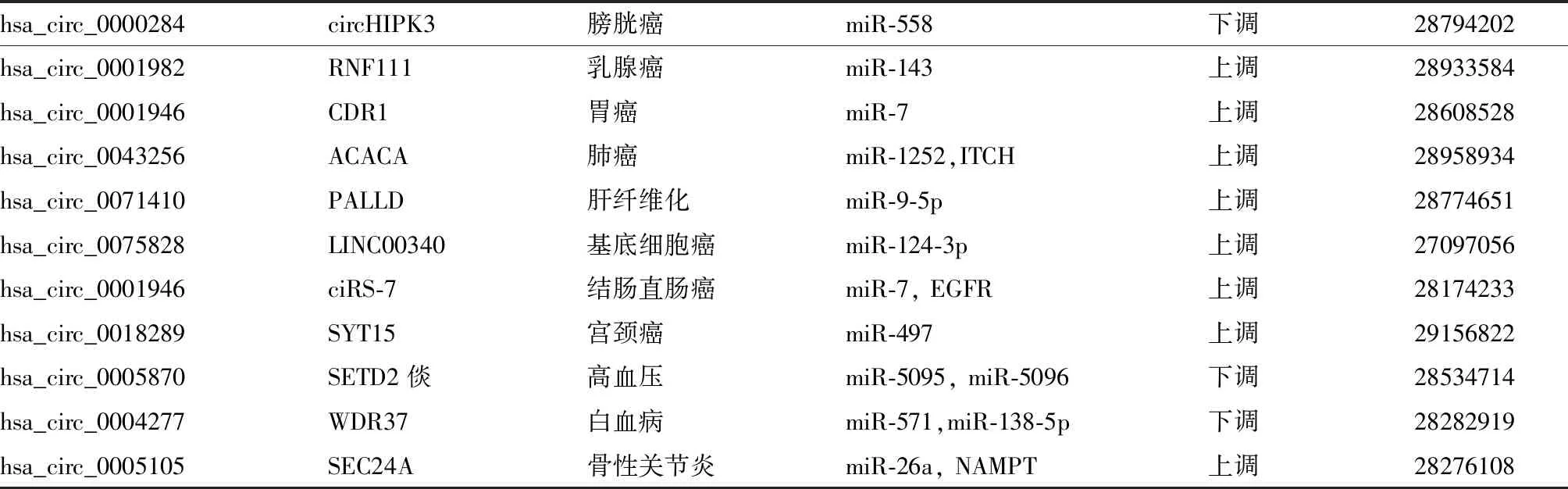
表1 環狀RNA作為診斷標志物
3 環狀RNA與頭頸部腫瘤
環狀RNA在消化,神經和免疫系統疾病中起重要作用,并且在胚胎和外泌體以及腫瘤中高度富集。與正常細胞相比,環狀RNA在腫瘤細胞外泌體中大量富集,并且腫瘤患者血清外泌體環狀RNA的富集程度與腫瘤的大小有關[8]。表明環狀RNA在腫瘤診斷和治療中具有潛在作用(圖2)。
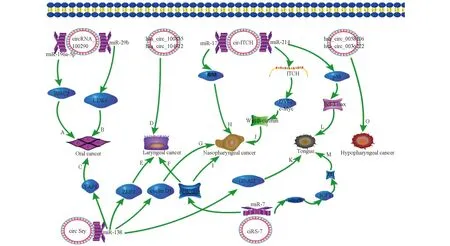
圖2 環狀RNA與頭頸部腫瘤
3.1 環狀RNA與口腔癌
在人口腔鱗狀細胞癌(Oral squamous cell carcinoma,OSCC)中,hsa_circ_0109291表達顯著增加,低表達可抑制OSCC細胞系的增殖和遷移。并且,環狀RNA可通過hsa_circ_0008309-miR-136-5P/hsa-miR-382-5P-ATXN1信號軸調節口腔癌的進程[9]。此外,circRNA_100290在OSCC組織中上調,并與細胞周期依賴性蛋白激酶6(cyclin dependent kinase 6,CDK6)共表達,通過海綿吸附miR-29b家族成員調節CDK6表達,體內外實驗發現敲除circRNA_100290能降低CDK6的表達并抑制OSCC細胞的增殖。此外,研究發現circSry擁有16個miR-138結合位點而發揮ceRNA的作用[10],并且在口腔鱗狀細胞癌中,miR-138顯著下調,而miR-138能結合Yes相關蛋白1的mRNA的3′-非翻譯區(untranslated region,UTR)來抑制細胞增殖,從而調控口腔癌的發生發展。近期研究發現,circDOCK1通過調控miR-196a-5p的表達靶向調節BIRC3,從而抑制OSCC凋亡[11]。不僅如此,OSCC患者術后唾液中hsa_circ_0001874和hsa_circ_0001971的表達水平明顯降低。此外,hsa_circ_001242的表達水平與腫瘤大小和T分期呈負相關。因此,環狀RNA在口腔鱗癌中起著重要的作用。
3.2 環狀RNA與下咽癌
通過circRNA微陣列分析下咽鱗狀細胞癌(hypopharyngeal squamous cell carcinoma,HSCC)獲得2392個差異環狀RNA分子。其中,1303個circRNA在HSCC組織中上調,1088個circRNA下調。在HSCC組織中,hsa_circ_0058106,hsa_circ_0058107和hsa_circ_0024108的表達顯著增高。hsa_circ_0036722,hsa_circ_0002260和hsa_circ_0001189的表達顯著降低[12]。但針對這些circRNA在HSCC中的作用尚未進行證實,仍需進一步實驗。此外,也有研究通過分析HSCC中失調環狀RNA差異譜,發現hsa_circ_0008287和hsa_circ_0005027兩個環狀RNA,可通過circRNA-miRNA調控網絡調控miR-548C-3p的表達,通過調控miR-548C-3p的表達間接調控ErbB,Hippo信號傳導途徑進而影響HSCC的預后[13]。
3.3 環狀RNA與喉頭癌
通過高通量測序篩選喉鱗狀細胞癌(Laryngeal squamous cell carcinoma,LSCC)組織,獲得698個差異環狀RNA,其中302個表達上調和396個表達下調。其中,hsa_circRNA_100855在LSCC組織中顯著上調,并且hsa_circRNA_100855的高表達與淋巴結轉移和晚期臨床分期有關。相反,hsa_circRNA_104912在LSCC組織中顯著下調,且與TMN分期、淋巴結轉移相關。最新研究發現通過檢測環狀RNA分子可以區分LSCC標本和正常標本[14]。綜上所述,環狀RNA可能在LSCC的發生發展中起重要作用,并可能有助于該疾病的診斷和預后。
3.4 環狀RNA與鼻咽癌
研究發現,在鼻咽癌中[15],miR-7可影響鼻咽癌細胞系CNE-1和CNE-2的放射敏感性,其表達水平越高,細胞對輻射的敏感性越強。ciRS-7發揮ceRNA作用,海綿吸附miR-7影響鼻咽癌的放療敏感性[10]。并且miR-7還通過抑制EGFR/PI3K/Akt信號傳導途徑抑制鼻咽癌細胞增殖和集落形成。最新研究發現,在鼻咽癌患者血清和組織中,circRNA_0000285顯著增加,并影響鼻咽癌患者的放療敏感性[16]。另外,circSry通過海綿吸附miR-138影響細胞周期蛋白D1的表達,從而影響鼻咽癌的發生發展。研究報道,cir-ITCH是一種腫瘤抑制基因,在食管鱗狀細胞癌中顯著下調,充當miR-17和miR-214海綿,提高ITCH水平;而ITCH的過表達可促進泛素介導的蓬亂蛋白2(DVL2)降解并抑制癌基因c-Myc的表達,從而抑制Wnt /β-catenin信號轉導途徑來影響鼻咽癌的進程[17]。
3.5 環狀RNA與舌癌
在舌鱗癌細胞中(Tongue squamous cell,TSCC)[18],ciRS-7可海綿吸附miR-7,促進胰島素樣生長因子1受體(insulin-like growth factor 1,IGF1R)的表達,誘導由胰島素樣生長因子1(IGF1)誘導的Akt信號通路激活,促進細胞增殖和細胞周期,抑制細胞凋亡的作用。circ-ITCH海綿吸附miR-214,促進p53蛋白質的表達,抑制Bcl-2/Bax相關蛋白質的作用,達到抑癌的效果。此外,circSry通過吸附miR-138促進GNAI2的表達,影響舌鱗狀細胞癌的轉移。通過高通量測序分析TSCC組織和鄰近組織發現,環狀RNA在一定程度上參與腫瘤的發生發展,并且與腫瘤相關的miRNA具有復雜的相關性。
4 環狀RNA研究策略
環狀RNA在疾病中作用機制的研究是時下的熱點。用于檢測環狀RNA表達及其功能研究的方法有很多。可以通過RNA測序和微陣列篩選目標環狀RNA,然后利用逆轉錄-聚合酶鏈反應,液滴數字PCR,RNA印跡和熒光原位雜交進行驗證。通過過表達或敲除實驗進行環狀RNA功能研究。結合生物信息學,RNA免疫共沉淀和RNA質譜進行機制研究。目前,已經開發了很多的數據庫和分析工具供研究者使用(表2)。CircInteractome具有環狀RNA引物和干擾RNA設計功能。ExoRBase用于分析血液外泌體中特異性環狀RNA分子。通過這些免費工具,我們可以分析組織、血液、外泌體中環狀RNA的差異表達,預測與之結合的miRNA,研究環狀RNA分子具有的功能。
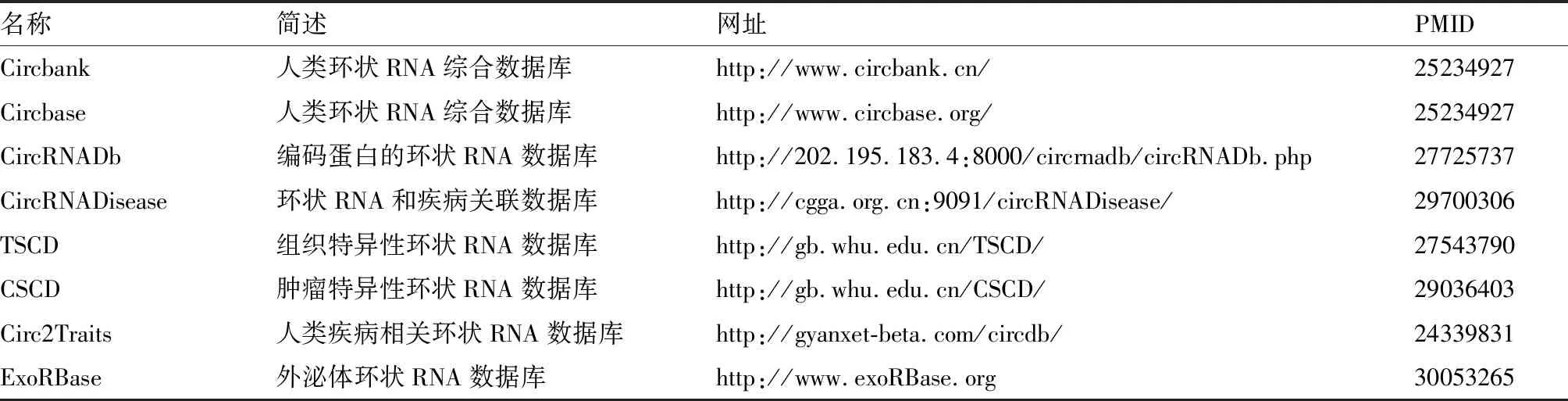
表2 環狀RNA數據庫
5 結 論
綜上所述,環狀RNA的穩定性和特異性,在靶點的準確性上優于miRNA和lncRNA,在腫瘤診斷和治療中存在潛在的價值。如果能實現體內控制內源環狀RNA在特定組織和細胞中的表達,可能增加治療的療效,極大降低外源物質所帶來的副作用,這將增加環狀RNA的價值,也將是未來基因治療的重大突破。盡管已經初步提出了環狀RNA的形成模型,但是仍需要大量的實驗來探索其生成機制,包括環狀RNA的產生、二級結構,以及不同RNA之間的的相互關系。目前,腫瘤中環狀RNA的檢測主要依賴于組織樣本,而頭頸部腫瘤位置的特殊性以及復雜性使組織樣品獲得困難,增加了臨床研究難度。與組織相比,血液中的環狀RNA表達通常很高,細胞可以通過外泌體將環狀RNA分泌到血液中。因此,血液,尿液,唾液等更容易獲得的非侵入性臨床樣本將在未來頭頸部腫瘤環狀RNA研究中廣泛應用。

