安妥沙星體外誘導大腸埃希菌耐藥研究
朱安祥 ,朱瑞奇 ,吳 韓 ,曾楊梅 ,吳俊偉,
(1.西南大學動物科學學院,重慶榮昌402460 ;2.重慶布爾動物藥業有限公司,重慶榮昌 402460)
近年來,由于抗微生物藥物的濫用,抗生素耐藥性已成為本世紀公共衛生的主要威脅,獸醫臨床上的細菌耐藥性問題也遍布全球[1]。交叉耐藥、多重耐藥等問題的出現為臨床各類疾病的預防和治療帶來愈加嚴峻的挑戰。安妥沙星是我國首個自主研發的喹諾酮類新藥,2009 年批準上市,具有良好的體內外抗菌能力和安全性,目前主要用于人醫臨床上大腸埃希菌引起的急性腎盂腎炎和膀胱炎,隨著寵物在家庭中地位的提高,該藥今后有望開發為寵物藥品。大腸埃希菌多重耐藥的產生主要與其外排泵系統有關,已有的試驗數據、研究結果提示,外排泵AcrAB-TolC 是導致其產生耐藥最主要的藥物外排泵[2]。
本試驗用安妥沙星誘導大腸埃希菌標準菌株ATCC25922,對誘導前后菌株進行最小抑菌濃度(MIC)測定,并通過對誘導前后菌株的外排泵AcrAB-TolC 調控基因acrA、acrB、tolC、acrZ的序列及mRNA 表達量進行分析,以期為該細菌在以AcrAB-TolC 為中心的外排系統介導的大腸埃希菌多重耐藥、分子生物學等方面的研究提供參考。
1 材料與方法
1.1 菌種 大腸埃希菌ATCC25922,購自中國獸醫藥品監察所。
1.2 主要試劑 安妥沙星,購自中國食品藥品檢定研究院;乳酸環丙沙星、恩諾沙星,購自上虞京新藥業有限公司;鹽酸土霉素,購自河北建民淀粉糖業有限公司;硫酸黏菌素,購自河北圣雪大成唐山制藥有限責任公司;硫酸慶大霉素,購自煙臺只楚藥業有限公司;磺胺嘧啶,購自西南合成制藥股份有限公司;LB 肉湯培養基、LB 瓊脂培養基、MH 肉湯培養基、MH 瓊脂等培養基,均購自青島高科園海博生物技術有限公司;Pfu PCR Master Mix(KP201),購自天根生化科技(北京)有限公司;瓊脂糖、UNIQ-10柱式總RNA 抽提試劑盒,購自生工生物工程(上海)股份有限公司;GoScriptTMReverse Transcription System 反轉錄試劑盒、TaKaRa SYBR’ 100179;Premix ExTaqTMII(Tli RNase H Plus)定量試劑盒,購自普洛麥格生物技術有限公司。
1.3 測定最小抑菌濃度(MIC)
1.3.1 復蘇標準菌株ATCC25922 將標準菌株ATCC25922 從-80 ℃冰箱取出,37 ℃水浴3 -4 min,待菌株融化后,用微量移液器吸取5 μL 于LB 肉湯中,置于37 ℃培養18 -24 h,次日接種到LB 瓊脂平板上,置于37 ℃培養18 -24 h,備用。
1.3.2 微量肉湯稀釋法測定MIC 按照美國臨床實驗室標準化委員會(CLSI)提供的獸醫版藥敏試驗標準(VET01-A4)[3],采用微量肉湯稀釋法測定所有抗菌藥對ATCC25922 的最小抑菌濃度(MIC)。
1.3.3 體外誘導大腸埃希菌 根據1.3.2 測定的安妥沙星的MIC,參照張靜等[4]的方法以1/2 ×MIC濃度的安妥沙星為起點體外誘導標準菌株,獲得耐藥性穩定的菌株A。測定安妥沙星和其他藥物對誘導前后細菌的MIC,方法同1.3.2。
1.4 誘導前后菌株外排泵AcrAB-TolC 基因突變情況
1.4.1 引物設計 根據GenBank 中大腸埃希菌相應基因序列設計PCR 擴增引物,acrB由于序列較長,將其分為2 段設計2 對引物分別擴增,見表1,由生工生物工程(上海)股份有限公司合成。以大腸埃希菌DNA 為模板,進行PCR 擴增,電泳檢測后將產物送生工生物工程(上海)股份有限公司測序。
1.4.2 誘導前后細菌acrA、acrB、tolC和acrZ序列的變異情況 將細菌培養至生長對數期,以濃度約為3.0 ×108CFU/mL 的新鮮菌液為模板,用合成的引物利用PCR 技術擴增相應基因,反應體系如表2所示。各基因的PCR 反應程序:94 ℃預變性3 min,94 ℃變性30 s,退火溫度見表1,時間30 s,72 ℃延伸2 min,共30 個循環,最后72 ℃溫育5 min。PCR反應結束后,用1.5%的瓊脂糖凝膠檢測擴增產物,將符合要求的PCR 產物送生工生物工程(上海)股份有限公司測序。
1.5 誘導前后細菌外排泵AcrAB-TolC 基因的mRNA表達量的變化 根據GenBank 中大腸埃希菌相應基因序列設計外排泵基因acrA、acrB、tolC、acrZ熒光定量PCR 擴增引物,以大腸埃希菌的看家基因gapA為內參,見表2,由生工生物工程(上海)股份有限公司合成。提取細菌總RNA,并反轉錄成cDNA。以cDNA 為模板上機檢測。反應條件:95 ℃30 s,95 ℃5 s,61 ℃35 s,共40 個循環,每次循環讀板1 次;熔解曲線測定:65~95 ℃,每0.5 ℃讀板1 次,持續5 s。
1.5.1 細菌處理 將細菌培養8 -12 h 后,接種于LB 肉湯中,培養至生長對數期(OD600=0.7~0.8)。以標準菌株為對照組,安妥沙星誘導后的耐藥菌株為試驗組。
1.5.2 總RNA 的抽提 按試劑盒說明書操作步驟抽提總RNA。
1.5.3 反轉錄 按GoScriptTMReverse Transcription System 反轉錄試劑盒說明書操作步驟合成cDNA。

表2 目的基因用于熒光定量PCR 擴增引物
1.5.4 熒光定量PCR 檢測 (1)熒光定量PCR反應:將cDNA 樣品作為模板上機檢測。反應條件:95 ℃30 s,95 ℃5 s,61 ℃35 s,共40 個循環,每次循環讀板1 次;熔解曲線測定:65~95 ℃,每0.5 ℃讀板1 次,持續5 s;(2)熔解曲線:每個樣品做3 次平行重復;(3)樣品擴增曲線:試驗設計為組內3 次試驗,觀察試驗重復性是否良好。
2 結果
2.1 安妥沙星及其他藥物對誘導前后大腸埃希菌MIC 的測定 經安妥沙星誘導后的細菌對乳酸環丙沙星、恩諾沙星、鹽酸土霉素和磺胺嘧啶均呈現出高度耐藥,對安妥沙星耐藥的大腸埃希菌極易對其他氟喹諾酮類藥物產生交叉耐藥,同時對其他類的抗菌藥物也產生了多重耐藥(表3)。

表3 安妥沙星及其他藥物對誘導前后菌株的MIC(μg/mL)
2.2 安妥沙星誘導前后acrA、acrB、tolC、acrZ突變情況
2.2.1 PCR 擴增結果 各基因電泳條帶均在相應范圍內,且條帶單一,說明目的基因被有效擴增且無非特異性條帶,可用于后續試驗(圖1)。
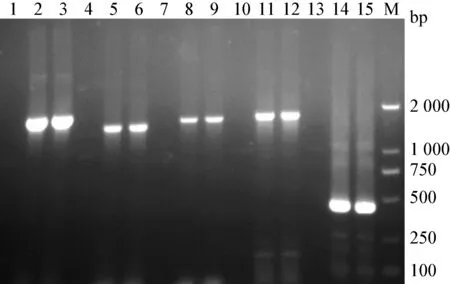
圖1 tolc、acrA、acrB2、acrB1和acrZ 基因電泳圖
2.2.2 目的基因測序結果 由表4 可見,與誘導前菌株相應基因序列對比,誘導后的耐藥菌株除acrZ未發生堿基突變外,其余基因均發生堿基突變,其中:acrA8 處、acrB40 處、tolC27 處。但本試驗中acrA堿基位突變,因密碼子具有兼并性并沒有使氨基酸發生突變;acrB編碼的氨基酸序列只出現了1 個位點突變596Asn→His;tolC編碼的氨基酸序列出現了3 個位點突變,分別是:13Leu→Phe、160Tyr→Asp、482Thr→Ser。
2.3 安妥沙星處理前后acrA、acrB、tolC、acrZmRNA 表達量的變化
2.3.1 擴增和熔解曲線的建立 實時定量PCR 擴增的基因,系統自動生成擴增曲線和熔解曲線,acrA、acrB、tolC、acrZ和gapA的擴增曲線和熔解曲線如圖2 和圖3 所示。熔解曲線峰單一無雜峰,表明PCR 擴增產物解鏈溫度穩定,PCR 擴增產物單一,引物設計合理,且無非特異性產物,可以進行后續試驗。
2.3.2 安妥沙星誘導前后acrA、acrB、acrZ、tolCmRNA表達量的變化 使用2-△△Ct法進行數據分析(圖4),與誘導前菌株相應基因mRNA 表達量相比,誘導后菌株acrA、acrB、acrZ、tolC的mRNA 表達量均極顯著增加。mRNA 的表達量增加在一定程度上會使得細胞膜上的外排泵蛋白AcrAB-TolC 數量增加,從而更快地將菌體內抗菌藥物泵出菌體外,使得大腸埃希菌對多種藥物的耐藥性增加。

表4 試驗菌株目的基因堿基和氨基酸序列突變情況

圖2 擴增曲線

圖3 熔解曲線
3 討論

圖4 安妥沙星處理前后菌株acrA、acrB、acrZ、tolC mRNA 表達量變化
3.1 安妥沙星誘導耐藥菌株對多種抗微生物藥物耐藥 大腸埃希菌對氟喹諾酮類藥物的耐藥機制主要包括:(1) 藥物作用靶位基因突變; (2) 細菌細胞膜通透性改變; (3) 主動外排。表3 中安妥沙星及其他藥物對誘導前后大腸埃希菌MIC 結果顯示,經安妥沙星誘導的菌株可同時對乳酸環丙沙星、恩諾沙星等氟喹諾酮類藥物交叉耐藥,同時會對鹽酸土霉素、硫酸慶大霉素和磺胺嘧啶產生多重耐藥,這表明此次安妥沙星誘導所得的耐藥菌株其耐藥性不具有很強的特異性,對多種抗微生物藥物的耐藥機制有著共同之處。藥物主動外排是大腸埃希菌多重耐藥的主要機制,外排泵AcrAB-TolC是大腸埃希菌最為重要的外排泵,也是目前研究比較清楚的細菌外排泵,能夠同時外排多種抗菌藥物、有機溶劑、染料及去污劑等使細菌產生高水平多重耐藥[5]。體外誘導耐藥過程中可能也會同時引起其他抗菌藥物的耐藥基因決定簇/耐藥基因位點發生了變化,Oethinger[6]等研究表明,在敲除acrAB的情況下,僅依靠促旋酶突變不能使野生型大腸埃希菌達到臨床相關水平的氟喹諾類藥物抗性。因此外排泵AcrAB-TolC在大腸埃希菌的固有和獲得的氟喹諾類藥物抗性中起到關鍵作用。
3.2 體外誘導的耐藥菌株外排泵基因突變及表達量變化 由表4 可以看出,與原菌株相比,誘導耐藥菌株的acrA、acrB和tolC基因的堿基序列變化最多,點突變的數量分別是8、40 和27,且acrB和tolC基因中都有氨基酸突變。Chen[7]等用氟喹諾酮類藥物對大腸埃希菌進行體外誘導時,發現誘導后的耐藥菌株其acrA/B和tolC的堿基及氨基酸均發生了變化,說明細菌的耐藥性與外排泵基因的突變有一定的相關性。acrZ基因屬于高度保守的基因,此次也未發現其發生突變。
外排泵AcrAB-TolC 屬于RND 家族[8-9],由AcrA、AcrB、TolC 蛋白組成,以三聚體復合模式存在于細菌的細胞膜上,AcrB 為外排轉運蛋白,TolC 為外膜通道蛋白,AcrA 為周質連接蛋白,位于周漿間隙中,兩端連接TolC 和AcrB,形成一個貫通內外膜的孔道,是藥物外排的主要途徑。在AcrB 與底物結合的部位還有一個特殊小蛋白AcrZ[10-11],可通過對AcrB 的變構調節來影響AcrB 對底物的選擇性,從而影響細菌對藥物的敏感性。圖4 中acrA、acrB、acrZ、tolC的mRNA 表達量均極顯著增加,理論上就會產生更多相應的外排泵蛋白。Mazzariol[12]等發現10 株臨床分離的大腸埃希菌中有9 株的AcrA 過表達≥170%,具有高水平的環丙沙星耐藥性(MICs,≥32 μg/mL)。Baucheron[13]等的研究表明,AcrB 多藥轉運蛋白在鼠傷寒噬菌體DT204 型腸道沙門菌的高水平氟喹諾酮耐藥中發揮重要作用。Sulavik[14]等的研究表明,敲除acrAB或tolC基因會導致大腸埃希菌的敏感性增加,進一步證實了AcrAB-TolC 外排系統在高水平氟喹諾酮類藥物耐藥中的重要性。Hobbs[15]等研究發現,acrZ基因缺失突變體的耐藥性顯著下降,AcrZ 特異性結合AcrB 可增強細菌耐藥性。四種蛋白均過量表達,協調配合形成更多結構和功能完整的外排泵AcrAB-TolC,從而更快地將菌體內抗菌藥物泵出菌體外,使得大腸埃希菌對多種藥物的耐藥性增加,多藥耐藥程度隨表達量增加而增強。
安妥沙星體外誘導大腸埃希菌標準菌株,可產生具有多重耐藥表型的耐藥株,且耐藥株對安妥沙星和其他抗微生物藥物的多重耐藥機制有一定的共同之處,與外排泵蛋白AcrAB-TolC 的過量表達有一定的相關性。

