中國藥物警戒的發展及文獻計量分析*
祝曉雨,張偉光,孫樹森,趙志剛
(1.首都醫科大學附屬北京天壇醫院藥學部,北京 100050;2.首都醫科大學附屬北京朝陽醫院西院藥事辦,北京 100043;3.美國西新英格蘭大學藥學院,美國斯普林菲爾德 01119)
藥物警戒譯自“Pharmacovigilance”,簡稱PV 或PhV,這個詞從詞源學角度是希臘語pharmakon(“藥物”的意思)以及拉丁語vigilare(“注意”的意思)的合成詞,英譯漢翻譯為“drug safety”(藥物安全性)[1]。世界衛生組織(WHO)將PV定義為檢測、評估、理解和預防不良反應,或其他任何藥物相關問題的科學研究與活動(Pharmacovigilance is defined as the science and activities relating to the detection,assessment,understanding and prevention of adverse effects or any other drug-related problem)[2]。1961年發生“沙利度胺海豹兒事件”后,WHO啟動一項多個國家合作的國際藥物警戒監測合作計劃(即現在的WHO藥物監測中心——WHO Monitoring Center)[3],奠定國際藥品監測合作計劃的基礎,由總部位于瑞士烏普薩拉的WHO協作中心(Uppsala Monitoring Center,UMC)統一協調[4],從而開啟藥物警戒的理論與實踐。截至2016年,已經有123個國家加入WHO的藥品監測計劃,28個國家等待正式加入此中心[5]。我國于1998年加入WHO國際藥品監測合作中心[6],成為第68個成員國,以堅持提高患者的健康水平和促進用藥安全為目的,開展不良反應監測的工作。
藥物警戒于1974年在法國首先提出[7],最初的解釋著重強調藥物不良反應(adverse drug reaction,ADR)的監測。ADR指合格藥品在正常用法用量下出現的與用藥目的無關的有害反應。所以直到現在還普遍認為藥物警戒就是ADR。ADR是藥物警戒的重要內容,但是藥物警戒并非單指ADR,還包括劣藥、假藥存在的用藥風險,以及不合理用藥——藥品誤用與嚴重的藥物濫用產生的危險,藥物用法錯誤。藥物警戒貫穿于藥物研究、藥物審批、藥物上市的整個生命周期。在藥物警戒的不斷實踐中,還有可能擴展其警戒的目標[8]。而ADR是藥物警戒的重要內容,常常用來作為藥物警戒監測的重要數據。藥物警戒需要在ADR監測工作中不斷完善[9-10],我國的藥物警戒體系就是在藥物不良反應監測體系基礎上發展而來,兩者最終目的都是促進臨床合理用藥,提高用藥安全,改善公眾身體健康,提升公眾生活質量。兩者區別見表1。
文獻計量分析[11]有助于對某一研究領域的國內外文獻發表情況進行全面了解[12-13]。筆者在本研究利用文獻計量分析的方法對中國藥物警戒的文獻發表情況進行全面分析,有助于了解中國藥物警戒現狀,有助于藥物警戒的進一步發展,保障用藥安全。
1 研究方法
1.1文獻檢索與計量學分析 在中國學術期刊全文數據庫(CNKI,1979—2018)、維普網(VIP)、萬方數據庫中,以“藥物警戒”為篇名或關鍵詞檢索,檢索從建庫時期到2018年5月22日所有文獻。
制定納入和排除標準:①納入關鍵詞或者篇名中含有“藥物警戒”的文獻。②排除新聞、會議通知、文摘、書籍等類型文獻。③應用數據處理軟件Endnote X排除重復文獻。④由于《藥品不良反應信息通報》和《藥物警戒快訊》是國家藥品不良反應監測中心發布的警戒通報,故不作為計量分析的數據。
對所得結果進行計量分析,包括出版年份、關鍵詞、機構、作者和來源出版物等,并分析文獻引用情況。
1.2藥品不良反應通報與藥物警戒快訊檢索 通過原國家食品藥品監督管理局(CFDA)官方網站查詢全部《藥品不良反應通報》與《藥物警戒快訊》,用Excel表格統計分析發表時間、基本內容等信息。
2 結果
2.1文獻計量分析 在CNKI、VIP和萬方數據庫中檢索到文獻分別為1103篇、686篇和777篇,經過數據處理,最終得到文獻588篇,文獻類型包括期刊、會議論文、研究生論文等。其中期刊464篇(78.91%)、綜述28篇(4.76%)、會議論文71篇(12.07%)、研究生論文25篇(4.25%)。
2.1.1藥物警戒相關文獻年發表量 為反映研究主題在該領域的發展情況,筆者對檢索到的文獻按年度分布情況、文獻量與時間變化的關系統計分析,見表2。
1997年李家泰的論文中首次以“藥物警戒”作為關鍵詞。1998年我國加入WHO國際藥品監測合作中心,1999年論文發表達5篇。之后,國家頒布一系列法律法規和指南[14-15],見表3。大力推動我國藥物警戒的發展,在2004年,李青[16]發表的《我國藥品上市后監測工作及國家藥物政策的基礎研究》開啟了關于我國藥物警戒相關監測工作的研究。此后論文發表數明顯增多,從2006年的27篇增至2009年的83篇,這表明藥物警戒已經引起廣泛關注,2011年之后雖然文獻發表量有所下降,但仍維持在每年26~50篇,說明中國學者意識到藥物警戒直接關系到臨床用藥安全,是不可忽視的內容。
為了促進中國藥物警戒領域的學術交流,推進藥
表2 藥物警戒相關文獻年發表情況
Tab.2Annualpublicationofpharmacovigilancerelatedpapers
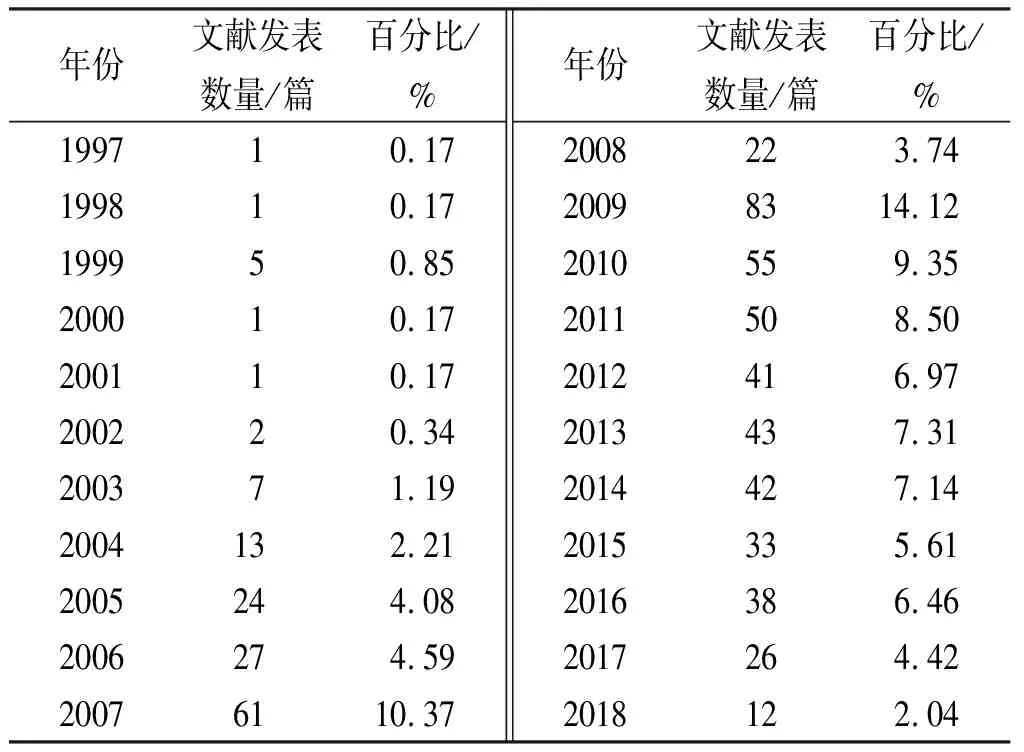
年份文獻發表數量/篇百分比/%199710.17199810.17199950.85200010.17200110.17200220.34200371.192004132.212005244.082006274.5920076110.37年份文獻發表數量/篇百分比/%2008223.7420098314.122010559.352011508.502012416.972013437.312014427.142015335.612016386.462017264.422018122.04
物警戒創新發展,自2007年至今,中國已舉辦6屆藥物警戒大會[17],見表4。
2.1.2文獻作者分布 表5為文獻發表總量前15位的作者,其中排名第一位的作者張冰教授來自北京中醫藥大學,主要研究方向為中藥防治代謝性疾病的臨床與實驗研究、中藥毒副作用及其藥源性疾病的研究和中藥藥性理論基礎與應用的研究,致力于中藥藥物警戒的理論研究與實踐探索,是《中國藥物警戒》雜志編委。排名第二位王大猷教授來自復旦大學附屬華山醫院,從事藥物警戒及藥物流行病學的研究與實踐,擔任國際藥物警戒學會會員、國家藥品監督管理局藥品評價中心專家委員會委員以及上海市臨床藥品不良反應監測中心專家咨詢委員會委員,并且擔任《藥物不良反應雜志》等刊物的編委。曾繁典教授曾擔任華中科技大學同濟醫學院臨床藥理研究室主任,原中國藥理學會副理事長、中國臨床藥理學會副主任委員、國家藥監局藥品評審專家庫專家,中國藥學會藥物流行病學專業委員會副主任委員,在藥物警戒與臨床藥學服務和藥物流行病學方面深有研究,曾擔任《醫藥導報》和《藥物流行病學雜志》主編。國家食品藥品監督管理局藥品評價中心陳易新是中藥不良反應及用藥安全性問題中國中醫藥監測和評價專家,主要參與組織、建立,并完善了中國藥品不良反應監測的基本技術工作體系,在藥品風險預警、不良反應監測中發揮至關重要的作用。這些專家及其團隊是我國藥物警戒研究的主力軍,其對藥物警戒體系的建立及發展起著至關重要的作用,其文獻也有及其重要的參考價值。
表3 相關法律法規及指南
Tab.3Relevantlaws,regulationsandguidelines

發布時間法律法規及指南1998《藥品生產質量管理規范》(局令第9號)2000《藥品經營質量管理規范》(局令第20號)2001《中華人民共和國藥品管理法》(主席令第45號)2002《中國人民共和國藥品管理法實施條例》(國務院令第360號)2002《醫療機構藥事管理暫行規定》2003《藥物臨床試驗質量管理規范》2003《藥品監督行政處罰程序規定》(局令第1號)2004《藥品不良反應報告和監測管理辦法》(局令第7號)2004《藥品生產監督管理辦法》(局令第14號)2004《互聯網藥品信息服務管理辦法》(局令第9號)2006《藥品說明書和標簽管理規定》(局令的24號)2007《藥品注冊管理辦法》(局令第28號)2007《藥品召回管理辦法》(局令第29號)2007《藥品廣告審查辦法》(局令第27號)2007《藥品廣告審查發布標準》(國家工商總局局令第27號)2007《藥品流通監督管理辦法》(局令第26號)2011《藥品不良反應報告和監測管理辦法》(衛生部令 81 號)2011《醫療機構藥事管理規定》2011《藥品生產質量管理規范》(衛生部令第79號)2013《國家基本藥物目錄》(2012年版)(衛生部令第93號)2015《藥品不良反應報告和監測檢查指南(試行)》2015《藥品經營質量管理規范》(國家食品藥品監督管理總局令第13號)2015《中華人民共和國藥品管理法》2016《藥品經營質量管理規范》2016《中華人民共和國藥品管理法實施條例》2017《藥品生產監督管理辦法》2017《藥品經營許可證管理辦法》2017《互聯網藥品信息服務管理辦法》2017《蛋白同化制劑和肽類激素進出口管理辦法》2017《生物制品批簽發管理辦法》(國家食品藥品監督管理總局令第39號)

表4 第一至第六屆藥物警戒大會
表5 文獻發表總量前15位的作者
Tab.5Thetop15authorswiththemostpublishedpapers

姓名發文量/篇百分比/%張冰244.08王大猷223.74杜文民223.74曾繁典162.72陳易新162.72賀佳152.55謝雁鳴132.21劉巍101.70姓名發文量/篇百分比/%董鐸101.70吳嘉瑞91.53林志健81.36楊悅81.36王龍興81.36范燕81.36沈璐71.19
2.1.3研究機構 機構是科學研究的重要背景因素,表6是發表藥物警戒相關文獻最多的前15個機構,其中國家藥品監督管理局藥品評價中心以47篇居于首位,第2和第3名分別是中國國家藥品不良反應監測中心和北京中醫藥大學。我國總的趨勢是非常重視藥物警戒的,尤其是對中藥藥物警戒方面的關注和研究。但各省市在此工作上仍然有很多工作需要做。
表6 文獻發表前15位的機構
Tab.6Thetop15institutionswiththemostpapers

機構名稱文獻量/篇百分比/%國家藥品監督管理局藥品評價中心477.99國家藥品不良反應監測中心355.95北京中醫藥大學284.76沈陽藥科大學264.42復旦大學附屬華山醫院244.08華中科技大學233.91上海市藥品不良反應監測中心223.74第二軍醫大學183.06輝瑞制藥(中國)有限公司142.38《中國藥物警戒》132.21中國藥科大學132.21上海市食品藥品監督管理局111.87四川大學華西醫院91.53廣東省食品藥品監督管理局81.36國家藥品監督管理局藥品審評中心81.36
2.1.4文獻來源分布 表7是按照收錄論文數量的多少對來源出版物進行的排名,從表7中可知,《中國藥物警戒》收錄的論文數最多,其次是《藥物流行病學雜志》和《中國處方藥》。
表7 收錄論文前15位的出版物
Tab.7Thetop15publicationswiththemostpapers

雜志名稱文獻量/篇百分比/%中國藥物警戒10517.86藥物流行病學雜志8414.29中國處方藥193.23中國藥房162.72藥品評價122.04健康報122.04中國執業藥師111.87中國中藥雜志101.70中國醫藥導報101.70中國藥業91.53中國食品藥品監管91.53中國藥事81.36中國醫院藥學雜志71.19中國醫院用藥評價與分析61.02
2.1.5關鍵詞分布 藥物警戒研究的前15個關鍵詞(表8),“藥物警戒”有511篇,這與本篇檢索策略相關。 “不良反應”,“監測”以及“藥品不良反應”分別居于第2,3,4位,50%論文以“不良反應”為關鍵詞,這和藥物警戒與藥品不良反應的關系相一致,藥品不良反應監測是藥物警戒的重要內容。
表8 藥物警戒研究排名前15的關鍵詞
Tab.8Thetop15keywordsasthepharmacovigilance

關鍵詞文獻數/篇百分比/%藥物警戒51186.90不良反應29450.00監測12421.09藥品不良反應11719.90風險管理6511.05中藥5910.03安全性579.69藥物不良反應528.84關鍵詞文獻數/篇百分比/% 合理用藥488.16 藥品不良反應監測386.46 藥物流行病學294.93 藥品風險管理264.42 數據挖掘213.57 警戒152.55 歐盟101.70
2.1.6基金資助機構分布 表9是基金資助機構,排名前3位的分別是國家自然科學基金、國家科技支撐計劃和中國博士后科學基金。
2.1.7被引文獻分析 表10列舉總被引次數排名前 15 位的論文,查閱論文第一作者后發現,論文被引次數最多的作者李幼平來自四川大學華西醫院,該論文為國家自然科學基金面上資助項目,針對藥品風險,介紹與藥品風險管理相關的一些基本概念等內容的判讀[18]。陳易新、楊煥和王蘭明3位作者來自國家藥品監督管理局,王明珠、葉小飛和田麗娟來自沈陽藥科大學。

表9 文獻所屬基金分布
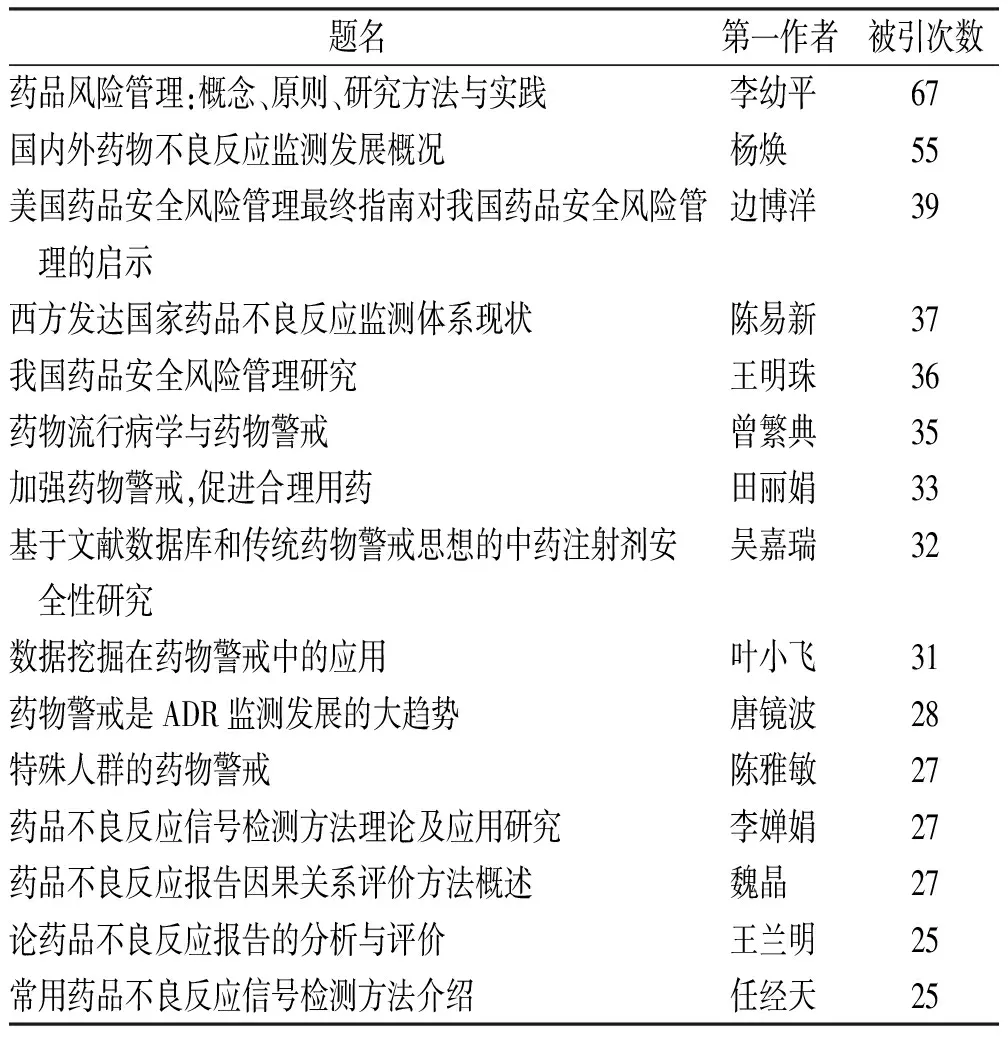
表10 藥物警戒被引次數前15位的論文
2.2藥品不良反應信息通報 原CFDA自2001年起至今發布76期《藥品不良反應信息通報》[19],年發布情況見表11,發布內容絕大部分是我國上報的新的或者嚴重的藥品不良反應信息。發布時間無規律,且自2010年后每年發布的期數明顯減少,建議我國加大對藥品不良反應信息通報力度。
2.3藥物警戒快訊 原CFDA自2005年至今發布《藥物警戒快訊》[20]共180期,年發布情況見表12,2005—2010年年發布期數在13~18期,2011年至今每月1期,其內容皆是國際上其他國家或機構發布的藥物警戒信息,以美國FDA和歐盟EMEA為代表,其建立較為完善的藥物警戒體系,尤其是歐盟實施的藥物警戒制度體系,是目前國際范圍內最完善的體系[21]。在這樣的體系下能全面及時的發現新的或嚴重的藥品不良反應信息,并及時發布。
表11 《藥品不良反應信息通報》年發布情況
Tab.11Annualreleaseofadversedrugreactioninformationbulletin

年份發布期數涉及藥品數量20011520022142003292004252005252006252007242008582009610年份發布期數涉及藥品數量20101010201199201289201378201477201545201644201733
表12 《藥物警戒快訊》年發布情況
Tab.12Annualreleaseofpharmacovigilancealerts

年份發布期數200517200614200718200813200915201015201112年份發布期數20121220131220141220151220161220171220184
3 討論
目前,我國藥物警戒的關注度持續維持在相對較高水平,ADR監測與上報作為其重要組成部分,近年來發展較快。吳世福等[22]研究提到我國2016年收集的ADR報告143.1萬份,ADR報告上報總數量較多,但是在嚴重不良反應和生產企業報告比例等方面還有待提高[23]。目前我國ADR上報主要是醫師、藥師和護士等醫療機構人員,藥品生產企業主動上報數量較少[24]。在發達國家,如加拿大,2011年81.8%報告均來自于藥品生產企業[25]。此外,我國普遍存在ADR病例漏報和延遲報告等問題[26]。
截至2011年末,我國已經建立34個省級ADR監測中心和333個地市級ADR監測中心[23]。隨著科技的發展,網絡建設的深入,我國發現和收集ADR信息的能力進一步增強。截至 2016年,全國已有約31萬個醫療機構等通過ADR監測網絡報送ADR報告[27],這為我國藥物警戒的發展奠定了很好的基礎。
中國在藥物警戒體系發展的領域尚存在一定不足與差距。許多國家的法律規定中,新藥的批準要求在藥品上市后最初幾年持續提供詳細的藥物警戒數據[28]。我國藥物警戒法規體系建設任重道遠,先進的、符合國情的法規和技術指南,將為加速藥物警戒的規范化、國際化進程提供法律支撐[29-30]。
立足國情,借鑒國際上ADR監測的經驗,加快我國ADR監測體系法律法規的制定,積極推行發布ADR上報和管理指南,才能逐步完善我國藥物警戒體系,同時,相關專家的廣泛宣傳與重視和藥師專業技能的提升,會讓我國藥物警戒工作更進一步。

