熊果酸對人非小細胞肺癌細胞系A549增殖、遷移、侵襲能力的影響及其機制探討
李姝葉,畢小菁,王文軍
(西南醫科大學附屬醫院,四川瀘州 646000)
肺癌是最常見的癌癥,也是癌癥死亡的主要原因,其中非小細胞肺癌(NSCLC)約占肺癌總數的80%[1]。熊果酸(UA)是一種五環三萜類化合物,廣泛存在于自然植物的莖皮、葉和果皮中,具有抗炎、抗氧化、抗血管生成及抗腫瘤等作用[2]。有研究[3]表明,UA可以調控腫瘤細胞的相關基因表達及調節腫瘤細胞的信號通路,從而產生抗腫瘤作用。Huang等[4]發現,UA可以明顯抑制肺癌細胞的增殖、遷移和侵襲。miRNA是一類非編碼的小分子RNA,可以在轉錄后調控基因的表達,降解靶基因或抑制其翻譯,從而影響腫瘤的發生和發展[5]。目前,有關UA抑制人肺癌細胞系A549的增殖、遷移、侵襲的作用機制尚不明確,且UA是否通過作用于miRNA從而抑制A549細胞的增殖、遷移、侵襲的相關研究甚少。2017年10月~2018年8月,我們觀察了UA對A549細胞增殖、遷移、侵襲能力的影響,并探討其可能機制。
1 材料與方法
1.1 材料 UA購自Sigma公司;A549細胞來源于西南醫科大學中心實驗室;miRNA-21 inhibitor、miRNA-21 mimic(RiboBio公司);RPMI1640培養液(Hyclone公司),新生小牛血清(四季青公司),脂質體Lipofectamine2000、TRIzol試劑(Invitrogen公司),CCK-8檢測試劑盒(碧云天公司),Transwell板、Matrigel膠(美國Corning公司),RT-PCR試劑盒(大連TaKaRa公司),PCR引物(武漢金開瑞公司),BCA蛋白濃度測定試劑盒(ASPEN公司),抗GAPDH抗體、抗PTEN抗體及抗PI3K抗體(美國Abcam公司),抗AKT抗體(美國CST公司)。
1.2 UA的IC50值計算及A549細胞中異常表達miRNA篩選 ①將A549細胞置入含10%胎牛血清的RPMI1640培養液中,置于37 ℃、5%CO2的培養箱中培養。取對數生長期細胞,用胰蛋白酶消化,配制成濃度為1×105/mL的細胞懸液接種于96孔板,每孔加100 μL,置于37 ℃、5%CO2的培養箱中培養24 h。分別加入0、5、10、20、30、40、50 μmol/L的UA,分別設置6個復孔,繼續培養細胞24 h,所有孔中加入10 μL的CCK-8,于培養箱中孵育2 h,去除培養基,加入100 μL溶液,使用酶標儀測定450 nm處的OD值,實驗重復3次。UA作用于A549細胞24 h后,UA的IC50值為42 μmol/L。②取對數生長期A549細胞5×107個,接種于培養基24 h,待細胞貼壁后加入42 μmol/L的UA繼續培養24 h,同時選擇不加UA的為對照;采用miRNeasy Mini Kit對兩組細胞進行total RNA抽提,抽提所得total RNA經Agilent Bioanalyzer 2100電泳質檢合格后備用,采用miRNA Complete Labeling and Hyb Kit對樣品中的miRNA分子進行熒光標記及芯片雜交,芯片結果采用Agilent Microarray Scanner進行掃描,用Feature Extraction software 10.7.1.1讀取數據,最后采用AgiMicroRna進行歸一化處理,miRNA 芯片檢測由上海伯豪生物技術有限公司完成。結果分析將改變大于2倍作為篩選異常表達miRNA的選擇依據。UA誘導前后A549細胞中有34條表達改變大于2倍的miRNA,其中上調的miRNA有20條,下調的miRNA有14條,結合檢出miRNA信號值及改變倍數綜合考慮篩選miRNA-21做后續實驗。
1.3 轉染后A549細胞miR-21檢測 采用PCR法。取對數生長期A549細胞并分為4組,a組轉染miR-21 inhibitor,b組轉染miR-21 mimic,c組轉染miR-NC,d組不干預。根據脂質體Lipo 2000的說明書進行細胞的轉染,分別用25 μL Opti-MEM無血清培養基將脂質體Lipo 2000、miR-21 inhibitor、miR-21 mimic及miR-NC稀釋,室溫孵育5 min后混勻,室溫放置20 min。加入基礎培養基繼續培養。轉染6 h后,細胞換完全培養基,繼續于37 ℃、5%CO2的培養箱中培養,24 h后,采用TRIzol法按照說明書提取細胞總RNA,逆轉錄合成cDNA,再按照熒光定量PCR試劑盒說明書進行擴增,按以下擴增程序反應:預變性、擴增40個循環、分析熔解曲線,每個樣品均作3個復孔。以U6為內參照,以2-ΔΔCt代表目的基因的表達量。實驗重復3次,取平均值。a、b、c、d組miR-21相對表達量分別為0.35±0.07、2.18±0.12、1.04±0.07、0.96±0.10,a、b組分別與c、d組比較,P均<0.05,證明轉染成功。
1.4 UA對A549細胞增殖、遷移、侵襲能力的影響觀察 取對數生長期的A549細胞并分為A、B、C、D組,A、B組細胞分別轉染miR-21 inhibitor及miR-21 mimic,24 h后除D組外其余各組均加入42 μmol/L UA繼續培養并進行下述實驗:①細胞增殖能力:上述4組細胞繼續培養24 h后采用CCK-8法檢測。使用酶標儀測定450 nm光吸收值,計算細胞增殖率,細胞增殖率=(實驗組OD值-空白組OD值)/(對照組OD值-空白組OD值)×100%。實驗重復3次,取平均值。②細胞遷移能力:上述4組細胞接種于6孔板中(每孔約5×105個),用無菌槍頭在孔內劃5條平行線,PBS輕輕漂洗3次后加入培養基,置于37 ℃、5% CO2條件下繼續培養,剛加入42 μmol/L UA時顯微鏡下拍照,記為0 h,繼續培養24 h,拍照記為24 h。實驗重復3次,結果取平均值。③細胞侵襲能力:采用Transwell實驗。將matrigel和培養基以1∶3的比例稀釋,取50 μL加入Transwell小室中干燥備用。分別取200 μL(105個/mL)上述4組細胞懸液放入Transwell小室中。將小室放入含培養基的24孔板中置于37 ℃、5%CO2條件下培養48 h,將小室取出,用棉簽將上室中的膠和細胞擦除干凈,結晶紫染色10 min,洗去表面的結晶紫,于倒置顯微鏡下計數遷移至微孔膜下層的細胞數,拍照。實驗重復3次,取平均值。
1.5 UA對A549細胞PTEN、PI3K、AKT表達的影響觀察 ①PTEN、PI3K、AKT mRNA:采用熒光定量PCR法檢測。收集“1.4”中4組細胞,采用“1.3”中熒光定量PCR法檢測各組細胞PTEN、PI3K、AKT mRNA。②PTEN、PI3K、AKT蛋白:采用Western blotting法。收集“1.4”中4組細胞,按照細胞總蛋白提取試劑盒步驟提取細胞蛋白,采用BCA蛋白質濃度測定試劑盒測定樣品蛋白濃度。根據測得濃度取相應體積樣品至每孔40 μg蛋白,100 ℃沸水浴5 min,按濃縮膠80 V、分離膠120 V進行恒壓電泳,按300 mA恒流轉膜,轉膜時間根據目的蛋白分子量大小調整。將轉好的膜加入封閉液室溫封閉1 h。加入已稀釋好的一抗4 ℃過夜,用TBST洗3次,加入稀釋好的二抗,室溫孵育30 min,ECL發光并拍照。將膠片進行掃描存檔,AlphaEaseFC軟件處理系統分析目標帶的光密度值。
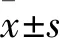
2 結果
2.1 各組細胞增殖率、24 h劃痕相對寬度、穿膜個數比較 細胞增殖率、24 h劃痕相對寬度、穿膜個數比較見表1。
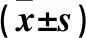
表1 各組細胞增殖率、24 h劃痕相對寬度、穿膜個數比較
注:與C組比較,*P<0.05。
2.2 各組細胞PTEN、PI3K、AKT蛋白和mRNA比較 細胞PTEN、PI3K、AKT蛋白和mRNA比較見表2。
3 討論
肺癌是當今世界最常見的惡性腫瘤之一,據美國癌癥協會統計,最常見的癌癥死亡原因是肺癌,肺癌按組織病理學可分為NSCLC和小細胞肺癌,其中NSCLC約占80%,主要包括腺癌、鱗狀上皮細胞癌、大細胞癌以及一些發病率較低的肺癌[6]。手術、化療、放療、分子靶向治療、免疫治療、中藥治療是目前臨床上治療NSCLC的主要方法,但因為大部分患者確診時已處于病程中晚期,喪失了最佳的手術時機,且化療藥不良反應大,故NSCLC患者的5年生存率也只有大約65%[7,8]。A549細胞為NSCLC的主要類型,因此尋找能夠抑制A549細胞增殖、遷移、侵襲及促進A549細胞凋亡的新方法具有重大意義。
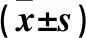
表2 各組細胞PTEN、PI3K、AKT蛋白和mRNA比較
注:與C組比較,*P<0.05。
UA是一種五環三萜類化合物,具有抗炎、抗氧化、肝保護、抗血管、抗腫瘤生成等作用[9~12]。UA有抗腫瘤作用,可用于乳腺癌、白血病、前列腺癌、黑色素瘤、子宮內膜癌、肺癌等治療中[13]。Hsu等[14]研究表明,UA可以抑制肺癌A549細胞增殖,促進其凋亡,是最有前途的抗肺癌藥物之一。本研究顯示,UA能抑制肺癌A549細胞的增殖、遷移和侵襲。
眾所周知,miRNA-21通過調控細胞增殖、轉移、血管生成、抗凋亡等多種分子機制,在腫瘤發展中發揮著關鍵作用[15]。各種研究都觀察到miRNA-21在肺癌患者中的表達異常[16]。PI3K/AKT信號通路在控制細胞存活、促進細胞增殖、抑制細胞凋亡等方面具有重要作用[17]。PTEN是目前已知的第一種抑制腫瘤活性的磷酸酶[18]。PTEN/PI3K/AKT信號通路是包括骨肉瘤在內的許多實體癌發生過程中的主要調控因子,PTEN/PI3K/AKT蛋白已被發現在多種癌癥中異常表達[19,20]。Li等[21]發現,miR-21通過下調PTEN以及激活PI3K/AKT通路參與EGFR-TKI在NSCLC中的獲得性耐藥。Zhang等[22]認為,下調miR-21的表達后,腫瘤抑制因子PTEN表達增加,抑制了NSCLC的增殖和侵襲。故可以猜想miRNA-21調控細胞的作用可能與PTEN/PI3K/AKT信號通路有關。
UA可以通過上調或者下調miRNA的表達從而調控細胞功能,Lu等[23]發現UA通過抑制miRNA-21/PTEN/Akt/mTOR途徑上調自噬,減輕糖尿病系膜細胞損傷。Jiang等[24]報道UA誘導大鼠原發性血管平滑肌細胞的抗增殖作用與抑制miRNA-21后引發PTEN/PI3K的變化有關。Wu等[25]研究表明,UA通過上調PTEN基因表達和PI3K/Akt通路失活從而誘導K562細胞凋亡。本研究顯示,UA作用下肺癌A549細胞miR-21相對表達量下降,PTEN表達升高,PI3K、AKT表達降低,由此我們可以猜測,UA能抑制肺癌A549細胞增殖、遷移、侵襲的作用機制可能是通過下調miRNA-21作用于PTEN/PI3K/AKT通路來實現的。為了驗證我們的猜測,我們在肺癌A549細胞中轉染了miRNA-21 inhibitor,轉染成功后肺癌A549細胞的miRNA-21 表達明顯下降,在下調miRNA-21表達后,UA抑制A549細胞的增殖、遷移和侵襲作用增強,PTEN的表達增加,并且抑制了PI3K/AKT的表達,而轉染miRNA-21 mimic后的肺癌A549細胞的miRNA-21 表達明顯增多,在上調miRNA-21表達后,UA抑制A549細胞的增殖、遷移和侵襲作用減弱,PTEN的表達減少,PI3K/AKT表達增加。
總之,UA能抑制肺癌A549細胞的增殖、遷移和侵襲,其作用機制可能是通過下調miRNA-21作用于PTEN/PI3K/AKT通路來實現的,這為以后UA的基礎研究、臨床研究及應用提供了理論基礎。

