膝骨關節炎患者血清GPI、抗MCV抗體水平變化及其意義
劉軒,徐翔,王靜,趙靜,李鴻斌
(1內蒙古醫科大學附屬醫院,呼和浩特 010050;2內蒙古醫科大學第二附屬醫院)
骨性關節炎(OA)是一種常見的退行性疾病,常伴隨明顯的疼痛和功能障礙[1]。OA的發病率和致殘率日益升高,目前60歲以上人群發病率達50%,75歲以上人群達80%[2]。因此,早期診斷和治療OA,可以避免關節的完全損害,對預防或減緩疾病的進展具有重要作用。膝骨性關節炎(KOA)的臨床特征為關節軟骨損傷、骨質增生形成肥厚性骨變、軟骨下骨重塑和滑膜炎癥,炎癥在其發生發展過程中起重要作用,OA雖然不是一種炎癥性疾病,但是KOA發病過程中卻有炎癥發生,促進滑膜炎癥和關節疼痛[3]。目前,KOA的診斷主要依靠X線、關節超聲等,但均不能作為早期診斷的有效手段。C反應蛋白(CRP)水平的輕度升高是慢性KOA X線進展的預測因素,CRP水平與KOA發生率之間存在顯著相關性[4]。血沉(ESR)的低度升高也被納入KOA患者的預測因素之一,來預測疾病的發展[5]。葡萄糖-6-磷酸異構酶(GPI)由T細胞分泌,除具有酶活性外,還具有細胞因子及生長因子樣活性,存在于各種細胞的細胞外液及細胞質,尤其是關節腔內,特別是軟骨表面[6]。GPI和抗GPI抗體可能激活補體通路,誘發關節炎[7]。抗突變型瓜氨酸波形蛋白(MCV)抗體為瓜氨酸相關自身抗體,存在于RA患者的滑液、滑膜細胞和血清中[8]。GPI和抗MCV抗體現已成為類風濕關節炎(RA)的診斷指標,但在抗環狀瓜氨酸肽抗體(診斷RA的關鍵指標)陰性的情況下,二者仍有低水平的升高,考慮可能與OA有關。本研究觀察了KOA患者血清GPI、抗MCV抗體水平變化,并探討其意義。
1 資料與方法
1.1 臨床資料 收集內蒙古醫科大學第一附屬醫院收治的KOA患者100例。納入標準:①符合2010年歐洲抗風濕病聯盟(EULAR)與1995年美國風濕病協會(ACR)制訂的KOA分類診斷標準,KOA患者早期和中晚期的分級標準根據MRI Recht分級標準[9]和關節鏡下Outerbridge分級標準[10],其中Ⅰ~Ⅱ級為早期組,Ⅲ~Ⅳ級為中晚期組;②年齡≥50歲;③患者知情同意,并經醫學倫理委員會的批準。排除標準:①伴有類風濕關節炎或其他自身免疫性疾病;②有膝關節外傷史或手術史;③膝關節腫瘤、結核;④嚴重的肝腎功能不全;⑤甲狀腺功能疾病;⑥近期接受過藥物治療者。所有患者按照病情進展分為兩組,早期組50例,男12例、女38例,年齡49~80(60.35±8.36)歲;中晚期組50例,男18例、女32例,年齡50~84(66.89±7.73)歲。另選取50例健康體檢者作為對照組,男13例、女37例,年齡50~79(57±8)歲。各組一般資料無統計學差異,具有可比性。
1.2 血清GPI、抗MCV抗體、ESR、CRP檢測 就診次日早晨采集入選對象空腹靜脈血各3~5 mL,以3 000 r/min速度離心10 min,分離血清,將離心后的血清標本儲存于-80 ℃冰箱待測。①GPI:采用ELISA法檢測,操作嚴格按說明書進行。a.將標準品和血清標本各100 μL加到相應微孔中置37 ℃孵育1 h,洗板5次后拍干;b.加酶100 μL置37 ℃孵育1 h,洗板5次后拍干;c.加入底物顯色液100 μL置室溫(15~30 ℃)避光孵育15 min;d.最后加終止液50 μL終止反應;e.用芬蘭Thermo全自動酶標儀,在主波長490 nm、副波長630 nm,以空白孔校零,測定各孔吸光度值,求出待測樣品GPI水平。本實驗GPI水平≥4 mg/L,按4 mg/L計算。②抗MCV抗體:采用ELISA法檢測,嚴格按說明書進行。a.將標準品、質控品和按1∶100比例稀釋后的患者血清各100 μL加入到微孔中,室溫(20~28 ℃)溫育30 min;b.吸出微孔板內組分,用300 μL洗液沖洗,沖洗3次,吸取100 μL酶結合物加到每個微孔中,在室溫下溫育15 min;c.吸出微孔板內組分,用300 μL洗液沖洗,沖洗3次,吸取100 μL底物溶液加到每個微孔中,在室溫下溫育15 min;d.在每個微孔中加入100 μL終止液,在室溫下溫育5 min;e.讀取450 nm處的光密度值并計算結果,根據繪制的標準曲線得出待測樣本水平。③ESR:用散射比濁法檢測,ESR>20 mm/h為異常。④CRP:采用散射比濁法檢測,以CRP>5 mg/L為異常,CRP<0.5 mg/L按0.5 mg/L計算。
2 結果
2.1 各組血清GPI、抗MCV抗體、ESR、CRP水平比較 結果見表1。
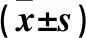
表1 各組血清GPI、抗MCV抗體、ESR、CRP水平比較
注:與對照組比較,*P<0.05;與中晚期組比較,△P<0.05。
2.2 KOA患者血清GPI、抗MCV抗體水平與ESR、CRP水平的相關性 KOA患者血清GPI水平與CRP水平呈正相關(r=0.27,P<0.05),與ESR水平無相關性(r=0.06,P>0.05);抗MCV抗體水平與CRP、ESR水平均無相關性(r分別為0.03、0.14,P均>0.05)。
3 討論
KOA病變關鍵是以軟組織退行性病變和病變關節周圍組織增生為主要病理變化的一組臨床綜合征,其實質是一種慢性的,逐漸發生的退行性病變,常常累及1個及多個關節,病變關節常常表現為局部關節軟組織發生退行性病變,以關節邊緣或關節軟骨下的骨組織發生剝脫,消失等為病理特征,因此又被稱為退行性關節炎[11,12]。OA常累及活動較多的負重關節,尤其是膝關節。KOA的臨床癥狀主要是疼痛,早期呈間歇性疼痛,活動后加重,晚期則出現持續性疼痛,關節僵硬、腫大和變形,嚴重影響日常的工作和生活,最終只能進行手術治療。KOA的確切病因及發病機制尚不明確,現階段診斷OA主要依靠臨床癥狀、X線和核磁共振檢查。KOA疾病的過程是一個連續的統一體,從軟骨細胞的早期變化到周圍基質的變化,到出現臨床癥狀和影像學檢測到的關節結構的變化,說明疾病進展是一個漫長、積累的過程,血清學標志物在疾病初期就已出現,早期發現OA的血清學標志物,對OA的早期診斷、早期治療至關重要。KOA屬于一種低度炎癥性關節病,炎癥反應及固有免疫反應等生物學因素在OA 進程中也發揮了重要作用[3]。最近的MRI和超聲成像也證實滑膜炎與KOA的癥狀和疾病進展有關,大量的試驗驗證了炎癥在OA的發病中與機械刺激等因素具有同樣的作用[13,14]。有研究[15]表明CRP、ESR與OA病情變化及預后具有一定的相關性。
CRP屬于一種急性時相反應蛋白,對于各種炎癥反應均有較高的敏感性,當CRP水平升高時往往提示慢性免疫系統被激活[16],盡管CRP不是KOA疾病的特異性標記,但它可以指示OA疾病中存在外周循環的炎癥狀態,在早期KOA會顯著增加,提示KOA病情會隨時間推移而進展,是炎癥進展的預測因素。而ESR是炎癥的一種非特異性的指標,在很多炎癥性疾病中都可以檢測到,在KOA患者中,也會有不同程度的升高。
除炎癥指標可以作為KOA的預測因素外,還有其他一些生物學標志物可以先于OA影像學出現,如血清軟骨寡聚基質蛋白、透明質酸、基質金屬蛋白酶(MMP)-3等[17]。有研究[18,19]顯示,在腫瘤細胞內發現GPI可以調節MMP-3的表達,而MMP-3在KOA患者的關節液中高表達。軟骨細胞對葡萄糖代謝途徑具有選擇性,通常情況下軟骨細胞主要通過糖酵解來滿足自身的能量需求,OA患者關節軟骨細胞糖酵解水平顯著提高[20]。GPI是糖酵解途徑的第二酶,由558個氨基酸組成,在糖酵解和糖異生過程中可以催化葡萄-6-磷酸和果糖6-磷酸的相互轉化。GPI在K/BxN關節炎小鼠中被確認為致病性自身抗原,重組人GPI免疫DBA/1小鼠可誘導關節炎[21]。GPI可被抗瓜氨酸化蛋白抗體(ACPA)識別,在RA患者的關節液和血清中ACPA呈高表達。ACPA還可識別其他多種瓜氨酸蛋白,如波形蛋白、α烯醇化酶、纖維蛋白原、纖維連接蛋白等[21]。波形蛋白是一種骨架蛋白,是抗MCV抗體的抗原,波形蛋白在凋亡細胞內分解成核周的聚集物,因得不到及時清除而導致瓜氨酸波形蛋白的持續存在,進而促進了MCV抗體的產生[22],GPI是否通過調節MMP-3而在OA中表達,波形蛋白在OA中的水平變化是否可以用來診斷KOA或者評估疾病嚴重程度,以及它們與炎癥預測因素ESR、CRP是否相關,是否通過參與炎癥反應誘導KOA的發生,可以通過本實驗的結果得到進一步闡釋。本研究顯示,與對照組比較,早期組和中晚期組血清GPI、抗MCV抗體、ESR、CRP水平升高;與早組比較,中晚期組血清CRP水平升高。KOA患者血清GPI水平與CRP水平呈正相關,與ESR水平無相關性;抗MCV抗體水平與CRP、ESR水平無相關性。
總之,KOA患者血清中GPI、抗MCV抗體水平升高,檢測兩指標有助于KOA的診斷及病情評估。

