佝僂病患兒維生素D受體基因BsmI和FokI位點多態性與骨密度相關性研究
王道靜,呂為萍,李建友,厲吉霞
維生素D缺乏性佝僂病(vitamin D deficient rickets)是由于嬰兒體內維生素D不足,造成鈣、磷代謝紊亂、骨鹽沉積量減少、骨形成障礙,形成一種以骨骼病變為特征的全身慢性營養性疾病[1],甚至造成成人后骨質疏松的發生。研究發現,即使在陽光充足的地域,佝僂病的發病率也比較高,且給予患兒補充維生素D之后的效果也不盡相同,說明佝僂病的發生不僅與環境和營養因素有關,還與基因遺傳因素有關[2]。維生素D受體(vitamin D receptor,VDR)作為核內生物大分子,在機體內發揮著極其重要的作用,尤其是維持鈣磷代謝等[3]。近年來,VDR基因被認為是遺傳調控骨和鈣代謝的候選基因[4]。研究表明,VDR等位基因通過影響信使RNA的表達,進而引起其受體蛋白在數量或功能上的差異,進一步地引起對鈣磷代謝調節出現異常,最終影響機體腸道中對鈣磷的吸收,使骨骼中的鈣磷沉積發生改變,從而影響骨密度(BMD)[5]。因此本研究采用病例對照研究方法,選取山東省煙臺地區的嬰幼兒作為研究對象,分析VDR基因 BsmI和FokI位點多態性與佝僂病、骨密度相關性,以期對本地區佝僂病患兒提供輔助性病因診斷,預測維生素D治療效果,指導臨床維生素D個體化用量。進而降低佝僂病患兒低骨密度對骨骼造成的不可逆性的改變,避免成人期骨質疏松的發生,報道如下。
1 資料和方法
1.1 臨床資料 選取2017年1—12月于煙臺市煙臺山醫院兒科就診的佝僂病患兒作為研究對象,納入標準:(1)符合中華醫學會兒科學分會兒童保健學組制定的“維生素D缺乏及維生素D缺乏性佝僂病防治建議”診斷標準[6];(2)臨床表現為枕禿、肋軟骨溝、雞胸。排除標準:(1)長期服用激素類藥物;(2)伴隨先天性疾病;(3)早產兒;(4)伴隨遺傳性疾病及肝腎功能障礙的患兒。最終納入符合要求的患兒50例作為研究組,男30例,女20例,年齡4~12(7.89±1.23)個月。另選擇同期在醫院體檢的健康嬰兒50例作為健康對照組,男29例,女21例,年齡4~12(7.92±1.21)個月。2組嬰兒均不存在影響維生素D吸收的胃腸道、內分泌、肝腎疾病等。2組嬰兒性別和年齡比較差異無統計學意義(P>0.05),具有可比性。本研究經醫院倫理委員會批準,所有入選嬰兒的監護人均知情同意并簽署知情同意書。
1.2 觀察指標與方法
1.2.1 VDR基因BsmI和FokI位點多態性分析:采用口腔拭子采集嬰兒口腔上皮細胞,然后采用DNA試劑盒進行提取,并采用紫外分光光度計測量純度和含量,PCR引物采用Primer Premier 6.23 DEMO軟件進行設計,由上海吉瑪生物有限公司代為合成。BsmI:F.3'-CCCTCACTGCCCTTAGCTC-5',R.3'-CCTCCAAAATCAATCAGGTAAAC-5';FokI:F.3'-GCTGAGCTCCCTGGTGGT-5',R.3'-AGCATTGAAGTGAAAGCCAGT-5'。反應條件:總體系為50 μl,95℃預變性3 min,之后94℃變形30 s、55℃退火35 s、72℃延伸40 s,35個循環后,再72℃延伸5 min。1%瓊脂糖電泳,嗅化乙啶染色,然后采用PCR純化試劑盒進行純化,采用3730XL基因測序儀(美國ABI公司生產)完成基因分型。
1.2.2 骨密度檢測:采用BMD-1000A超聲波骨密度儀(上海名元實業有限公司)檢測左脛骨中段骨密度,然后通過數據庫自動計算骨密度Z值,骨密度檢測由2位具有5年以上工作經驗的醫師完成。
1.2.3 生化指標檢測:常規禁食8 h,采集肘靜脈血1.5 ml,離心5 min,收集血清,一部分采用全自動生化分析儀檢測血清鈣和磷;另一部分采用酶聯免疫試劑盒(基爾頓生物科技有限公司)檢測25-(OH)D3水平,采用全血干化學法檢測骨堿性磷酸酶(bone alkaline phosphatase,B-ALP),試劑盒購自安徽高山藥業有限公司。
1.3 統計學方法 采用SPSS 16.0統計軟件對數據分析。采用卡方檢驗判斷各位點基因型頻率分布是否符合Hardy-Weinberg平衡;計數資料用頻數或率(%)表示,組間比較采用χ2檢驗;符合正態分布計量資料用均數±標準差表示,組間比較采用t檢驗;不同基因型的骨密度、血鈣、血磷以及25-(OH)D3采用單因素方差分析,兩兩比較采用LSD-t檢驗;Logistic單因素回歸分析基因位點與佝僂病發病的風險性。P<0.05為差異有統計學意義。
2 結 果
2.1 2組嬰兒血鈣、血磷、骨密度、B-ALP及25-(OH)D3水平比較 研究組患兒血鈣、骨密度以及25-(OH)D3明顯低于健康對照組,而血磷和B-ALP明顯高于健康對照組,差異具有統計學意義(P<0.01),見表1。
2.2 Hardy-Weinberg平衡檢驗 Hardy-Weinberg平衡檢驗結果顯示BsmI位點(χ2=0.714,P>0.05)和FokI位點(χ2=0.693,P>0.05),均符合Hardy-Weinberg遺傳平衡,說明選取的對象具有代表性。
2.3 2組嬰兒VDR基因BsmI和FokI位點基因多態性分布比較 研究組和健康對照組在FokI位點上的基因型ff、Ff及FF分布上差異有統計學意義(P<0.05),而在BsmI位點上基因型BB和Bb+bb分布差異無統計學意義(P>0.05),見表2。
2.4 2組嬰兒VDR基因BsmI和FokI位點基因多態性與佝僂病風險性的關系 校正性別和年齡后,結果顯示FokI位點攜帶FF基因型個體的佝僂病發生風險是攜帶Ff+ff基因型個體的3.918倍,差異具有統計學意義(OR=3.918,95%CI1.174~8.918,P=0.045),而BsmI位點基因型BB與bb+Bb個體相比,佝僂病發病差異無統計學意義(OR=1.034,95%CI0.437~1.562,P=0.782)。
2.5 2組嬰兒VDR基因FokI位點不同基因型血鈣、血磷、骨密度、B-ALP及25-(OH)D3比較 2組骨密度和25-(OH)D3在不同基因型間差異均具有統計學意義(P<0.05),而不同基因型間血鈣、血磷以及B-ALP間差異無統計學意義(P>0.05)。兩兩比較結果顯示FF基因型個體骨密度和25-(OH)D3水平均明顯低于攜帶Ff和ff基因型個體(P<0.05),見表3。
3 討 論
據報道,中國北方地區佝僂病的流行率為40%左右[7]。人體大部分骨礦含量的累積發生在嬰兒及青少年時期,至30歲左右達到骨量峰值(peak bone mass,PBM)。PBM代表個體一生中所能達到的最大BMD值,PBM的高低與原發性骨質疏松癥發生密切相關[8]。嬰幼兒作為佝僂病的高發群體,雖不會給患兒生命安全造成威脅,但會引起患兒抵抗力下降,致使其容易發生腹瀉、貧血等疾病,因此正確識別和診斷佝僂病至關重要[9]。B-ALP作為骨合成過程中的關鍵酶,由成骨細胞合成分泌,如果小兒體內缺乏維生素D,骨鈣化不足,成骨細胞就會活躍,B-ALP活性就會升高[10]。本研究結果顯示佝僂病患兒血鈣、骨密度以及25-(OH)D3明顯低于健康對照組,而血磷和B-ALP明顯高于健康對照組,差異具有統計學意義(P<0.05)。提示血鈣、骨密度、25-(OH)D3、血磷和B-ALP均可作為診斷佝僂病的生化指標。
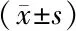
表1 2組嬰兒血鈣、血磷、骨密度、B-ALP及25-(OH)D3水平比較
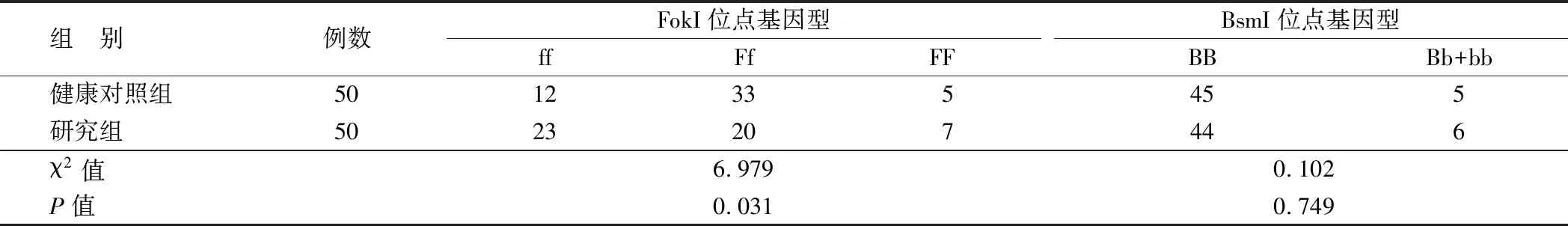
表2 2組嬰兒VDR基因BsmI和FokI位點基因多態性分布比較 (例)
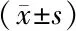
表3 2組嬰兒VDR基因FokI位點不同基因型血鈣、磷、骨密度、B-ALP以及25-(OH)D3比較
注:組內與ff基因型比較,aP<0.05;組內與Ff基因型比較,bP<0.05
嬰兒時期的PBM與性別、鈣吸收、運動、體質以及遺傳等諸多因素有關。文獻報道稱即使在陽光充足的地域,佝僂病的發病率也比較高,且給予患兒補充維生素D之后的效果也不盡相同,說明佝僂病的發生不僅與環境和營養因素有關,還與基因遺傳因素有關[11]。維生素D與骨代謝有著非常密切的關系。人體內維生素D主要活性形式是25-(OH)D3,它通過對腸、腎、骨等靶器官的作用發揮其抗佝僂病的生理功能[12]。維生素D受體(vitamin D receptor,VDR)作為核內生物大分子,屬于一種配體依賴的核轉錄因子,通過與其他激素如甲狀旁腺激素共同維持鈣、磷的動態平衡,調節骨骼代謝[13]。近年來,研究發現維生素D受體基因是調控骨和鈣代謝的候選基因[14]。本研究結果顯示煙臺地區嬰幼兒VDR基因FokI位點基因多態性和佝僂病風險性相關,攜帶FF基因型個體的佝僂病發生風險是攜帶Ff+ff基因型個體的3.918倍,說明FokI位點FF基因更容易發生佝僂病。
與骨代謝相關的VDR基因FokI位點在VDR基因5'端第二個外顯子轉錄起始位點,當由ATG突變為ACG時,原本由從第一位起始密碼子ATG轉錄(f型VDR基因),轉變成從下游存在ATG開始轉錄(F型VDR基因)[5]。因此,F位點的VDR所表達出來的蛋白質長度要短于f位點,因此其親和力、穩定性及轉運活力要比f位點高,所以F位點的VDR所表達出來的蛋白質能夠增加腸道對鈣的吸收,從而增加BMD。FokI位點基因多態性可能主要是通過影響鈣和維生素D的攝入,從而引起佝僂病的發生[16]。另外本研究還對比了佝僂病嬰兒和健康嬰兒不同基因型個體血鈣、血磷、骨密度、B-ALP以及25-(OH)D3的差異,結果顯示FokI位點FF基因型個體骨密度和25-(OH)D3水平均明顯低于攜帶Ff和ff基因型個體(P<0.05),說明FokI位點基因多態會影響到骨代謝,從而引起佝僂病發生。而對于BsmI位點多態性,本研究尚未發現其與佝僂病風險性相關,研究結果與銀川地區嬰兒BsmI位點多態性分布差異無統計學意義一致[17]。可能是因為BsmI位點在VDR內含子中,因此并不改變VDR蛋白的序列。
綜上所述,煙臺嬰幼兒FokI位點基因多態性和骨密度、25-(OH)D3水平密切相關,FF基因型可能是佝僂病發生的遺傳危險因素,提示佝僂病發生不僅與維生素D缺乏和紫外照射不足有關,還與基因異常突變有關,通過對嬰兒VDR基因檢測,從遺傳角度進行評估,明確個體對維生素D需求的差異,從而采取個性化干預方案,有利于針對性地指導嬰兒對維生素D和鈣的攝入,從而降低佝僂病發生率。
利益沖突:無
作者貢獻聲明
王道靜、呂為萍:設計研究方案,實施研究過程,論文撰寫,提出研究思路,分析試驗數據,論文審核;李建友、厲吉霞:實施研究過程,資料搜集整理

