二甲雙胍改善長期體外培養骨髓間充干細胞的增殖和分化功能
章淑艷 倪德勝 王維戚
骨髓間充質干細胞(bone marrow mesenchymal stem cells, BMMSCs)具有自我更新和多向分化特性以及很強的免疫調控功能,在組織工程和再生醫學以及多種疾病的細胞治療領域具有很好的應用前景[1-2]。然而,長期體外培養會引起BMMSCs的功能改變,如表面標志表達降低,增殖能力減低以及分化異常等,影響了BMMSCs的應用[3-5]。因此,如何改善長期體外培養BMMSCs的功能是目前再生醫學和細胞治療領域十分關注的問題。
二甲雙胍(metfomin, Met)作為一種重要的糖尿病治療藥物,可以促進骨質疏松模型的骨量恢復[6]。氧化應激是衰老、骨質疏松、糖尿病等病理條件下BMMSCs功能受損的重要因素[7]。近年來的研究表明Met具有抵抗氧化應激的能力[8]。本研究旨在探討Met能否改善體外長期培養過程中BMMSCs的增殖和成骨分化功能,及其與調控細胞氧化應激水平的關系。
1 材料與方法
1.1 材料
1.1.1 實驗動物 12 周齡雌性C57小鼠(佳木斯大學動物實驗中心)。
1.1.2 主要試劑 主要試劑 α-MEM液體培養基和胎牛血清(Invitrogen, 美國); Met、 茜素紅(Sigma, 美國); 0.25%胰蛋白酶(MPB iomedicals,美國); 細胞增殖與毒性檢測試劑盒(上海七海復泰生物科技有限公司); BCIP/NBT堿性磷酸酯酶顯色試劑盒(上海碧云天生物技術公司); 結晶紫(Amresco,美國); GENMED細胞內氧化應激活性氧(ROS)初級熒光測定試劑盒(GenMed, 美國); TrizolReagent、 RT-PCR試劑盒(Takara,日本); PCR引物由上海生工生物工程有限公司根據設計合成。
1.2 方法
1.2.1 BMMSCs分離培養 小鼠處死后置于75%酒精中5 min,取股骨及脛骨放于20%胎牛血清的α-MEM培養液的培養皿, 1 ml注射器將骨髓沖出,收集到離心管,吹散后均勻接種于塑料培養皿中, 37 ℃、 5% CO2孵箱中培養。待細胞融合達到80%左右,胰酶消化傳代。選取P1代和P6代的細胞進行后續實驗。
1.2.2 細胞增殖實驗 MMSCs按照1×103/孔的密度接種于96 孔板,每孔接種200 μl培養液,檢測時每孔加入20 μl CCK-8,孵箱避光孵育2 h后, 酶標儀讀取450 nm的吸光度值。連續檢測7 天,第0 天的吸光度值作為基準,取每1 d的吸光度值與其的比值繪制生長曲線。根據藥物濃度設為3 組,每孔加入10 μl Met,濃度分別為10、 100、1 000 nmol/L。
1.2.3 克隆形成實驗 BMMSCs消化計數后,按照1×104/皿的密度接種, 37 ℃, 5% CO2孵箱培養, 每4 d換液, 14 d時去除培養液,PBS清洗,4%多聚甲醛固定后,0.2%結晶紫染液進行染色,后PBS清洗,拍照。
1.2.4 成骨分化 BMMSCs消化計數后,按照2×105/孔的密度接種于12孔板,待細胞融合到80%左右更換成成骨誘導液,每3 d換液,誘導7 d后進行ALP染色, 14 d后進行茜素紅染色。
1.2.5 ALP染色 成骨誘導7 d后,去除誘導液,PBS清洗,加入配置好的ALP染色試劑,避光染色5~30 min,PBS清洗,拍照并使用Image J測定灰度值。
1.2.6 茜素紅染色 成骨誘導14 d后,去除誘導液,PBS清洗,異丙醇進行固定,0.1%茜素紅染液進行染色,PBS清洗,拍照并通過十六烷基丙磺酸鈉溶解后檢測吸光度值進行定量。
1.2.7 ROS檢測 BMMSCs按照4×105/孔的密度接種于6 孔板,待細胞鋪滿率達到70%,使用ROS初級熒光測定試劑盒進行檢測,倒置顯微鏡觀察。
1.2.8 RT-PCR檢測 應用Trizol提取各組細胞的總RNA進行濃度測定,反轉錄成cDNA,再以cDNA為模板在相應基因的引物作用下進行擴增,使用ABI7500 RT-PCR儀(ABI公司, 美國)進行檢測。引物序列見表 1。
1.3 數據處理
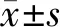

表 1 RT-PCR引物序列
2 結 果
2.1 P1和P6代BMMSCs增殖和成骨分化能力比較
P6代BMMSCs的生長曲線明顯低于P1代細胞(P<0.05)(圖 1A),表明P6代BMMSCs的增殖能力較低。克隆形成實驗(圖 1B、 1C)說明P6代BMMSCs的克隆形成能力低于P1代細胞(P<0.05)。PCR結果(圖 1H、1I)顯示P6代BMMSCs的增殖相關基因Ccnd1和Ccne1表達水平顯著低于P1代細胞(P<0.05)。
成骨分化誘導后的ALP(圖 1D、 1E)和茜素紅染色(圖 1F、1G)結果表明,P6代BMMSCs的成骨分化能力明顯低于P1代細胞(P<0.05)。PCR結果(圖 1J、 1K)表明與P1代細胞相比,P6代BMMSCs的成骨相關基因OCN和Runx2的表達水平較低(P<0.05)。
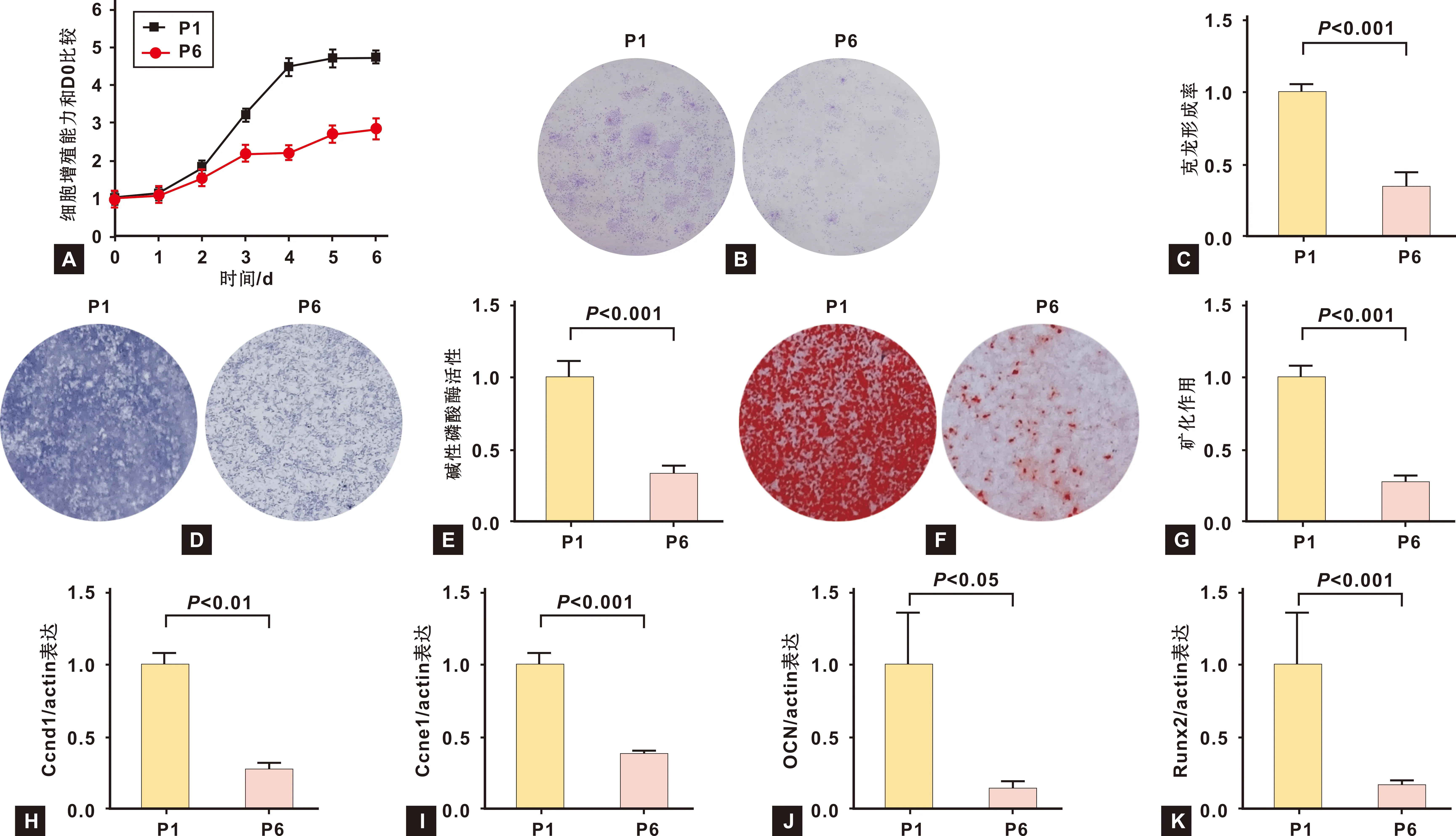
圖 1 P1和P6代小鼠BMMSCs的增殖,克隆形成和成骨分化能力比較
2.2 Met對P6代BMMSCs增殖能力的影響
從生長曲線(圖 2A)中可以看到,Met處理可以提高P6代BMMSCs的增殖能力,其中100 nmol/L濃度的提高作用最明顯(圖 2B、 2C)。100 nmol/L的Met可以顯著提高P6代BMMSCs的克隆形成能力(P<0.05)。圖 2D、 2E顯示Met處理可以增強P6代BMMSCs的增殖相關基因Ccnd1和Ccne1的表達水平(P<0.05)。
2.3 Met對P6代BMMSCs成骨分化能力的影響
ALP染色(圖 3A、 3B)和茜素紅染色(圖 3C、 3D)結果表明100 nmol/L Met提高了P6代BMMSCs的成骨分化能力(P<0.05),PCR結果表明(圖 3E、 3F)Met可以提高P6代BMMSCs成骨相關基因OCN和Runx2的表達水平(P<0.05)。
2.4 Met對P6代BMMSCs氧化應激和抗氧化能力的影響
ROS染色(圖 4A,4B)顯示P6代BMMSCs相對于P1代BMMSCs,ROS含量明顯升高,Met處理可以有效減少ROS的產生(P<0.05)。抗氧化相關基因Foxo1,Foxo3,Sod1和Sod2的PCR結果(圖 4C~4F)表明與P1代BMMSCs相比,P6代BMMSCs的抗氧化相關基因表達明顯降低,Met處理可以部分恢復其表達水平(P<0.05)。
2.5 Met對P6代BMMSCs干細胞屬性(干性)和衰老的影響
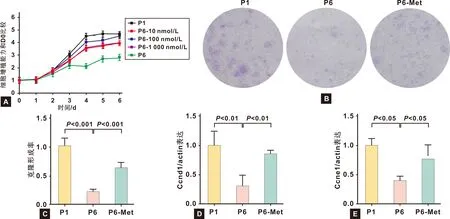
圖 2 Met對P6代小鼠BMMSCs增殖能力的作用
圖 3 Met對P6代小鼠BMMSCs成骨分化功能的作用
PCR技術檢測結果表明P6代BMMSCs相對于P1代BMMSCs,干性相關基因Nanog、 Sox2、 C-myc和Klf4的表達水平明顯降低,Met處理可以顯著增加這些基因的表達水平(P<0.05)(圖 5A~5D)。P6代BMMSCs的衰老相關標志基因p16和p53表達增高,且可以被Met降低(P<0.05)(圖 5E~5F)。
3 討 論
Met具有促進BMMSCs成骨分化的功能[9],并且具有減輕高血糖引起的氧化應激對BMMSCs損傷的作用[10]。本研究中,首先驗證了體外長期培養過程中小鼠來源BMMSCs的增殖和成骨分化功能降低。我們將不同濃度Met加入培養體系中,發現Met可以增強P6代BMMSCs的增殖能力,且100 nmol/L的效果較50 nmol/L和1 000 nmol/L更明顯。進一步研究發現,Met可以增強P6代BMMSCs的克隆形成能力和成骨分化功能,提示Met可應用于體外培養體系中以改善MSCs功能。
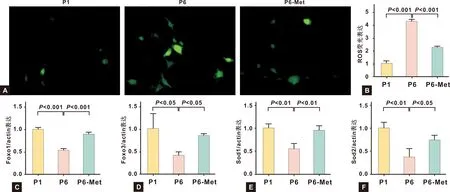
圖 4 Met對P6代小鼠BMMSCs的氧化應激和抗氧化能力的作用
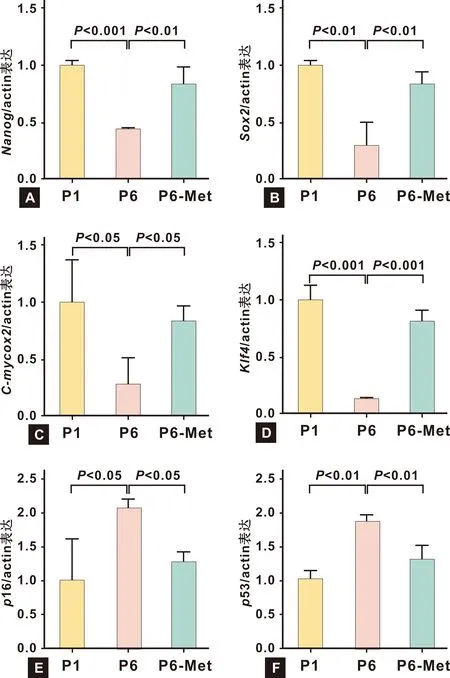
圖 5 Met對P6代小鼠BMMSCs的干性和衰老相關基因的作用
Fig 5 The effects of Met on the expression level of stemness and senescence genes of P6 mice BMMSCs
氧化應激是體外長期培養過程中細胞功能受損的重要因素[11]。有研究發現,ROS產生過多引起氧化應激,損害BMMSCs的增殖和成骨功能,促進細胞衰老[12]; 降低細胞的氧化應激水平,可以改善BMMSCs功能[13]。本研究發現Met可以降低長期體外培養BMMSCs的氧化應激水平,提高抗氧化相關基因的表達水平,提示抑制氧化應激可能是Met改善長期培養BMMSCs增殖和成骨分化能力的一種機制; 進一步檢測干性相關標志物的表達水平,發現Met可以促進相關基因的表達水平,提示Met可能對體外長期培養過程中BMMSCs的干性維持具有有利作用; 進一步研究還發現Met可以降低體外長期培養BMMSCs中衰老相關標志基因的表達水平。
綜上所述,Met可以有效改善體外長期培養小鼠來源BMMSCs的增殖和成骨分化功能,提示可以將其作為優化細胞培養體系的手段,以促進BMMSCs的體外擴增和臨床應用。

