mRNA穩定因子HuR通過cyclinD1的靶向作用對人乳腺癌MCF-7細胞株行為的影響
鄭克思 鄭翔 曾勇 陳聰 吳元肇 鄭克文
乳腺癌是一種嚴重危害婦女健康的惡性腫瘤,在全球范圍內,其發病率均呈大幅上升趨勢,但隨著生物技術的發展,新型靶向藥物研制的成功,使乳腺癌患者的預后得到很大的改善[1]。但乳腺癌作為一種異質性腫瘤,各亞型在自然病程和治療反應方面差異較大,因此繼續尋找一種特異性生物標志物應用于乳腺癌預后的判斷及新型靶向藥物的研制,已經成為乳腺癌治療的一種必然。目前大量的研究表明,腫瘤的發生、發展與細胞周期調控異常有關,而細胞周期特異性蛋白D1(cyclin D1)是調控細胞周期的關鍵蛋白,已被證實為原癌基因,其過度表達可以導致細胞的惡性轉化。而在腫瘤中,人抗原R(HuR)作為一種RNA結合蛋白,主要通過基因的轉錄后調節機制調節靶基因的表達,進而調控腫瘤細胞增殖、分化、凋亡、血管生成和淋巴管生成等過程。相關研究表明,在卵巢癌、胃癌、乳腺癌、宮頸癌等腫瘤組織中均能檢測到HuR、cyclinD1的過表達[2-7]。本文以人乳腺癌MCF-7細胞為研究對象,探討HuR通過cyclinD1對乳腺癌細胞行為的影響,現報道如下。
1 材料和方法
1.1 實驗材料 MCF-7人乳腺癌細胞株(武漢普諾賽公司);RPMI 1640細胞培養液、胰蛋白酶、FBS、1%青鏈霉素(美國Gibco公司);pU6gRNACas9EGFP載體及pIRES2-ZsGreen載體(美國 Addgene公司);LipofectamineTM2000轉染試劑、TRIzol試劑(美國Invitrogen公司);RT-PCR試劑盒、T4 DNA連接酶、限制性內切酶Xho I、EcoR I(大連 Takara公司);DNA 膠回收試劑盒(上海生工公司);Transwell小室(美國Corning公司);RIPA裂解液、BCA蛋白濃度測定試劑盒、MTT檢測試劑盒(上海碧云天公司);細胞凋亡檢測試劑盒(南京凱基公司);HuR抗體、cyclin D1抗體;甘油醛-3-磷酸脫氫酶(GAPDH)抗體、HRP標記羊抗兔二抗(武漢三鷹公司)。
1.2 方法
1.2.1 細胞培養及分組 將MCF-7細胞放在含有10%FBS和1%青鏈霉素的RPMI 1640培養基中培養,并置于37℃、5%CO2環境下生長。細胞融合至80%左右時常規傳代。將MCF-7細胞分為對照組、HuR過表達組(構建HuR過表達載體并轉染)、HuR敲低組(構建HuR敲低載體并轉染)。
1.2.2 HuR過表達載體的構建與轉染 按照TRIzol試劑盒說明書提取MCF-7細胞的總RNA,反轉錄獲得cDNA,以此cDNA為模板進行PCR擴增:Premix Taq 12.5μl、上下游引物各 1μl、模板 2μl、加 ddH2O 至 25μl的反應體系。反應條件為 94℃ 5 min,94℃ 30s,61℃30s,72℃ 2min,共 30 個循環,72℃延伸 10min,電泳后切膠回收HuR基因片段。用限制性內切酶Xho I、EcoR I將回收的HuR片段與載體pIRES2-ZsGreen分別進行雙酶切,將酶切產物用T4 DNA連接酶構建HuR過表達載體,并進行DNA測序鑒定。
1.2.3 HuR敲低載體的構建 使用CRISPR在線設計工具(http://crispr.mit.edu/)設計HuR基因的 gRNA(序列:5′-AGAGCGATCAACACGCTGAA-3′;上海吉瑪制藥技術有限公司合成),退火成雙鏈后,連接克隆到經Bbs I酶切的pU6gRNACas9EGFP載體上。然后轉化到感受態的大腸桿菌DH5α后,挑單克隆提取質粒和測序分析,驗證得到正確克隆的質粒。
1.2.4 熒光定量PCR檢測HuR、cyclinD1 mRNA的表達 細胞轉染48h后分別收集HuR過表達組和HuR敲低組細胞,同時收集對照組細胞。按照TRIzol試劑盒說明書提取細胞的總RNA,反轉錄獲得cDNA,以此cDNA為模板進行熒光定量PCR。選取GAPGH作為內參,利用2-ΔΔCT相對定量法測定并計算HuR、cyclinD1 mRNA的相對表達量。各基因引物序列見表1。

表1 各基因引物序列
1.2.5 Western blot檢測 HuR、cyclinD1蛋白的表達細胞轉染48h后分別收集對照組、HuR過表達組、HuR敲低組細胞,細胞裂解液4℃裂解,12 000r/min離心30min,吸取上清液獲取總蛋白。根據BCA蛋白定量結果上樣,10%SDS-PAGE凝膠電泳2.5h,轉膜后NC膜TBS稍蕩洗,5%脫脂奶粉室溫封閉1h,4℃下分別孵育HuR、cyclinD1一抗過夜,TBST洗10min×3次,室溫孵育二抗1h,TBST洗10min,重復3次,曝光顯影;采用BIO-RAD Image Lab軟件進行灰度值分析。
1.2.6 MTT檢測細胞增殖活性 細胞轉染48h后進行MTT檢測。將對照組、HuR過表達組、HuR敲低組細胞接種于96孔板。每孔加入10μl MTT,37℃孵育4h,吸出培養基,加入150μl DMSO震蕩10min,酶標儀測定各孔在波長568nm下的吸光度值(OD)。
1.2.7 Annexin V-APC/7-AAD雙染檢測細胞凋亡率細胞轉染48h后分別收集對照組、HuR過表達組及HuR敲低組的細胞。預冷PBS洗2~3次,調整細胞濃度至 5×105/ml,加入 100μl Binding Buffer重懸細胞。加入5μl Annexin V-APC 和 5μl 7-AAD 染液混勻,避光室溫孵育 10min。再次加入 400μl 1×BindingBuffer。然后樣品于流式細胞儀檢測分析。
1.2.8 Transwell實驗檢測細胞遷移 細胞轉染48h后分別收集對照組、HuR過表達組及HuR敲低組的細胞。用無血清培養基稀釋細胞濃度至2×105/ml。在24孔板中加入800μl 10%含FBS培養基,并放入transwell小室,在transwell上室分別接入200μl各組細胞懸液,37℃,5%CO2培養箱培養 48h。取出 transwell,用 PBS 小心清洗小室1遍,用70%冰乙醇溶液固定細胞1h。用0.5%結晶紫染液染色,室溫中放置20min,PBS清洗,用干凈的棉球將上室一側未遷移的細胞擦干凈,顯微鏡下觀察拍照,計數細胞數量。
1.3 統計學處理 采用SPSS 17.0統計軟件,計量資料以表示,組間比較采用獨立樣本t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 HuR過表達載體及敲低載體構建 構建的HuR過表達及敲低載體經測序分析表明插入的序列及位點正確,目的基因HuR的過表達及敲低載體質粒構建成功,見圖1。

圖1 HuR過表達載體及敲低載體質粒測序鑒定(a:HuR過表達載體部分測序結果;b:HuR敲低載體部分測序結果)
2.2 HuR對MCF-7細胞增殖的影響 見圖2。
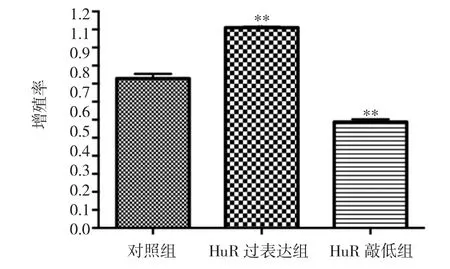
圖2 HuR對MCF-7細胞增殖的影響(與對照組比較,**P<0.01)
由圖2可見,與對照組比較,HuR過表達組細胞的增殖率顯著增加(t=-18.29,P<0.01),HuR敲低組細胞的增殖率顯著降低(t=13.83,P<0.01)。
2.3 HuR對MCF-7細胞遷移的影響 見圖3。

圖3 HuR對MCF-7細胞遷移的影響(a:對照組MCF-7細胞的HE染色圖,b:HuR過表達組MCF-7細胞的HE染色圖,c:HuR敲低組MCF-7細胞的HE染色圖,×200;d:各組細胞遷移數量的柱形圖,與對照組比較,*P<0.05)
由圖3可見,與對照組比較,HuR過表達組細胞的遷移數量增加(t=-4.57,P<0.05),HuR 敲低組細胞的遷移數量降低(t=3.91,P<0.05)。
2.4 HuR對MCF-7細胞凋亡的影響 見圖4。
由圖4可見,與對照組比較,HuR過表達組細胞的凋亡率顯著降低(t=3.70,P<0.05),HuR敲低組細胞的凋亡率顯著升高(t=-45.32,P<0.01)。
2.5 HuR對cyclinD1表達的影響 見圖5。
由圖5可見,與對照組比較,HuR過表達組細胞中HuR、cyclinD1蛋白表達水平顯著升高(t=-10.55、-6.75,均P<0.01),HuR敲低組細胞中HuR、cyclinD1蛋白表達水平顯著降低(t=21.35、4.33,P<0.05 或 0.01)。與對照組比較,HuR過表達組細胞中HuR、cyclinD1 mRNA表達水平顯著升高(t=-11.70、-9.34,均P<0.01),HuR敲低組細胞中HuR、cyclinD1 mRNA表達水平顯著降低(t=21.88、9.55,均P<0.01)。
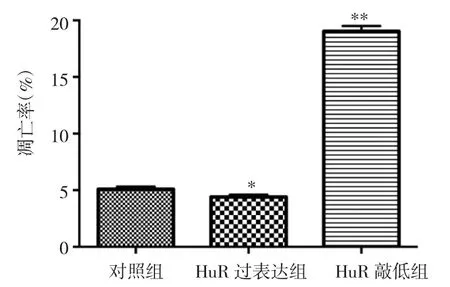
圖4 HuR對MCF-7細胞凋亡率的影響(注:與對照組比較,*P<0.05,**P<0.01)
3 討論
HuR是RNA結合蛋白中胚胎致死異常視覺(ELAV)家族的重要一員,其基因在機體各組織中廣泛表達,通過調控靶mRNA的穩定性和(或)翻譯效率來影響靶基因在細胞中的表達水平,而且這種調控多以正向調控為主,從而參與細胞生命活動的調控[8-12]。在生理狀態下,HuR主要定位在細胞核,功能是與靶基因的mRNA結合形成復合物,穿梭到胞質,在此過程中HuR保護mRNA避免衰變降解;在病理狀態下,HuR胞質表達增加,阻止含AREs靶基因脫腺苷化降解過程,延長mRNA的壽命,使其蛋白異常增加[8-12]。近年來研究表明,HuR與人乳腺癌、結直腸癌、宮頸癌、卵巢癌和胃癌的發生、侵襲及轉移有關,可能是影響胃癌、乳腺癌、大腸癌等預后的因素[2-7]。2005年,Heinonen等[13]發現胞質HuR表達與HER2陰性、PR和ER陽性、p53表達、癌腫的分級及管狀分化表型相關,并發現HuR在細胞質中的高表達可以作為浸潤性導管乳腺癌診斷的分子標志。在本研究中,HuR過表達組細胞的增殖率和遷移數量顯著增加,細胞凋亡率降低;HuR敲低組細胞的增殖率和遷移數量顯著降低,細胞凋亡率顯著升高。表明HuR可以促進人乳腺癌MCF-7細胞增殖和遷移活動,降低MCF-7細胞的凋亡。
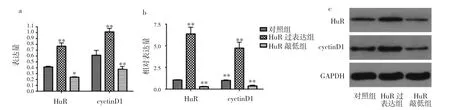
圖5 HuR對cyclinD1表達的影響(a:各組HuR、cyclinD1蛋白表達水平柱狀圖;b:各組HuR、cyclinD1 mRNA表達水平柱狀圖;c:各組HuR、cyclinD1 蛋白電泳圖。注:與對照組比較,*P<0.05,**P<0.01)
細胞增殖呈周期性變化,增值周期中有多個調控點,其中最重要的是起始調控點即G1-S間的前期調控點,此點主要由cyclinD1決定,當受生長因子刺激cyclinD1增多,與CDK4/CDK6結合使其活化為蛋白激酶,使Rb蛋白磷酸化,Rb蛋白磷酸化后構象改變而轉錄因子E2F分離使其發揮強大的轉錄作用使細胞增殖[14-15]。大量研究表明,腫瘤的發生與細胞周期調控異常有關,cyclinD1已被證實為原癌基因,它們的過度表達或錯誤調控均可導致細胞的惡性轉化[14-15]。目前研究cyclinD1含295氨基酸,由染色體上11q13上的CCND1基因編碼,動物模型和細胞培養表明cyclinD1蛋白過度表達可使細胞周期縮短,對分裂原的依賴性減弱[14-15]。有人應用基因轉染技術cyclinD1 cDNA導入生育期小鼠中,發現乳腺組織CCND1擴增,其中8只小鼠發展為乳腺癌并不同程度合并其他腫瘤,證明了CCND1作為原癌基因在乳腺癌形成過程中起重要的促進作用[16]。在乳腺癌細胞培養中Buckley觀察了20種癌細胞系,發現25%的樣本存在cyclinD1基因的表達升高,45%的樣本其mRNA水平較正常高[17-18];而乳腺癌研究中發現大約一半的浸潤癌cyclinD1蛋白的表達水平高于正常上皮,cyclinD1可作為乳腺癌腫瘤標記之一[17-18]。胡向陽等[19]用免疫組化的方法檢測發現乳腺癌中cyclinD1表達陽性率顯著高于良性乳腺組織,cyclinD1表達出現于導管內癌并持續于浸潤轉移等過程中,與年齡、腫瘤大小、組織學類型等無相關性,但與組織學分級呈負相關。O′Connor等[20]報道cyclin D1在乳腺癌中的過表達與預后呈正相關。
HuR參與細胞周期的調控,研究表明,HuR蛋白能夠通過轉錄后調控機制調節 p21、p27、cyclinA、cyclinB1、p53等多種與細胞周期相關的基因在細胞中的表達[21-24]。在肺癌細胞的研究中發現,豬苓多糖能通過HuR介導的轉錄后途徑調控A549細胞cyclin D1表達[25]。在人腎臟系膜細胞中,研究表明在血管緊張素Ⅱ刺激下可促使胞核內HuR蛋白向胞質內轉移增強cyclinD1蛋白表達進而刺激人腎小球系膜細胞增殖[26]。細胞周期蛋白可分為3類:S期周期蛋白,M期周期蛋白,G1期周期蛋白。S期周期蛋白為cyclin A,M期周期蛋白為cyclin B,G1期周期蛋白為cyclin C、D、E。相關文獻表明HuR能調控各周期蛋白的表達,Guo等[27]發現微小RNA可以通過HuR調節cyclin E1在乳腺癌中的表達,Schroeder等[28]發現在細胞增殖過程中HuR調控cyclin A和cyclinB1 mRNA的穩定性。在本研究中,cyclinD1在HuR過表達組細胞中表達顯著升高,在HuR敲低組中顯著降低,提示HuR可能通過上調cyclinD1的表達,影響細胞周期,從而促進MCF-7細胞的惡性生物學行為。
本研究以熒光定量PCR及Western blot檢測HuR、cyclinD1蛋白及mRNA的表達水平,結果顯示與對照組比較,HuR過表達組細胞中HuR、cyclinD1蛋白及mRNA的表達水平顯著升高,HuR敲低組細胞中HuR、cyclinD1蛋白及mRNA的表達水平顯著降低,提示HuR與cyclinD1在乳腺癌演進過程中有協同作用。目前研究認為轉錄后調節mRNA產物的最具特征性的順式作用元件是AREs(富含腺嘌呤A和尿嘧啶U的序列),定位在許多不穩定mRNA的3′非翻譯保守區(3′UTR),而在HuR蛋白上有3個RNA識別模序(RRMs),可以與AREs特定位點結合[8-12]。HuR作為一種mRNA結合蛋白,連接于3′UTR含有AREs的短壽命mRNA,可以抑制該mRNA的快速衰變降解,從而增強其轉錄后翻譯的能力[8-12]。HuR蛋白已被證實可以通過轉錄后調控機制調節 cyclinA、cyclinB1、c-fos、VEGF、TNF-α、β 連接素(β-catenin)、c-Myc、COX-2、myogenin、MyoD、GMCSF、p21、p27、p53 與 HSP70 等多種基因在細胞中的表達,而相關的研究顯示這些基因的mRNA都富含AREs[21-24]。目前cyclinD1基因的mRNA亦被證實富含AREs,提示cyclin D1的過表達可能是通過HuR穩定其mRNA實現的。
綜上所述,HuR可能通過上調cyclinD1的表達,影響細胞周期,從而促進MCF-7細胞的惡性生物學行為。因此,HuR、cyclinD1基因可能為乳腺癌的新治療靶點。

