胞內分枝桿菌肺病CT特征:與堪薩斯、膿腫/龜分枝桿菌肺病比較
楊晴媛,邢志珩*,秦中華,謝 祎,孫 昕
(1.天津市海河醫院放射科,天津 300350;2.天津市呼吸疾病研究所,天津 300350)
近年來,非結核分枝桿菌肺病發病率逐步升高。在我國,胞內分枝桿菌為非結核分枝桿菌肺病的主要菌種[1]。胞內分枝桿菌肺病臨床癥狀不典型,細菌學培養時間長、病程遷延,導致診斷困難。治療胞內分枝桿菌肺病與其他常見分枝桿菌肺病如堪薩斯分枝桿菌和膿腫分枝桿菌肺病用藥差異很大[2]。胞內分枝桿菌、膿腫分枝桿菌對抗結核藥高度耐藥,而堪薩斯分枝桿菌耐藥率較低[3]。本研究探討胞內分枝桿菌肺病CT特征,并與堪薩斯分枝桿菌、膿腫/龜分枝桿菌肺病對比,旨在為早期臨床診斷及治療提供幫助。
1 資料與方法
1.1 一般資料 收集2014年1月—2016年12月于我院確診的35例胞內分枝桿菌肺病患者,男20例,女15例,年齡14~85歲,中位年齡70.0歲。收集同期18例堪薩斯分枝桿菌肺病患者(男14例,女4例,年齡26~76歲,中位年齡36.5歲)和22例膿腫/龜分枝桿菌肺病患者(男14例,女8例,年齡26~77歲,中位年齡61.0歲)。全部診斷均符合中華醫學會結核病學分會《非結核分枝桿菌病診斷與治療專家共識》[4]標準,其中35例胞內分枝桿菌肺病、16例堪薩斯分枝桿菌肺病和22例膿腫/龜分枝桿菌肺病患者2次痰培養均為同一致病菌;1例堪薩斯分枝桿菌肺病患者為支氣管灌洗液培養陽性且陽性度2+以上;另1例堪薩斯分枝桿菌肺病患者肺活組織檢查發現肉芽腫性炎,且痰標本和支氣管沖洗液標本培養均為陽性。排除免疫缺陷患者。
1.2 儀器與方法 采用Toshiba Asteion 4層螺旋CT掃描機,囑患者仰臥,掃描范圍自肺尖至肺底。掃描參數:管電壓120 kV,管電流240 mA,螺距1∶1,軟組織和高分辨算法重建,重建層厚5 mm,層距5 mm。
1.3 圖像分析 由2名具有3年及以上胸部影像學診斷工作經驗的醫師共同閱片,于窗位-600 HU、窗寬1 500 HU肺窗圖像上進行測量和觀察。評估內容包括病灶累及肺葉數目、側別、部位,毀損肺(正常肺組織被廣泛的干酪病變、空洞、纖維化或支氣管擴張等病理性改變所替代,基本喪失肺功能),非牽拉性支氣管擴張,結節支氣管擴張,牽拉性支氣管擴張,小葉中心結節和樹芽征,索條影,肺內鈣化,胸膜滲出、增厚、鈣化,縱隔淋巴結增大、鈣化等。對合并空洞者測量最大空洞壁厚度(于空洞壁最厚處測量)和空洞腔大小(空洞最大橫截面腔內長徑與短徑的平均值)。

2 結果
胞內分枝桿菌肺病與堪薩斯分枝桿菌肺病患者年齡差異有統計學意義(Z=3.436,P=0.001),與膿腫/龜分枝桿菌肺病患者年齡差異無統計學意義(Z=2.188,P=0.029),3者間性別差異無統計學意義(χ2=2.199,P=0.333)。
2.1 胞內分枝桿菌肺病CT表現 胞內分枝桿菌肺病病灶累及范圍廣泛且分散,多為雙肺、多葉,甚至全部肺葉彌漫受累。影像學表現多樣,主要CT征象按出現比率依次為索條影、實變、小葉中心結節和樹芽征、胸膜增厚、磨玻璃密度影、牽拉性支氣管擴張、非牽拉性支氣管擴張、結節、肺內鈣化及空洞,次要征象包括結節支氣管擴張、縱隔淋巴結鈣化、縱隔淋巴結增大、胸膜鈣化、毀損肺及胸膜滲出,見表1。
2.2 胞內分枝桿菌肺病與堪薩斯分枝桿菌、膿腫/龜分枝桿菌肺病CT特征比較 與堪薩斯分枝桿菌相比,胞內分枝桿菌病灶累及肺葉數差異有統計學意義(P<0.001),胞內分枝桿菌肺病更多累及全部肺葉,累及肺葉部位及側別差異無統計學意義(P均>0.05)。與膿腫/龜分枝桿菌肺病相比,胞內分枝桿菌肺病累及側別、肺葉數及部位差異均無統計學意義(P均>0.05)。
胞內分枝桿菌、堪薩斯分枝桿菌、膿腫/龜分枝桿菌肺病患者空洞壁厚度分別為6.20(3.90,9.40)mm、3.90(2.75,4.55)mm及3.90(3.08,4.58)mm,空洞腔大小分別為(21.06±11.80)mm、(20.20±9.50)mm及(20.00±9.77)mm。胞內分枝桿菌肺病空洞壁厚與堪薩斯分枝桿菌、膿腫/龜分枝桿菌肺病差異均有統計學意義(Z=2.339、2.257,P=0.019、0.024),空洞腔大小與堪薩斯分枝桿菌、膿腫/龜分枝桿菌肺病差異無統計學意義(F=0.033,P=0.968)。
與堪薩斯分枝桿菌肺病相比,胞內分枝桿菌肺病磨玻璃密度影多(P=0.001),肺內鈣化多(χ2=6.009,P=0.014),空洞少(P=0.004)。與膿腫/龜分枝桿菌肺病相比,胞內分枝桿菌肺病磨玻璃密度影多(χ2=12.438,P<0.001),肺內鈣化多(χ2=7.356,P=0.007),縱隔淋巴結增大多(χ2=7.747,P=0.005);見圖1~3。胞內分枝桿菌肺病與堪薩斯分枝桿菌、膿腫/龜分枝桿菌肺病其余CT征象差異無統計學意義(P均>0.05),見表1。
3 討論
既往研究[5]認為鳥-胞內分枝桿菌復合體肺病的主要影像學征象為結節支氣管擴張和纖維空洞,且結節支氣管擴張是復發危險因素[6]。近年來,有學者[7-8]開始關注胞內分枝桿菌肺病的影像學特征,將其與鳥-胞內分枝桿菌復合體肺病進行比較,發現胞內分枝桿菌肺病患者具有體質量指數低、患慢性基礎性肺病等特點,影像學多表現為樹芽征、支氣管擴張、實變、結節和纖維空洞,臨床癥狀更重、預后更差。本研究中胞內分枝桿菌肺病患者年齡較大,病灶累及范圍廣,包括雙肺、多葉,甚至累及全部肺葉。胞內分枝桿菌肺病主要影像學表現的病理基礎為肺實變及磨玻璃密度影提示滲出性反應;小葉中心結節和樹芽征、結節提示肉芽腫增殖炎性反應;索條影、牽拉性支氣管擴張、肺內鈣化、胸膜增厚提示膠原纖維增生硬化性反應;空洞提示干酪樣壞死、膠原纖維增生混合性反應[9]。胞內分枝桿菌肺病影像學表現多樣,反映其復雜且進程不一的病理生理過程,是患者臨床癥狀較重、病程遷延的重要因素。此外,胞內分枝桿菌肺病患者年齡較大,預后較差,及早臨床診斷、針對菌種合理用藥尤為重要。

表1 胞內分枝桿菌肺病與堪薩斯分枝桿菌、膿腫/龜分枝桿菌肺病的CT征象分析[例(%)]
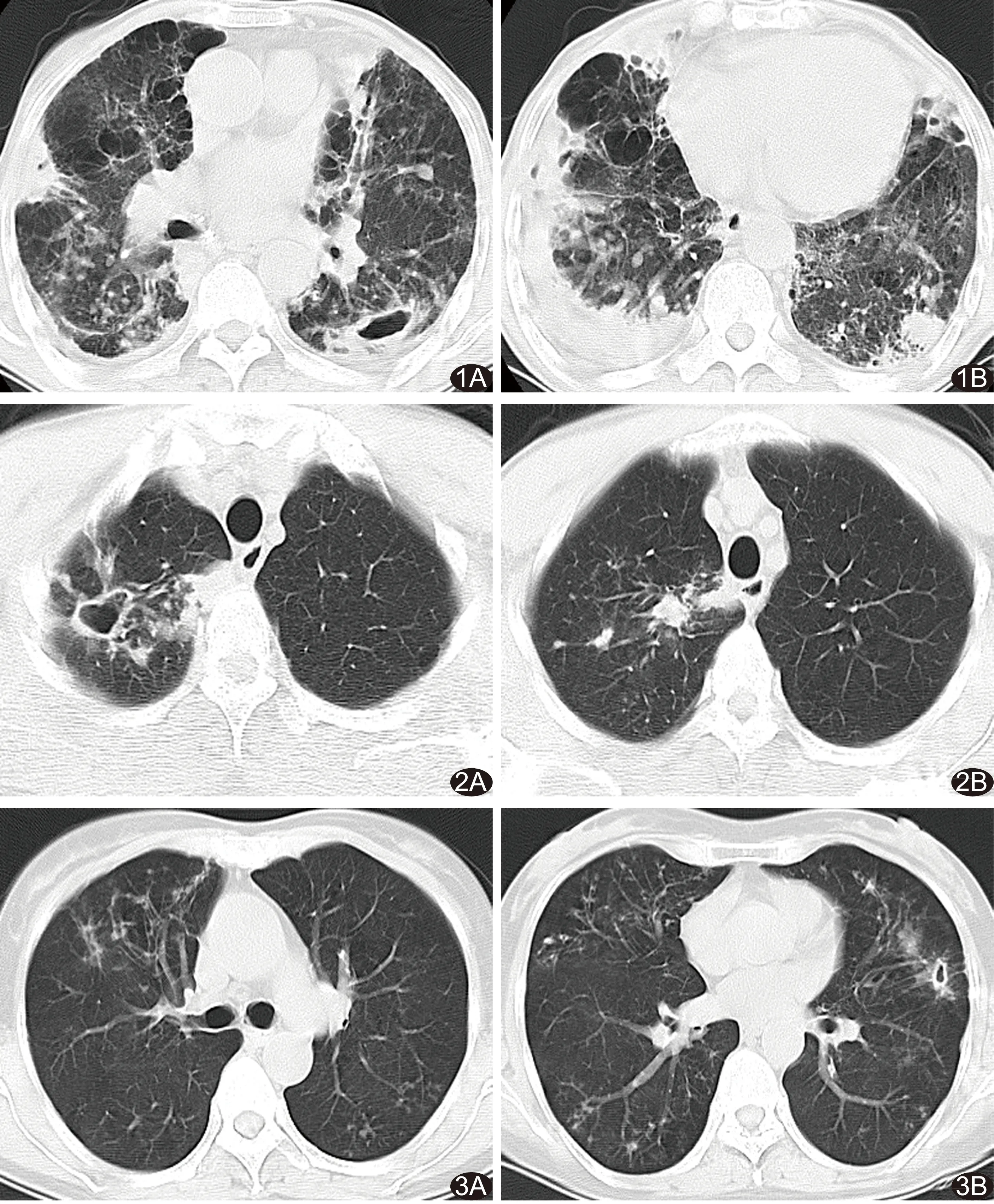
圖1 患者男,76歲,胞內分枝桿菌肺病,病灶分布分散,累及雙肺多個肺葉,以磨玻璃密度影、厚壁空洞及肺內鈣化灶為主要表現 A.左肺下葉厚壁空洞壁厚約8.5 mm,左肺上葉可見牽拉性支氣管擴張,雙肺多發小葉中心結節、結節、實變、磨玻璃密度影及索條影,部分結節鈣化; B.雙肺下葉散在小葉中心結節、結節、實變、索條影及磨玻璃密度影,部分結節鈣化,右側胸膜增厚粘連伴包裹性積液 圖2 患者男,30歲,堪薩斯分枝桿菌肺病,病灶分布局限,累及右肺上葉,以薄壁空洞為主要表現 A.右肺上葉尖段薄壁空洞,壁厚3.4 mm,并見索條、實變影; B.右肺上葉多發結節和實變影 圖3 患者女,59歲,膿腫/龜分枝桿菌肺病,病灶分布分散,累及雙肺全部肺葉,以結節支氣管擴張為主要CT表現 A.右肺上葉多發結節支氣管擴張,左肺上葉多發樹芽征; B.右肺中下葉、左肺上葉舌段及下葉多發結節支氣管擴張,左肺上葉舌段可見薄壁空洞,周圍多發索條影
有研究[10]認為與膿腫分枝桿菌肺病相比,鳥-胞內分枝桿菌復合體肺病以空洞為主要影像學表現,而前者以結節支氣管擴張為主。本研究對比觀察胞內分枝桿菌肺病與堪薩斯、膿腫/龜分枝桿菌肺病影像學表現,發現胞內分枝桿菌肺病空洞少于堪薩斯分枝桿菌肺病患者,縱隔淋巴結增大多于膿腫/龜分枝桿菌肺病患者;實變、小葉中心結節和樹芽征、結節支氣管擴張三者無明顯差異,磨玻璃密度影、空洞壁厚度、肺內鈣化差異均有統計學意義。相比堪薩斯、膿腫/龜分枝桿菌肺病,胞內分枝桿菌肺病主要CT特征為磨玻璃密度影、厚壁空洞和肺內鈣化。磨玻璃密度影提示以淋巴細胞、巨噬細胞浸潤為主的滲出性改變;空洞提示肺組織破壞,壁厚則提示病灶支氣管引流欠佳、空洞壁纖維化不佳;肺內鈣化提示缺血、肉芽腫萎縮、膠原纖維增生所致硬化性反應。以上征象反映了胞內分枝桿菌肺病生長緩慢、病程遷延、患者預后差的特點。
研究[11]表明,鳥-胞內分枝桿菌復合體病患者中耐藥和持續陽性者較多,有效者較少,基本僅見于強化或修改一線方案和接受手術切除感染肺組織者。具有肺部并發癥和纖維空洞的男性患者預后較差,纖維空洞可增加非結核分枝桿菌肺病的死亡率[12-13]。鳥-胞內分枝桿菌復合體肺病患者5年死亡率較高,約27%[14],其中大環內酯耐藥者5年死亡率可達47.1%[15]。鳥-胞內分枝桿菌復合體包括胞內分枝桿菌,因而可在一定程度上反映胞內分枝桿菌肺病的治療效果及預后。但目前研究熱點依舊為鳥-胞內分枝桿菌肺病,對于胞內分枝桿菌肺病的治療效果及預后尚待進一步驗證。
綜上所述,胞內分枝桿菌肺病累及肺葉范圍廣、分布分散,CT表現多樣;相比堪薩斯、膿腫/龜分枝桿菌肺病,其顯著CT特征為磨玻璃密度影、厚壁空洞和肺內鈣化,有助于臨床早期診斷及治療。

