中華鱘免疫分子CD22的克隆及生物信息學挖掘
來璇 金鈺婷 金語嫣 廖志勇

摘要? ? 為研究中華鱘免疫分子CD22的結構及其可能對應的功能,克隆中華鱘CD22 cDNA(CsCD22),進行生物信息學分析,根據結構推測功能。結果表明,成功克隆中華鱘CD22 cDNA序列,該序列全長1 748 bp,包含1個1 170 bp的開放閱讀框,共編碼389個氨基酸,包含3個Ig超家族結構域和3個潛在的N-糖基化位點。綜上所述,中華鱘CD22分子具有高度保守的結構特征,推測其具有與其他動物CD22分子相似的免疫學功能。
關鍵詞? ? 中華鱘;CD22;序列分析;功能預測
中圖分類號? ? S917.4? ? ? ? 文獻標識碼? ? A? ? ? ? 文章編號? ?1007-5739(2019)09-0204-03
Abstract? ? In order to study the structure of CD22 and its possible corresponding functions,the Acipenser sinensis CD22 cDNA(CsCD22)was cloned and analyzed by bioinformatics.The results showed that the CD22 cDNA sequence of Acipenser sinensis was successfully cloned.The full length of the sequence was 1 748 bp and it contained a 1 170 bp open reading frame encoding a total of 389 amino acids,including three Ig superfamily domains and three potential N-glycosylation sites.In summary,the Acipenser sinensis CD22 molecule has a highly conserved structural feature and is presumed to have immunological functions similar to those of other animal CD22 molecules.
Key words? ? Acipenser sinensis;CD22;sequence analysis;functional prediction
CD是位于細胞膜上的一類分化抗原的總稱,是白細胞(以及血小板、血管內皮細胞等)分化為不同譜系和分化成熟的不同階段及活化過程中出現的細胞表面標志[1]。CD22為Ⅱ型跨膜蛋白,是唾液酸結合免疫球蛋白樣凝集素家族成員[2]。在哺乳動物體內,CD22維持B細胞抑制的基線水平,以控制體液免疫[3]。CD22限制了BCR的信號傳遞,使其在強直信號傳遞、對病原體的反應和自身免疫的預防之間達到平衡[4]。
作為B細胞受體的抑制性共受體,CD22對中華鱘B細胞激活信號具有負性調節作用,特別是抑制細胞內Ca2+信號[5]。中華鱘免疫分子CD22對于控制B細胞的信號傳導閾值特別是對B細胞早期發育起重要調節作用,對其凋亡的調控及陰性選擇尤為重要[6]。此外,能夠與包含2-2,6連接唾液酸的糖蛋白配體特異性結合,抗原激活BCR,也使CD22胞質區免疫受體酪氨酸抑制基序中的酪氨酸迅速磷酸化,并激活下游信號分子抑制鈣離子內流而減弱BCR信號。CD22參與B細胞的歸巢過程。因CD22相對特異地表達于B細胞表面,已成為調節B細胞免疫以及治療某些B細胞腫瘤的良好靶標[2]。
中華鱘(Acipenser sinensis)在動物分類上隸屬于魚綱鱘形目鱘科鱘屬,別名鱘魚、鰉魚、苦臘子、鳣等[7],是上堊紀遺留至今的古老魚種,已有1.4億年的歷史,是我國獨有的古老珍稀物種,也是脊椎動物中較原始的魚類,在其身上能夠探尋出物種進化的陳跡,中華鱘被人們稱為魚類始祖的“活化石”[8]。鱘魚肉質鮮美,營養豐富,具有極高的食用價值與藥用價值。中華鱘在食品、科研等方面的大規模應用使其在現代社會中的經濟價值逐漸凸顯。中華鱘主要分布于我國東南沿海的大陸架水域和長江中下游的干流內[9];喜好在粗糙的河床底質產卵,需要有一定速度的水流,對環境條件的要求較高,這是中華鱘在長期進化過程中產生的生態適應[10]。然而,隨著棲息地的減少、環境的惡化,中華鱘新產卵地的有效繁殖種群數量和環境容量減少[11],許多中華鱘品種面臨滅絕的危險。為了保護生態多樣性,自 1983年開始,國家明令禁止對長江中華鱘的商業捕撈,1984年從葛洲壩下捕撈的中華鱘親魚的人工繁殖獲得成功,開始人工放流并且持續至今[12],在這些過程中疾病防治問題不可避免。對中華鱘免疫的研究不僅有利于加強人們對免疫學的了解,還能為中華鱘人工養殖、野生保護過程中出現的疾病防治問題提供理論基礎。
1? ? 材料與方法
1.1? ? 試驗試劑
RNeasy Plus Mini Kit(Qiagen,德國),SMART cDNA libr-ary construction kit(Clontech,美國),DH10B Competent cell(Tiangen,北京),Vitagene 96-easy plasmid Miniprep kit(Vi-tagene,意大利),其他化學試劑均為國產分析純。
1.2? ? 試驗方法
1.2.1? ? 中華鱘脾臟CD22基因克隆。于-80 ℃取出中華鱘脾臟組織,在液氮中充分研磨,稱取100 mg左右脾臟組織于1.5 mL無菌離心管,加入1 mL TRIpure充分混勻;FORTEX渦旋振蕩15 s充分混勻,于室溫靜置5 min,從而保證核蛋白體充分裂解;4 ℃,最高速11,000×g離心10 min,小心吸取上清至新的無核酸酶離心管中,加0.2 mL氯仿,蓋緊管蓋,渦旋振蕩15 s,室溫靜置3 min;4 ℃,最高速冷凍離心15 min,離心后的混合液分為3層(由下至上),第1層為紅色有機苯酚氯仿層(蛋白質),第2層為DNA,第3層為無色水樣層(RNA);將水樣層轉移至無核酸酶離心管中,加入等體積異丙醇,上下顛倒混勻5~10次,室溫靜置10 min;4 ℃,最高速11,000×g冷凍離心3 min,棄上清;重復離心步驟1次,小心用移液槍吸出多余液體;室溫靜置3 min,晾干沉淀,加入50 μL無核酸酶充分溶解RNA,利用NanoDrop 2000測RNA濃度及OD260/OD280;抽提的RNA于-70 ℃保存,避免降解。
1.2.2? ? 中華鱘CD22 cDNA(CsCD22)文庫構建。使用SMART cDNA library construction kit構建中華鱘脾臟全長cDNA文庫。將長度大于500 bp的cDNA片段連接至pDNR-LIB載體,轉化DH10B感受態細胞。隨機挑取cDNA陽性克隆菌,直接接種于含有1 mL YT培養基的96孔板中,37 ℃孵育過夜。利用Vitagene 96-easy plasmid Miniprep kit抽提菌液中的DNA,送往上海生工生物公司完成測序工作。使用T7引物,從5端測序,篩選中華鱘CD22 cDNA序列[13]。
1.2.3? ? 生物信息學分析。用Bioxm 軟件分析中華鱘CsCD22 cDNA序列開放閱讀框;通過SMART(http://smart.emblhei-delberg.de)在線分析CsCD22功能結構域;通過http://www.cbs.dtu.dk/services/NetNGlyc/在線預測CsCD22糖基化位點;通過NetNGIyc 1.0 Server(http://www.cbs.dtu.dk/services/NetN
Glyc/)在線預測CsCD22的磷酸化位點;通過http://www.cbs.dtu.dk/services/SignalP/在線預測CsCD22信號肽序列;通過ExPASy-COILS進行CsCD22的蛋白質卷曲螺旋預測(embnet.vital-it.ch/software/COILS_form.html);利用BioEdit軟件進行氨基酸同源性比對及保守結構的分析;CsCD22蛋白空間結構模型由SWISS-MODEL(https://swissmodel.expasy.org/)在線預測。
2? ? 結果與分析
2.1? ? CsCD22 cDNA序列及功能域分析
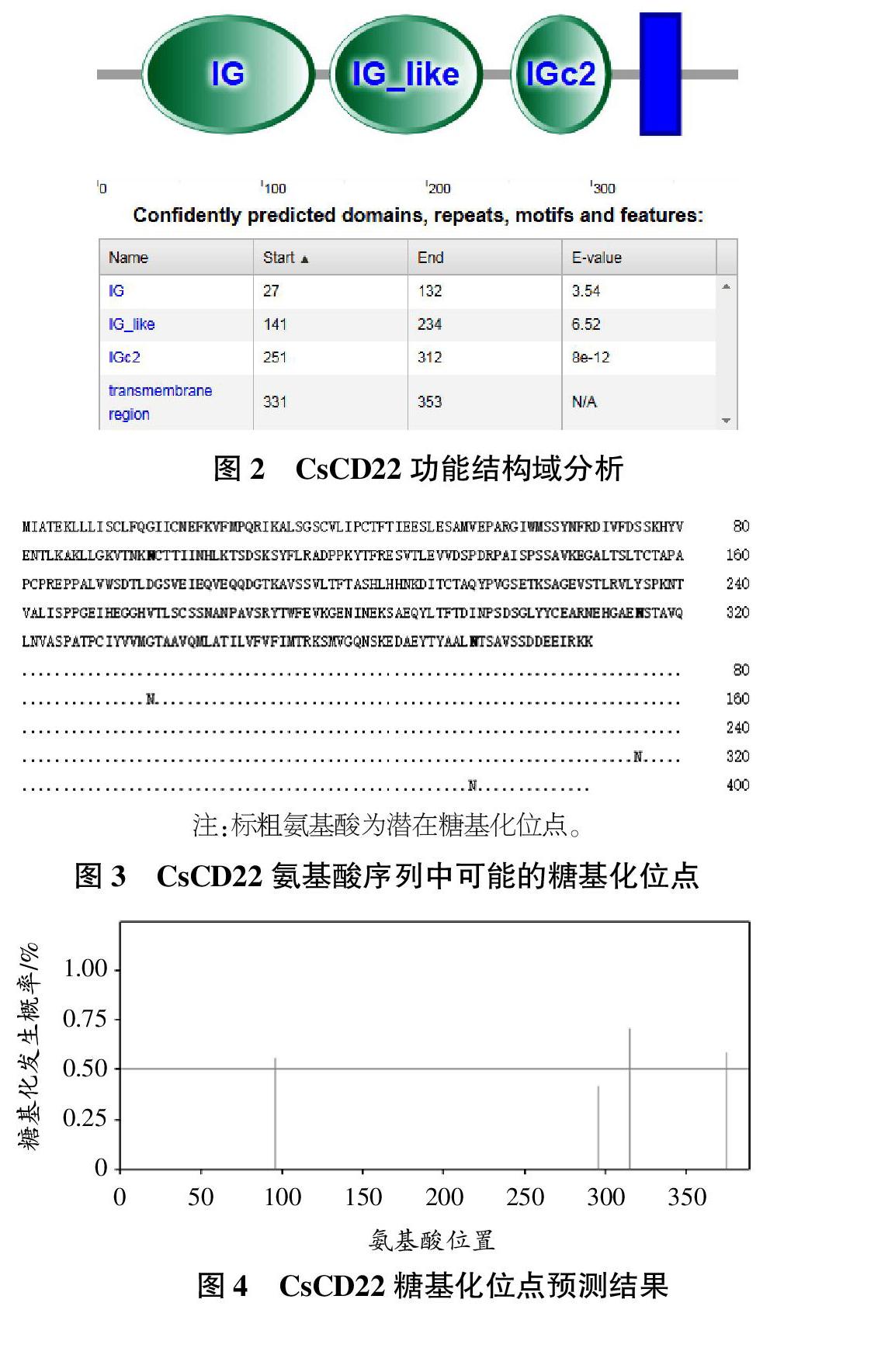
CsCD22全長為1748 bp,其中包括1個65 bp的5′非編碼區、1 170 bp的開放閱讀框和488 bp的3′非編碼區。3′端有1個典型的polyA尾巴,其上游附近有1個加尾信號(AA-TAAA)。CsCD22的開放閱讀框編碼389個氨基酸(圖1),預測其等電點為4.78、分子量為42.8 kDa。同時,其N端包含1個由11個氨基酸組成的信號肽。SMART在線預測結果顯示(圖2),CsCD22含有3個Ig超家族結構域(Ig superfamily),該結構域提供與不同球狀結構多肽或化學基團粘附的部位,從而發揮免疫學功能。
2.2? ? CsCD22糖基化位點預測
通過NetNGIyc 1.0 Server(http://www.cbs.dtu.dk/services/NetNGlyc/)在線預測CsCD22的糖基化位點。結果如圖3、4所示,96、315、374位天冬酰胺處的信號超過了臨界值,是潛在的糖基化位點。
2.3? ? CsCD22磷酸化位點預測
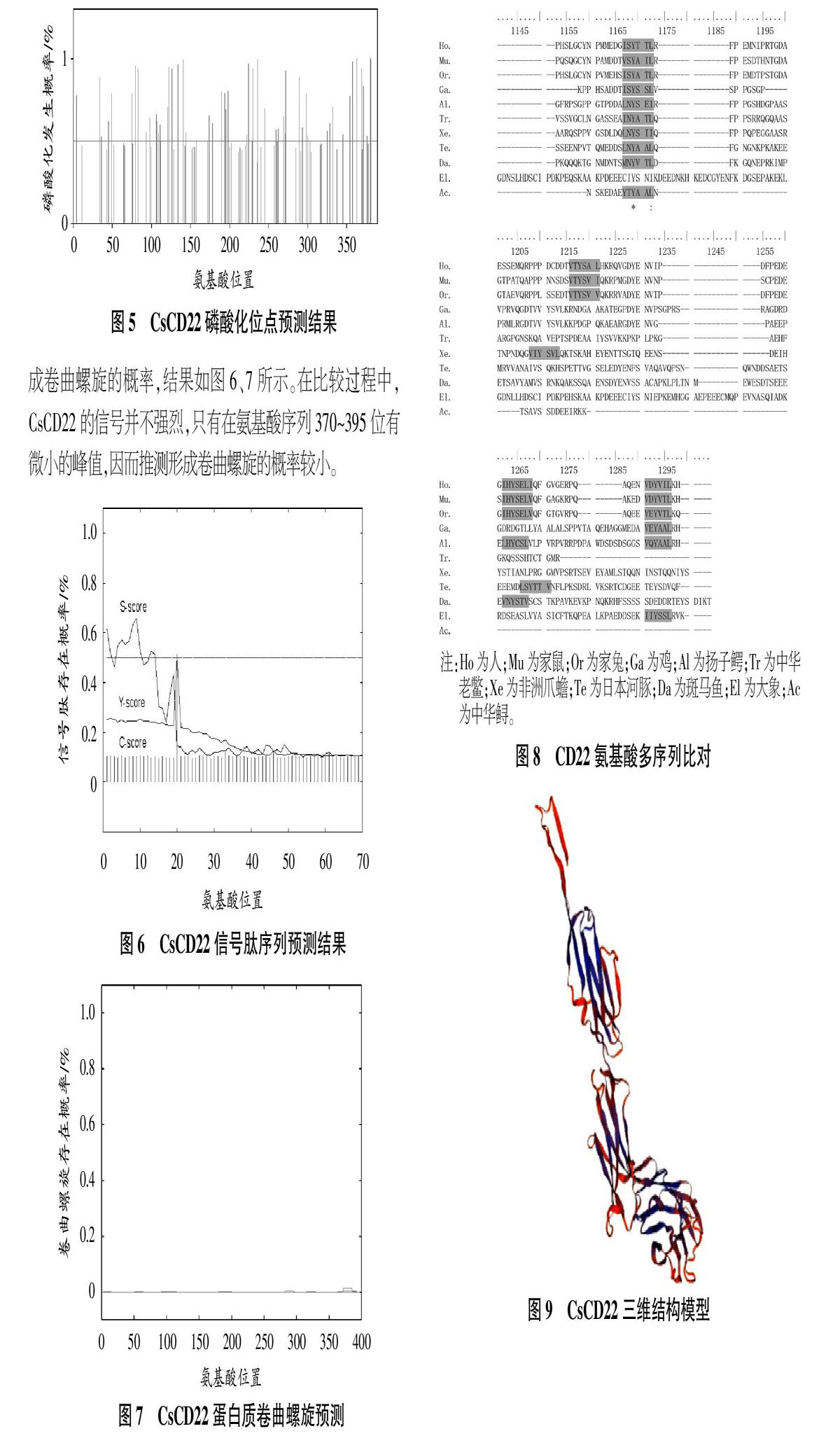
引入磷酸基團之后,CsCD22的分子構象發生變化,造成酶活力的缺失或者獲得。磷酸化導致CsCD22核內特定基因的表達,成功完成對外界信號的應激性。利用NetNGIyc 1.0 Server(http://www.cbs.dtu.dk/services/NetNGlyc/)在線預測CsCD22的磷酸化位點,結果如圖5所示。
2.4? ? CsCD22信號肽序列及蛋白質卷曲螺旋預測
CsCD22的信號肽位于疏水氨基區上游,長約11個氨基酸殘基。負責把CsCD22引導到細胞內不同膜結構的亞細胞器內,這與它跨膜的性質相吻合。利用Coils Server在線(https://embnet.vital-it.ch/software/COILS_form.html)進行CsC
D22蛋白質卷曲螺旋預測,將序列與已知的平行雙鏈卷曲螺旋數據庫進行比較,得到相似性得分,并據此算出序列形成卷曲螺旋的概率,結果如圖6、7所示。在比較過程中,CsCD22的信號并不強烈,只有在氨基酸序列370~395位有微小的峰值,因而推測形成卷曲螺旋的概率較小。
2.5? ? CsCD22三維結構模型分析
CD22氨基酸多序列比對結果如圖8所示,可以看出,CD22氨基酸在進化過程中是保守的。多物種中具有典型的ITIM結構域,這與使信號通路上的分子去磷酸化,從而向細胞內傳遞抑制性信號達到下調細胞的活性作用密切相關,也是CD22分子具有免疫活性的關鍵所在。基于序列保守性這一前提,模擬了CD22的三維結構模型(圖9)。
3? ? 結論與討論
通過分子生物學、生物信息學研究手段,鑒定得知CsCD
22 cDNA全長為1 748 bp,其開放閱讀框有1 170 bp,共編碼389個氨基酸。CsCD22的開放閱讀框編碼389個氨基酸,預測其等電點為4.78、分子量為42.8 kDa,包含3個Ig超家族結構域和3個潛在的N-糖基化位點。生物信息學結果顯示,96、315、374位天冬酰胺是CsCD22的潛在糖基化位點。CsCD22的信號肽位于疏水氨基區上游,長約11個氨基酸殘基。氨基酸多序列對比及功能域分析結果顯示,CsCD22在物種進化過程中高度保守,與其他物種的CD22具有較高的同源性,其中具有典型的ITIM結構域,這與使信號通路上的分子去磷酸化,從而向細胞內傳遞抑制性信號達到下調細胞的活性作用密切相關,暗示它們在免疫防御方面的功能可能是相近的。
4? ? 參考文獻
[1] 鄧子新,陳峰.微生物學[M].北京:高等教育出版社,2017:245.
[2] 徐洪來,肖敏,劉強,等.CD22分子機制的研究進展[J].醫學綜述,2015,21(15):2720-2722.
[3] ERE?譙O-ORBEA,J,SICARD,T,CUI,H,et al.Molecular basis of human CD22 function and therapeutic targeting[J].Nature Communications,2017,8(1):1-11.
[4] DEPOIL,D,DUSTIN,M L.Agile CD22 nanoclusters run rings around fenced BCR[J].The EMBO Journal,2016,35(3):237-238.
[5] CHEN,J,WANG,H,XU,W,et al.Besides an ITIM/SHP-1-dependent pathway,CD22 collaborates with Grb2 and plasma membrane calcium-ATPase in an ITIM /SHP-1-independent pathway of attenuation of Ca 2+i signal in B cells[J].Oncotarget,2016,7(35):56129-56146.
[6] 葛新順,廖曉龍.CD22分子的生物學功能研究進展[J].交通醫學,2007(1):24-26.
[7] 吳劍峰.中華鱘的過去,現在和將來[J].生物學教學,1993(7):36-38.
[8] 云文.“活化石”:中華鱘[J].中國釣魚,1995(2):41.
[9] 張輝,危起偉.命運堪憂的中華鱘[J].大自然,2016(6):8-11.
[10] 常劍波,曹文宣.中華鱘物種保護的歷史與前景[J].水生生物學報,1999(6):712-720.
[11] HUANG Z,WANG L.Yangtze Dams increasingly threaten the survival of the Chinese sturgeon[J].Curr Biol,2018,28(22):3640-3647.
[12] 肖慧.葛洲壩水利樞紐與珍稀魚類保護的實踐[M]//黃真理.21世紀長江大型水利工程中的生態與環境保護.北京:中國環境科學出版社,1998:199-209.
[13] 劉榴,石君玲,尤修玲,等.大鯢泛素結合酶cgsUBE2L3基因克隆及其在免疫應答中的表達分析[J].安徽農業科學,2017,45(22):93-97.
基金項目? ?浙江省大學生科技創新活動計劃暨新苗人才計劃(2018R42 9034)。
*通信作者
收稿日期? ?2019-01-11

