Cripto-1 siRNA聯(lián)合5-FU對大腸癌細胞增殖和遷移的影響及與EMT的關系
華麗,周燕紅,游紅霞
(1湖北醫(yī)藥學院,湖北十堰442000;2湖北科技學院)
近年來,隨著飲食結構、生活習慣和環(huán)境的改變,我國大腸癌的發(fā)病率呈逐年上升的趨勢,嚴重威脅人類健康[1]。大腸癌早期缺乏特異性表現(xiàn),不易被發(fā)現(xiàn),確診時多為晚期,手術切除率低,通常采取化療手段。5-氟尿嘧啶(5-FU)是晚期大腸癌患者化療的首選藥物[2],但大部分患者仍死于化療藥物的不良反應和腫瘤的復發(fā)轉(zhuǎn)移。如何減少化療藥物的不良反應并抑制腫瘤復發(fā)和轉(zhuǎn)移,對治療大腸癌具有重要意義。研究顯示,Cripto-1是一種癌基因,參與腫瘤的侵襲與轉(zhuǎn)移[3]。在上皮間質(zhì)轉(zhuǎn)化(EMT)進程中,由于細胞極性的改變、細胞間黏附性下降等增強了細胞侵襲運動能力,促進了腫瘤細胞向遠處發(fā)生轉(zhuǎn)移。研究顯示,在人類大腸癌形成和腫瘤侵襲過程中伴隨著EMT[4]。上皮標志物E鈣黏蛋白(E-cadherin)是上皮細胞表面的黏附分子,對細胞之間的黏附起重要作用;間質(zhì)標志物鋅指轉(zhuǎn)錄因子(Snail)是EMT過程中的關鍵轉(zhuǎn)錄因子。2018年3~9月,我們采用小干擾RNA(siRNA)技術沉默人大腸癌細胞中Cripto-1的表達,并聯(lián)合5-FU共同作用,觀察其對大腸癌細胞增殖和遷移的影響,并探討其與EMT的關系。
1 材料與方法
1.1 材料 人大腸癌Lovo細胞購自中科院細胞庫。5-FU(TCI公司),RPMI1640培養(yǎng)基(Gibico公司),胰蛋白酶(Gibico公司),胎牛血清(Gibico公司)。脂質(zhì)體LipofectamineTM2000轉(zhuǎn)染試劑盒、Opti-MEM培養(yǎng)基、TRIzol試劑均購自Invitrogen公司,人工合成3對Cripto-1-siRNA和無義序列RNA(上海吉瑪基因有限公司),Transwell小室(美國BD公司),CCK-8檢測試劑盒(中國Biosharp公司),低速離心機(德國Eppendorf公司),倒置顯微鏡(日本Olympus公司)。鼠單抗E-cadherin(CST公司),兔多抗snail(武漢三鷹生物技術有限公司),兔多抗Cripto-1(Abcam公司)。
1.2 細胞培養(yǎng)與分組 人大腸癌Lovo細胞常規(guī)培養(yǎng)于含10%胎牛血清的RPMI1640培養(yǎng)基中,置于37 ℃、5% CO2厭氧培養(yǎng)箱中。待細胞貼壁80%左右即可傳代,復蘇后傳2~3代,待細胞狀態(tài)穩(wěn)定后用于實驗。將細胞分為正常對照組、Cripto-1 siRNA組、5-FU組、聯(lián)合組。正常對照組加入含10%胎牛血清的RPMI1640培養(yǎng)基中培養(yǎng)48 h。Cripto-1 siRNA組于轉(zhuǎn)染前1 d取對數(shù)期生長細胞接種于6孔板,轉(zhuǎn)染前用RPMI1640培養(yǎng)液沖洗2次;將100 μL無血清Opti-MEM培養(yǎng)基、8 μL LipofectamineTM2000、10 μL siRNA混勻,加入6孔板中,混勻后室溫下靜置25 min;轉(zhuǎn)染完成后,換普通培養(yǎng)基繼續(xù)培養(yǎng)48 h。5-FU組加入10 mg/L 5-FU培養(yǎng)48 h。聯(lián)合組先按Cripto-1 siRNA組的方法進行轉(zhuǎn)染,然后加入10 mg/L 5-FU繼續(xù)培養(yǎng)48 h。
1.3 細胞增殖能力觀察 采用CCK-8法。取各組細胞,加入10 μL CCK-8,37 ℃培養(yǎng)4 h。上酶標儀,讀取450 nm波長下的吸光度OD值。細胞增殖率=(實驗孔OD值-空白孔OD值)/(正常對照孔OD值-空白孔OD值)×100%。
1.4 細胞遷移能力觀察 采用Transwell實驗。取各組細胞,加入什么試劑制成細胞懸液,調(diào)整細胞密度為4×105/mL。在24孔板中預先加入600 μL含10% FBS的RPMI1640培養(yǎng)基,放入Transwell小室,在Transwell小室上室底部中央垂直加入100 μL終濃度為300 μg/mL的Matrigel。待Matrigel干成膠狀后,在Transwell上室分別接入200 μL各組細胞懸液,37 ℃、5% CO2培養(yǎng)箱培養(yǎng)過夜。取出Transwell,PBS清洗,70%冰乙醇溶液固定,0.5%結晶紫溶液染色,PBS清洗。用干凈棉球擦去上室表面的細胞,倒置顯微鏡下觀察,計數(shù)穿膜細胞數(shù),每組觀察5個視野,取平均值。
1.5 Cripto-1及EMT相關蛋白E-cadherin、Snail表達檢測 采用Western blotting法。收集各組細胞,加入裂解緩沖液提取總蛋白,BCA法測定總蛋白質(zhì)。10% SDS-PAGE凝膠電泳,轉(zhuǎn)印于PVDF膜。封閉液(5%脫脂奶粉,0.05% Tween20,pH 7.6)室溫封閉2 h。加入一抗(稀釋比例1∶500)4 ℃孵育過夜,加入二抗(稀釋比例1∶2 000)室溫孵育2 h。TBS洗滌3次,超敏發(fā)光液曝光,X線感光片感光,顯影定影。采用BandScan軟件分析膠片灰度值,以目的蛋白與內(nèi)參GAPDH的比值表示目的蛋白的相對表達量。
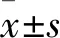
2 結果
2.1 四組細胞增殖能力比較 正常對照組、Cripto-1 siRNA組、5-FU組、聯(lián)合組的細胞增殖率分別為96.96%±2.69%、79.42%±2.46%、74.39%±4.79%、62.12%±2.80%。與正常對照組比較,其余三組細胞增殖率均降低(P均<0.05),聯(lián)合組細胞增殖率較Cripto-1 siRNA組、5-FU組降低(P均<0.05),Cripto-1siRNA組與5-FU組比較差異無統(tǒng)計學意義(P>0.05)。
2.2 四組細胞遷移能力比較 正常對照組、Cripto-1 siRNA組、5-FU組、聯(lián)合組的穿膜細胞數(shù)分別為(185.80±4.76)、(143.60±3.36)、(128.60±4.51)、(111.60±4.28)個。與正常對照組比較,其余三組穿膜細胞數(shù)均減少(P均<0.05),聯(lián)合組穿膜細胞數(shù)較Cripto-1 siRNA組、5-FU組減少(P均<0.05),5-FU組較Cripto-1 siRNA組減少(P<0.05)。
2.3 四組Cripto-1、E-cadherin、Snail蛋白相對表達量比較 Cripto-1 siRNA組、5-FU組、聯(lián)合組Cripto-1和Snail蛋白表達低于正常對照組,E-cadherin蛋白表達高于正常對照組(P均<0.05);聯(lián)合組Cripto-1和Snail蛋白表達低于Cripto-1 siRNA組、5-FU組,E-cadherin蛋白表達高于Cripto-1 siRNA組、5-FU組(P均<0.05);Cripto-1 siRNA組與5-FU組各蛋白表達比較差異無統(tǒng)計學意義(P均>0.05)。見表1。
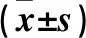
表1 四組Cripto-1、E-cadherin、Snail蛋白相對表達量比較
注:與正常對照組比較,*P<0.05;與聯(lián)合組比較,#P<0.05。
3 討論
大腸癌是消化系統(tǒng)常見的惡性腫瘤,其發(fā)病率和病死率居全球第3位[5]。5-FU為細胞周期特異性藥物[6],是大腸癌的標準輔助化療的基礎藥,其通過抑制嘧啶類核苷酸合成,抑制癌細胞DNA、RNA的合成,從而誘導細胞凋亡。5-FU治療大腸癌的單藥有效率約為20%,但其不良反應較多[7],如惡心、嘔吐、腹瀉、口腔黏膜炎等,嚴重者會出現(xiàn)白細胞減少、血紅蛋白減少、血小板減少,且長期應用導致耐藥性增加,因此其臨床應用受到限制。從基因角度出發(fā),干擾癌基因表達可減少化療藥物的用量,進而減少藥物不良反應,是一種新型治療方法。Cripto-1是一種癌基因,在腫瘤的發(fā)生、侵襲和轉(zhuǎn)移過程中起重要作用[3]。在食管癌、胃癌、宮頸癌等研究中發(fā)現(xiàn),Cripto-1可以通過EMT促進腫瘤細胞的侵襲和遷移[8~10]。文獻報道,Cripto-1在人結腸癌組織中高表達,在大腸癌患者血液中水平增高[11],但其是否參與了大腸癌細胞的侵襲轉(zhuǎn)移鮮見報道。
腫瘤的發(fā)生與腫瘤細胞的惡性增殖密切相關,抑制腫瘤細胞增殖是治療腫瘤的有效手段。本研究結果顯示,干擾組、5-FU組、聯(lián)合組增殖率明顯低于對照組,其中聯(lián)合組的增殖抑制率最低。表明干擾Cripto-1表達可抑制大腸癌Lovo細胞增殖,可能是大腸癌治療靶點,與5-FU聯(lián)用可更好地抑制大腸癌細胞的增殖,為大腸癌的化療提供了新的方法。
惡性腫瘤主要生物學特征是侵襲和轉(zhuǎn)移[12],也是腫瘤患者死亡的重要原因,抑制腫瘤的侵襲和轉(zhuǎn)移是治療的關鍵問題。本研究結果顯示,與正常對照組比較,Cripto-1 siRNA組、5-FU組、聯(lián)合組的穿膜細胞數(shù)均減少,其中聯(lián)合組最少。提示Cripto-1基因可促進大腸癌細胞的侵襲與轉(zhuǎn)移,靶向沉默Cripto-1表達能抑制大腸癌細胞的遷移能力;5-FU可以抑制大腸癌細胞的侵襲和轉(zhuǎn)移,靶向沉默Cripto-1表達聯(lián)合5-FU能夠更好地抑制大腸癌細胞的侵襲轉(zhuǎn)移。
EMT在腫瘤的浸潤與轉(zhuǎn)移過程中具有重要作用[13,14]。EMT在演變過程中伴隨著上皮黏附分子(如E-cadherin、β-catenin)的表達缺失或下調(diào)以及間質(zhì)標志物(如Snail、Vimentin等)的表達或上調(diào)。E-cadherin是上皮細胞表面的黏附分子,對細胞之間的黏附起重要作用,其表達下調(diào)使細胞之間黏附能力下降,轉(zhuǎn)移侵襲能力增強[15]。Snail是EMT過程中的關鍵轉(zhuǎn)錄因子[16],其通過與E-cadherin的啟動子區(qū)E-box結構結合,抑制E-cadherin的轉(zhuǎn)錄表達,導致細胞彼此之間的黏附力降低,誘導EMT的發(fā)生,促進腫瘤細胞浸潤和轉(zhuǎn)移。本研究結果顯示,與正常對照組比較,Snail蛋白表達下調(diào),其中Cripto-1 siRNA聯(lián)合5-FU組Snail蛋白表達受到顯著抑制,而E-cadherin蛋白的表達則完全相反。說明Cripto-1基因可能通過調(diào)控EMT促進大腸癌細胞的侵襲與轉(zhuǎn)移。既往研究表明,EMT介導腫瘤的侵襲轉(zhuǎn)移與轉(zhuǎn)化生長因子β、表皮生長因子、肝細胞生長因子、Wnt信號通路及Notch信號通路等多條信號通路相關[3],Cripto-1通過何種信號通路介導EMT仍需進一步研究。
本研究結果顯示,5-FU也可下調(diào)Cripto-1蛋白表達,說明5-FU也可能通過抑制Cripto-1信號通路而抑制大腸癌細胞的侵襲轉(zhuǎn)移。與正常對照組、5-FU組及Cripto-1 siRNA 組比較,聯(lián)合組Cripto-1蛋白表達降低,穿膜細胞數(shù)量減少,提示Cripto-1 siRNA與5-FU可能存在協(xié)同作用,降低了大腸癌細胞的侵襲轉(zhuǎn)移能力。
綜上所述,Cripto-1基因可促進大腸癌細胞的增殖與遷移,RNA干擾靶向抑制Cripto-1表達聯(lián)合5-FU可抑制大腸癌細胞的增殖與遷移,從基因角度為大腸癌的侵襲轉(zhuǎn)移機制及化療提供了新的思路,但其侵襲轉(zhuǎn)移的機制尚未明確,需進一步深入研究。

