氯吡格雷對急性腦梗死合并糖尿病患者療效及血清血管活性因子、血小板活化參數的影響
王珊珊
(天津市職業病防治院 天津市工人醫院,天津300011)
急性腦梗死(ACI)是臨床常見的缺血性腦血管疾病,血管內皮細胞生長因子(VEGF)、基質金屬蛋白酶9(MMP-9)、血管緊張素Ⅱ(AngⅡ)等血管活性因子在ACI發生發展中起重要作用。糖尿病患者機體糖脂代謝紊亂、動脈粥樣硬化、血管內皮受損嚴重,是發生ACI的高危人群[1]。血小板膜糖蛋白GPⅡb/Ⅲa與凝血酶、膠原結合,激活血小板活化和凝血過程,促進纖維蛋白原與血小板結合而轉化為纖維蛋白,導致血栓形成[2]。 由于血小板活化、異常聚集在ACI的發生和進展中具有關鍵性作用,積極抗血小板治療有助于預防血栓形成,阻止病情進展[3]。氯吡格雷是一種新型抗血小板藥物,屬于血小板腺苷二磷酸(ADP)受體拮抗藥,可選擇性地抑制ADP與血小板受體結合,阻止ADP介導的糖蛋白GPⅡb/Ⅲa復合物活化,降低纖維蛋白結合位點暴露,進而抑制血小板異常聚集[4]。有研究認為,糖尿病患者胰島素抵抗狀態可能影響氯吡格雷的抗血小板活性。因此,氯吡格雷用于糖尿病所致ACI的療效如何,尚不明確。2016年3月~2018年3月,我們觀察了氯吡格雷治療ACI合并糖尿病患者的效果及其對血管活性因子、血小板活化參數的影響。現報告如下。
1 資料與方法
1.1 臨床資料 收集天津市職業病防治院同期收治的ACI合并糖尿病患者。納入標準:①符合《中國急性缺血性腦卒中診治指南2010年版》[5]中ACI的診斷標準;②符合《中國2型糖尿病防治指南》中糖尿病的診斷標準[6];③腦梗死24 h內入院治療;④入院后經CT、MRI檢查確診梗死病灶的位置及大小。排除標準:①凝血功能障礙;②伴有上消化道活動性出血;③免疫系統疾病;④甲狀腺功能疾病;⑤腦出血性疾病;⑥短暫性腦缺血發作。選取符合標準的患者110例,采用隨機分組方式分為觀察組和對照組各55例。觀察組男35例、女20例,年齡(64.6±8.2)歲;合并高血壓38例、糖尿病55例、血脂異常23例、冠心病9例,吸煙27例;入院時GCS評分(8.85±0.85)分,其中梗死病灶體積<5 cm316例、5~10 cm324例、≥10 cm315例。對照組男32例、女23例,年齡(62.9±8.8)歲;合并高血壓32例、糖尿病55例、血脂異常25例、冠心病7例,吸煙25例;入院時GCS評分(8.89±0.94)分,其中梗死病灶體積<5 cm312例、5~10 cm330例、≥10 cm313例。兩組臨床資料具有可比性。本研究獲醫院醫學倫理委員會批準,患者家屬知情同意。
1.2 治療方法 兩組均給予基礎治療措施,包括吸氧、脫水降低顱內壓、溶栓、降糖、調脂、控制血壓、擴張血管、營養神經等對癥治療,并給予阿司匹林腸溶片(拜耳醫藥保健有限公司)100 mg/d頓服。觀察組同時給予氯吡格雷(賽諾菲安萬特杭州制藥有限公司)75 mg/d頓服。
1.3 血清血管活性因子、血小板活化參數檢測方法 分別于治療前、治療1周后,抽取患者空腹肘靜脈血。取一份血標本,3 500 r/min離心10 min,取血清;采用意大利AZXM11-Alisei全自動酶標儀以ELISA法檢測血清血管活性因子VEGF、MMP-9、AngⅡ,試劑盒購自武漢博士德生物制劑有限公司。另取一份血標本,采用美國Coulter Beckman EPICSXL流式細胞儀檢測血小板活化參數CD63、CD62P,以EXPO-analysis軟件進行數據分析,結果以熒光密度(%)表示。
1.4 臨床療效及不良反應觀察方法 分別于治療前及治療2周時,采用神經功能缺損評分(NIHSS)評價神經功能恢復情況;分別于治療前及治療3個月時,采用Barthel指數評價日常生活活動能力。治療過程中,觀察并記錄藥物不良反應的發生情況。
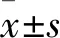
2 結果
2.1 兩組血清血管活性因子水平比較 治療前,兩組血清VEGF、MMP-9、AngⅡ水平比較差異無統計學意義;治療1周后,觀察組血清MMP-9、AngⅡ水平低于對照組而VEGF水平高于對照組(P均<0.05)。見表1。
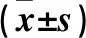
表1 兩組血清VEGF、MMP-9、AngⅡ水平比較
2.2 兩組血小板活化參數比較 治療前,兩組CD63、CD62P水平比較差異無統計學意義;治療1周后,觀察組CD63、CD62P水平低于對照組(P均<0.05)。見表2。
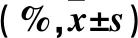
表2 兩組血小板活化參數CD63、CD62P比較
2.3 兩組神經功能缺損及日常生活活動能力比較 治療前,兩組NIHSS、Barthel指數比較差異無統計學意義;治療后,觀察組NIHSS低于對照組而Barthel指數高于對照組(P均<0.05)。見表3。
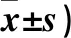
表3 兩組NIHSS、Barthel指數比較(分,
2.4 兩組藥物不良反應比較 觀察組出現胃腸道不適2例、牙齦出血2例、鼻出血1例,不良反應發生率9.09%;對照組出現胃腸道不適、牙齦出血各1例,不良反應發生率3.64%;觀察組不良反應發生率高于對照組,但差異無統計學意義(χ2=1.373,P=0.241)。
3 討論
糖尿病患者機體糖脂代謝紊亂狀態嚴重,可導致血液黏度增高、腦動脈粥樣硬化、血管內皮受損等病理改變,易形成腦血栓而導致ACI,患者往往遺留不同程度的神經功能缺損而影響其生存質量[7]。血小板活化、異常聚集是引起ACI的啟動因子,因此積極抗血小板治療對改善患者預后具有重要意義[8]。阿司匹林是ACI患者常用的抗血小板藥物,可通過抑制血小板血栓素A2生成而抑制血小板活化、異常聚集。但阿司匹林在用藥過程中易引起出血性不良反應,應予以重視[9]。
氯吡格雷可選擇性地抑制ADP與其血小板P2Y12受體結合而抑制血小板膜糖蛋白GPⅡb/Ⅲa復合物活化,進而抑制血小板的異常聚集[10]。但也有研究發現,氯吡格雷的抗血小板作用受到胰島素抵抗、P2Y12受體變異等因素的影響。胰島素抵抗狀態可引起氯吡格雷抗血小板作用受限,可能與高血糖狀態下血小板表面黏附分子P選擇素表達增加、膜流動性下降有關[11]。因此,氯吡格雷在ACI合并糖尿病患者中的應用尚存在一定爭議。
血小板活化是引起ACI的危險因素,CD63、CD62P是臨床常用的血小板活化指標[12]。血小板活化后體積增大、外形圓球化、致密顆粒增多,更易形成血栓。本研究發現,觀察組采用氯吡格雷治療1周后外周血CD63、CD62P水平低于對照組。這提示在ACI合并糖尿病患者治療中應用氯吡格雷可更好地抑制血小板活化,表明在ACI合并糖尿病的治療中應用氯吡格雷是可行的。
VEGF是血管形成的促進因子,可刺激血管內皮細胞增殖、遷移,進而促進新生血管形成。高水平VEGF有利于側支循環的建立,進而改缺血腦組織的血流灌注[13]。MMP-9可降解細胞外基質,破壞血腦屏障的完整性,進一步增加腦組織損傷程度[14]。AngⅡ是一種縮血管物質,可引起血管收縮、痙攣,增加腦動脈壁斑塊、附壁血栓的不穩定性而脫落,進而增加局部動脈栓塞的風險[15]。本研究發現,觀察組采用氯吡格雷治療1周后血清MMP-9、AngⅡ水平低于對照組而VEGF水平高于對照組。這提示在ACI合并糖尿病患者治療中應用氯吡格雷可促進新生血管形成、改善腦組織的血流灌注,并保持斑塊、附壁血栓穩定,防止ACI病情惡化。
本研究還發現,觀察組采用氯吡格雷治療后2周的NIHSS低于對照組,治療后3個月的Barthel指數高于對照組。這提示在ACI合并糖尿病患者治療過程中應用氯吡格雷可更好地促進神經功能早期恢復、改善患者日常生活活動能力。這表明氯吡格雷能夠更好地抑制血小板活化、穩定斑塊和附壁血栓、改善腦組織血流灌注,進而保護神經細胞。
應用阿司匹林治療時可出現胃腸道不適、牙齦出血、鼻出血等不良反應,給患者增加額外的痛苦[16]。本研究結果顯示,兩組治療期間的不良反應發生率差異無統計學意義。這提示在ACI合并糖尿病患者治療過程中,應用氯吡格雷的安全性良好,未增加不良反應的發生風險。
綜上所述,氯吡格雷在ACI合并糖尿病患者治療過程中,有降低血小板活性、促進神經功能早期恢復及改善患者日常生活活動能力的作用,且不增加患者的不良反應。

