D-松醇復(fù)配Mn2+對HepG2細(xì)胞胰島素抵抗的調(diào)節(jié)及其作用機(jī)制
王 夢,張澤生,李雨蒙,劉亞萍,張文菱子
(天津科技大學(xué)食品工程與生物技術(shù)學(xué)院,天津 300457)
胰島素抵抗是指各種原因使胰島素促進(jìn)葡萄糖攝取和利用的效率下降[1-2]。胰島素抵抗不僅是II型糖尿病的發(fā)病基礎(chǔ),也是高血脂癥及代謝綜合癥的共同病理基礎(chǔ)[3-4]。因此緩解胰島素抵抗是預(yù)防及改善II型糖尿病的重要環(huán)節(jié)[5-6]。HepG2細(xì)胞是與人體肝細(xì)胞極為相似的肝胚胎瘤細(xì)胞株[7-8],在高水平的胰島素作用條件下,HepG2細(xì)胞表面胰島素受體的數(shù)目下降。因此采用HepG2細(xì)胞建立胰島素抵抗細(xì)胞模型,便于觀察干預(yù)因素對胰島素抵抗的直接影響[9-10]。
D-松醇是D-手性肌醇的一種甲基化衍生物,詹天榮等[11]和Kim等[12]研究結(jié)果表明,D-松醇具有類胰島素的作用,它能夠通過提高機(jī)體對胰島素的敏感程度來緩解機(jī)體胰島素抵抗現(xiàn)象,調(diào)控機(jī)體血糖水平,而且D-松醇在促進(jìn)胰島素功能的同時還可以為機(jī)體傳輸營養(yǎng)物質(zhì)。D-松醇還具有抗腫瘤[13]、免疫調(diào)節(jié)[14]和抗炎癥[15]等生物活性。有研究表明,D-松醇可與肝細(xì)胞受損后產(chǎn)生的半乳糖胺在Mn2+的螯合作用下,形成胰島素第二信使[16],改善胰島素抵抗癥狀。
胰島素能調(diào)控糖代謝關(guān)鍵酶的基因表達(dá),且胰島素通過信號轉(zhuǎn)導(dǎo)途徑影響糖異生關(guān)鍵酶的活性,而胰島素信號轉(zhuǎn)導(dǎo)強(qiáng)度的增加或減少、發(fā)生障礙等均會影響胰島素的敏感性[17-21]。AMPK 是糖代謝的主要調(diào)控分子,是胰島素發(fā)揮生理效應(yīng)的主要信號轉(zhuǎn)導(dǎo)通路,因此可作為II型糖尿病、肥胖癥和癌癥的潛在治療靶標(biāo)[22-26]。
目前,關(guān)于D-松醇復(fù)配Mn2+緩解胰島素抵抗和作用機(jī)制的研究未見報道。本實(shí)驗(yàn)通過胰島素誘導(dǎo)HepG2細(xì)胞建立胰島素模型,探究D-松醇復(fù)配Mn2+后的降血糖作用效果,并初步探討其作用機(jī)制,為預(yù)防或延緩糖尿病及其并發(fā)癥的發(fā)生發(fā)展提供理論依據(jù)。
1 材料與方法
1.1 材料與儀器
D-松醇 純度95%,購于西安一品生物技術(shù)有限公司;食品級MnSO4科漢森(天津)食品添加劑公司;人肝癌細(xì)胞(HepG2) 中國科學(xué)院上海生命科學(xué)研究院細(xì)胞資源中心;胰島素 北京鼎國昌盛生物技術(shù)有限責(zé)任公司;高糖DMEM培養(yǎng)基 美國Hyclone公司;胎牛血清 杭州四季青生物工程材料有限公司;青霉素-鏈霉素混合溶液、Trizol、cDNA合成試劑盒 北京索萊寶生物科技有限公司;四甲基偶氮唑鹽(MTT) 美國Sigma公司;胰蛋白酶 美國Gibco公司;完全培養(yǎng)基組成成分:10%滅火胎牛血清、1%雙抗、0.02%兩性霉素葡萄糖,肝肌糖原測定試劑盒 南京建成生物工程研究院;PCR引物 北京鼎國昌盛生物技術(shù)有限責(zé)任公司合成。
Multiskan FC酶標(biāo)儀、GSORVALL LEGEND MICRO 17R臺式冷凍離心機(jī) 美國Thermo Fisher公司;MCO-15AC CO2培養(yǎng)箱 日本三洋電器公司。
1.2 實(shí)驗(yàn)方法
1.2.1 HepG2細(xì)胞的培養(yǎng) 凍存的HepG2細(xì)胞置于37 ℃恒溫水中,迅速震蕩凍存管,使細(xì)胞凍存液盡快融化,后吸取細(xì)胞懸液置于離心管中。經(jīng)過復(fù)蘇后轉(zhuǎn)入細(xì)胞培養(yǎng)瓶中,加入完全培養(yǎng)基,于37 ℃、5% CO2培養(yǎng)箱中孵育培養(yǎng),每隔24 h換液一次,待細(xì)胞貼壁80%以上時吸棄培養(yǎng)液,用pH7.2~7.4的PBS緩沖溶液清洗2遍,加入1 mL 0.25%的胰蛋白酶消化液均勻鋪滿瓶底消化30~60 s,吸棄消化液,加入4 mL細(xì)胞培養(yǎng)液輕輕吹打得到細(xì)胞懸液,按照1∶4的比例轉(zhuǎn)至新的細(xì)胞培養(yǎng)瓶中培養(yǎng),以完成細(xì)胞的傳代[10]。每48 h進(jìn)行一次傳代操作,選擇處于生長對數(shù)期的細(xì)胞進(jìn)行實(shí)驗(yàn)。
1.2.2 HepG2細(xì)胞胰島素抵抗模型的建立
1.2.2.1 不同濃度胰島素對HepG2細(xì)胞增殖的影響 將處于對數(shù)期(24 h)的細(xì)胞濃度調(diào)至1×105個/mL轉(zhuǎn)移至96孔培養(yǎng)板中,每孔100 μL。待細(xì)胞單層貼壁后棄去培養(yǎng)液,加入不同濃度的胰島素溶液,胰島素濃度分別為1×10-2、1×10-3、1×10-4、1×10-5、1×10-6mmol/L,并設(shè)立正常對照組,每組10個復(fù)孔,培養(yǎng)36 h。向每孔加入20 μL濃度為5 g/L的MTT溶液,培養(yǎng)箱內(nèi)培養(yǎng)4 h后棄去混合溶液,加入150 μL二甲基亞砜溶液充分震蕩10 min,酶標(biāo)儀490 nm波長下掃描并記錄結(jié)果。
1.2.2.2 胰島素最佳作用濃度的確定 將處于對數(shù)生長期(24 h)的細(xì)胞濃度調(diào)至1×105個/mL,之后轉(zhuǎn)移至96孔培養(yǎng)板中培養(yǎng),每孔100 μL。待細(xì)胞單層貼壁后棄去培養(yǎng)液,加入不同濃度的胰島素溶液(胰島素濃度分別為1×10-2、1×10-3、1×10-4、1×10-5、1×10-6mmol/L,并設(shè)立正常對照組,每組10個復(fù)孔)。培養(yǎng)箱內(nèi)培養(yǎng)36 h后棄去培養(yǎng)基,PBS清洗后加入無酚紅DMEM培養(yǎng)液(不含血清)孵育24 h,取出96孔板。用葡萄糖測定試劑盒測定各孔培養(yǎng)基中葡萄糖含量,以無細(xì)胞的空白孔作為對照,計算各組細(xì)胞的葡萄糖消耗量。選擇葡萄糖消耗量差值最大的胰島素作用濃度為胰島素最佳濃度。葡萄糖消耗量計算公式如公式1。
式(1)
式中:5.55為計算常數(shù)。
1.2.2.3 胰島素最佳作用時間的確定 確定胰島素最佳濃度后,重復(fù)上述方法,設(shè)立正常對照組和模型對照組,每組10個復(fù)孔,正常對照組加入正常DMEM 培養(yǎng)液,模型對照組加入含有最佳胰島素濃度的DMEM培養(yǎng)液,分別培養(yǎng)24、36、48 h,測定各組的葡萄糖消耗量,選取模型對照組和正常對照組葡萄糖消耗量出現(xiàn)極顯著性差異的時間為胰島素的最佳作用時間。
1.2.2.4 HepG2細(xì)胞胰島素抵抗模型穩(wěn)定時間的確定 選用上述實(shí)驗(yàn)中胰島素最佳作用濃度和時間來建立HepG2 細(xì)胞胰島素抵抗模型。重復(fù)上述方法,正常對照組和模型對照組處理后換為無酚紅DMEM 培養(yǎng)液,繼續(xù)培養(yǎng)12、24、36 h,用葡萄糖測定試劑盒測定各組的培養(yǎng)液上清液中的葡萄糖含量,并計算各組的葡萄糖消耗量,來判定該胰島素抵抗模型的穩(wěn)定時間。
1.2.3 樣品毒性實(shí)驗(yàn)(MTT實(shí)驗(yàn)) 選擇處于對數(shù)生長期的細(xì)胞進(jìn)行D-松醇和MnSO4毒性實(shí)驗(yàn)。首先將細(xì)胞濃度調(diào)至1×105個/mL并轉(zhuǎn)移至96孔培養(yǎng)板中培養(yǎng),每孔100μL。待細(xì)胞貼壁后吸去培養(yǎng)基,PBS 清洗兩次。加入不同質(zhì)量濃度D-松醇0、10、50、100、200、400、600、800 mg/L)和MnSO4(0、1、5、10、50、100 mg/L),每組設(shè)立10個復(fù)孔,每孔100 μL,培養(yǎng)24 h。向每孔加入20 μL 濃度為5 g/L的MTT溶液,繼續(xù)培養(yǎng)4 h后棄去混合溶液,加入150 μL二甲基亞砜溶液充分震蕩10 min,酶標(biāo)儀490 nm波長下掃描并記錄結(jié)果。評價不同受試樣品的不同濃度對HepG2細(xì)胞增殖的影響。
1.2.4 樣品對胰島素抵抗HepG2細(xì)胞葡萄糖消耗量的影響 選擇處于對數(shù)生長期的細(xì)胞將濃度調(diào)至1×105個/mL并轉(zhuǎn)移至96孔培養(yǎng)板中培養(yǎng),每孔100 μL。按照1.2.2方法建立胰島素抵抗細(xì)胞模型。實(shí)驗(yàn)樣品設(shè)立正常對照組、模型對照組和D-松醇復(fù)配MnSO4不同劑量組(D-松醇濃度為50、100、200 mg/L;MnSO4濃度為1、5、10 mg/L;每組設(shè)10個復(fù)孔)。在樣品處理24 h后采用葡萄糖氧化酶法檢測培養(yǎng)液中葡萄糖含量,以不鋪細(xì)胞的空白孔為空白對照,計算24 h后各組細(xì)胞的葡萄糖消耗量。
1.2.5 糖原含量的測定 選擇處于對數(shù)生長期的細(xì)胞將濃度調(diào)至1×105個/mL并轉(zhuǎn)移至6孔培養(yǎng)板中培養(yǎng),每孔2 mL。按照1.2.2方法建立胰島素抵抗細(xì)胞模型。實(shí)驗(yàn)樣品設(shè)立正常對照組、模型對照組和D-松醇復(fù)配MnSO4不同劑量組(D-松醇濃度為50、100、200 mg/L;MnSO4濃度為1、5、10 mg/L;每組設(shè)2個復(fù)孔)。在樣品處理24 h后采用硫酸蒽酮法檢測細(xì)胞中糖原含量,以不鋪細(xì)胞的空白孔為空白對照,計算24 h后各組細(xì)胞的糖原含量。公式如式2。
糖原含量(mg)=×M×A×10/1.11
式(2)
式中:10:測試過程中的稀釋倍數(shù);1.11:此法獲得的葡萄糖含量換算成糖原含量的系數(shù);M:標(biāo)準(zhǔn)管含量(mg);A:樣品測試前稀釋倍數(shù)。
1.2.6 實(shí)時熒光全定量分析(RT-PCR)實(shí)驗(yàn) 用PBS將細(xì)胞收集后采用Trizol法提取細(xì)胞RNA,反轉(zhuǎn)錄得到cDNA,再利用Real-time PCR法以GADPH為看家基因,檢測各劑量組IRS-1、IRS-2、AMPKα-1、AMPKα-2、PGC-1α、PEPCK、G6Pase、GLUT4基因mRNA表達(dá)水平。PCR引物設(shè)計如表1所示,實(shí)驗(yàn)分組如表2所示。

表1 全定量PCR引物設(shè)計序列Table 1 Real-time PCR primer design sequences

表2 實(shí)驗(yàn)設(shè)計方案Table 2 Experimental design for grouping rats
1.3 數(shù)據(jù)處理
本實(shí)驗(yàn)所得數(shù)據(jù)均采用數(shù)理統(tǒng)計軟件進(jìn)行統(tǒng)計學(xué)分析,實(shí)驗(yàn)數(shù)據(jù)以“均值±標(biāo)準(zhǔn)偏差”(M±SD)表示,采用Duncans進(jìn)行多重比較檢驗(yàn)。組間分析采用t檢驗(yàn),p<0.05表示兩組之間具有顯著性差異,p<0.01表示兩組之間具有極顯著性差異。
2 結(jié)果與分析
2.1 HepG2細(xì)胞胰島素抵抗模型建立
胰島素誘導(dǎo)HepG2細(xì)胞建立胰島素抵抗模型,結(jié)果如圖1所示。由圖1A可知,各實(shí)驗(yàn)濃度胰島素對HepG2細(xì)胞的正常增殖無影響。故選用此系列實(shí)驗(yàn)濃度進(jìn)行葡萄糖消耗量試驗(yàn),由圖1B可知,與正常對照組相比,當(dāng)胰島素濃度為1×10-3mmol/L時,細(xì)胞培養(yǎng)液中的葡萄糖消耗量極顯著性降低(p<0.01),說明細(xì)胞產(chǎn)生顯著的胰島素抵抗現(xiàn)象,故建造HepG2細(xì)胞胰島素抵抗模型時選用胰島素的作用濃度為1×10-3mmol/L。
由圖1C可知,與正常對照組相比,當(dāng)胰島素作用時間為24 h時,胰島素樣品組葡萄糖消耗量顯著性降低(p<0.05),且在36 h時極顯著性降低(p<0.01),說明細(xì)胞產(chǎn)生明顯的胰島素抵抗現(xiàn)象,故選取36 h為建造HepG2細(xì)胞胰島素抵抗模型的最佳作用時間。
本實(shí)驗(yàn)在建立胰島素抵抗模型基礎(chǔ)上,對該模型的作用穩(wěn)定時間進(jìn)行了研究,采用1×10-3mmol/L濃度的胰島素處理細(xì)胞36 h后,換成無酚紅DMEM高糖培養(yǎng)基,分別于12、24、36 h后檢測上清液中葡萄糖消耗量。結(jié)果如圖1D所示,與正常對照組相比,12 h后上清液中葡萄糖消耗量出現(xiàn)顯著性降低(p<0.05),24 h和36 h出現(xiàn)極顯著性降低(p<0.01),說明該胰島素抵抗模型在建模成功后36 h內(nèi)穩(wěn)定。
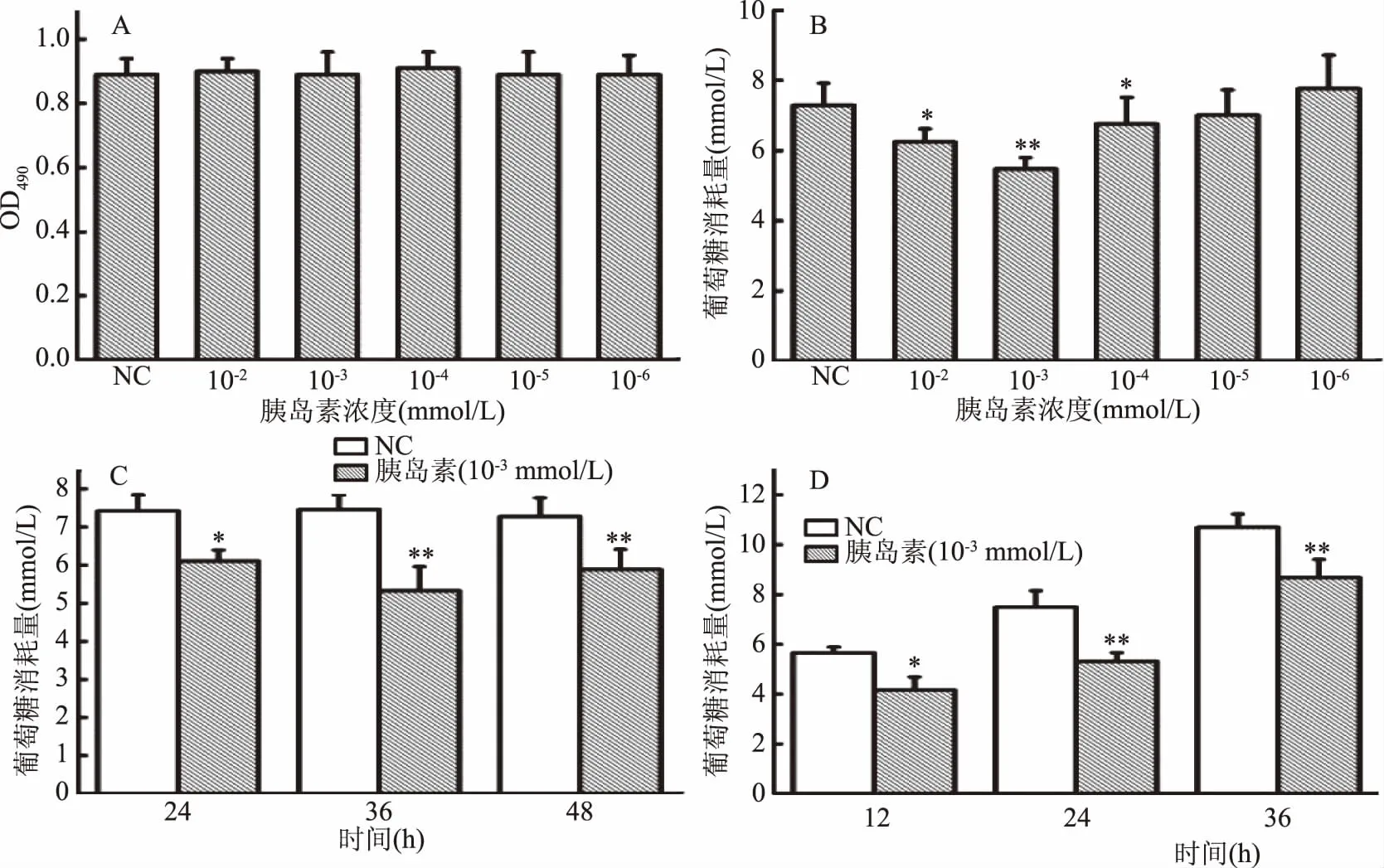
圖1 HepG2細(xì)胞胰島素抵抗模型實(shí)驗(yàn)結(jié)果Fig.1 Results of insulin resistance in HepG2 cells注:NC:正常對照組;*:p<0.05,與正常對照組比較具有顯著性差異; **:p<0.01,與正常對照組比較具有極顯著性差異;圖2同。
2.2 受試樣品對HepG2細(xì)胞增殖的影響
D-松醇和MnSO4對HepG2細(xì)胞增殖的影響如圖2所示。由圖2A可知,D-松醇濃度在0~400 mg/L范圍內(nèi),各組在490 nm波長下的吸光度值無差異;濃度在600~800 mg/L范圍內(nèi),各組的吸光度值略有升高,但無顯著性差異。說明D-松醇在該濃度范圍內(nèi)對HepG2細(xì)胞的正常增殖無顯著性影響,故后續(xù)實(shí)驗(yàn)所選用的D-松醇濃度在0~400 mg/L范圍內(nèi)。由圖2B可知,MnSO4濃度在0~10 mg/L范圍內(nèi),各組在490 nm波長下的吸光度值無顯著性差異;濃度在50~100 mg/L范圍內(nèi),各組的吸光度值極顯著性降低(p<0.01)。說明MnSO4在0~10 mg/L濃度范圍內(nèi)對HepG2細(xì)胞的正常增值無顯著性影響,在50~100 mg/L濃度范圍時,抑制細(xì)胞正常增殖,故后續(xù)實(shí)驗(yàn)所選用的MnSO4濃度在0~10 mg/L范圍內(nèi)。
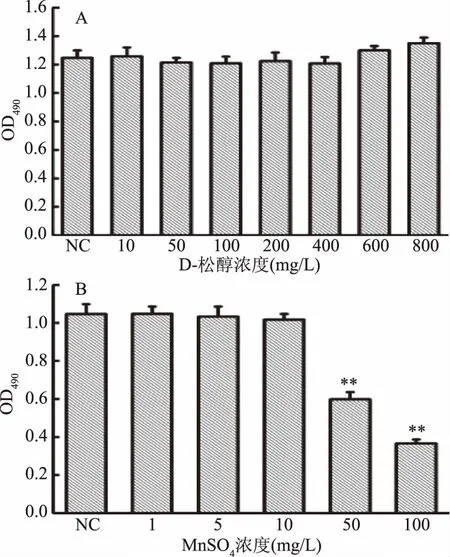
圖2 D-松醇和MnSO4對HepG2細(xì)胞增殖的影響Fig.2 Effect of D-pinitol and MnSO4 on proliferation of HepG2 cells
2.3 受試樣品對HepG2細(xì)胞葡萄糖消耗量的影響
D-松醇和復(fù)配MnSO4對HepG2細(xì)胞葡萄糖消耗量的影響如圖3所示。由圖3A可知,和正常對照組相比,模型對照組的葡萄糖消耗量極顯著降低(p<0.01),說明造模成功,細(xì)胞產(chǎn)生胰島素抵抗。和模型對照組相比,當(dāng)D-松醇濃度為100~200 mg/L時,葡萄糖消耗量有升高趨勢,但無顯著性差異,而D-松醇濃度為400 mg/L時,葡萄糖消耗量極顯著升高(p<0.01)。由圖3B可知,和正常對照組相比,模型對照組的葡萄糖消耗量極顯著降低(p<0.01),說明造模成功,細(xì)胞產(chǎn)生胰島素抵抗。和模型對照組相比,當(dāng)D-松醇濃度為100 mg/L時,復(fù)配MnSO4濃度為5 mg/L時,葡萄糖消耗量顯著性升高(p<0.05),MnSO4濃度為10 mg/L時,葡萄糖消耗量極顯著性升高(p<0.01)。
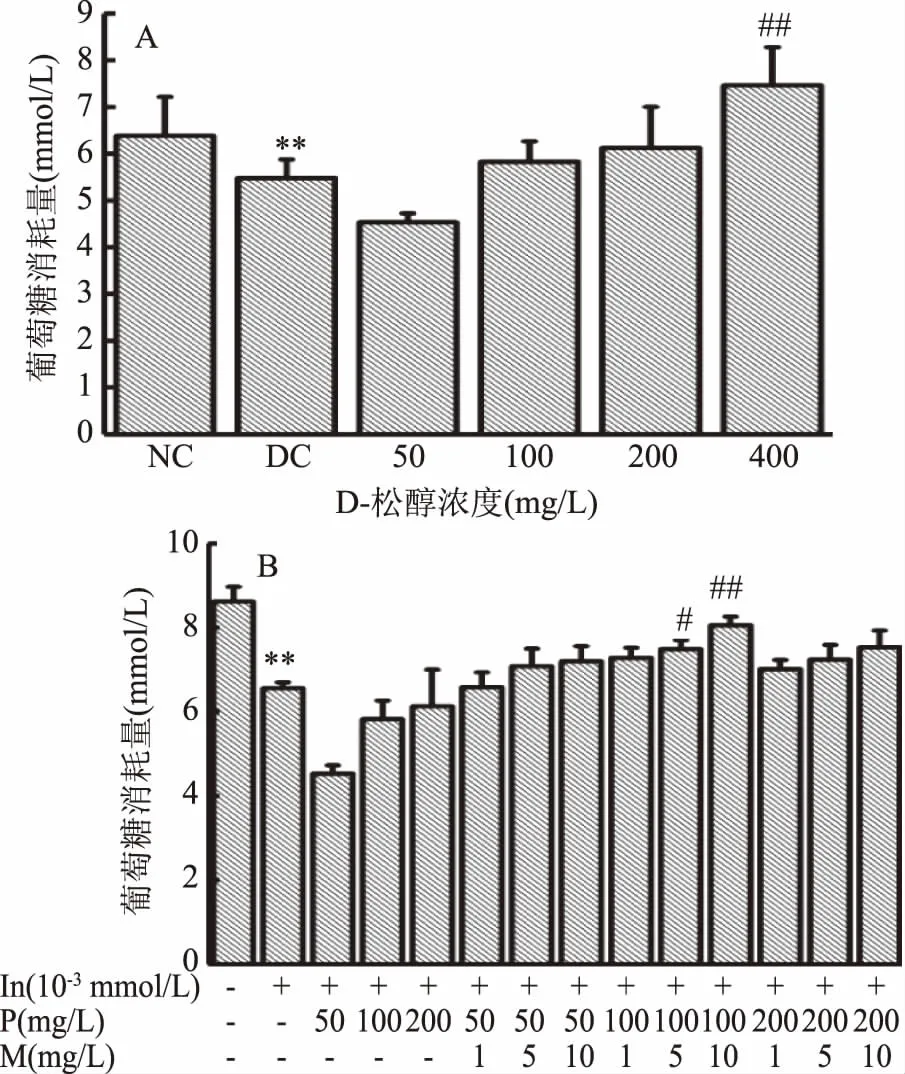
圖3 D-松醇和復(fù)配MnSO4對HepG2細(xì)胞葡萄糖消耗量的影響Fig.3 Effects of D-pinitol and compound with MnSO4 on glucose consumption of HepG2 cells注:#:p<0.01,劑量組與模型對照組比較具有顯著性差異; ##:p<0.01,劑量組與模型對照組比較具有極顯著性差異; NC:正常對照組;DC:模型對照組;圖4~圖5同。
2.4 受試樣品對HepG2細(xì)胞糖原含量的影響
D-松醇和復(fù)配MnSO4對HepG2細(xì)胞糖原含量的影響如圖4所示。由圖4A可知,與正常對照組相比,模型對照組糖原含量極顯著性降低(p<0.01),說明細(xì)胞合成糖原能力下降,細(xì)胞造模成功。與模型對照組相比,當(dāng)D-松醇濃度為50~200 mg/L時,糖原含量有升高趨勢,但無顯著性差異,而D-松醇濃度為400 mg/L時,糖原含量極顯著升高(p<0.01)。由圖4B可知,與正常對照組相比,模型對照組糖原含量極顯著性降低(p<0.01),說明細(xì)胞合成糖原能力下降,細(xì)胞造模成功。和模型對照組相比,當(dāng)D-松醇濃度為100 mg/L時,復(fù)配MnSO4濃度為5 mg/L時,糖原含量顯著性升高(p<0.05),MnSO4濃度為10 mg/L時,糖原極顯著性升高(p<0.01)。
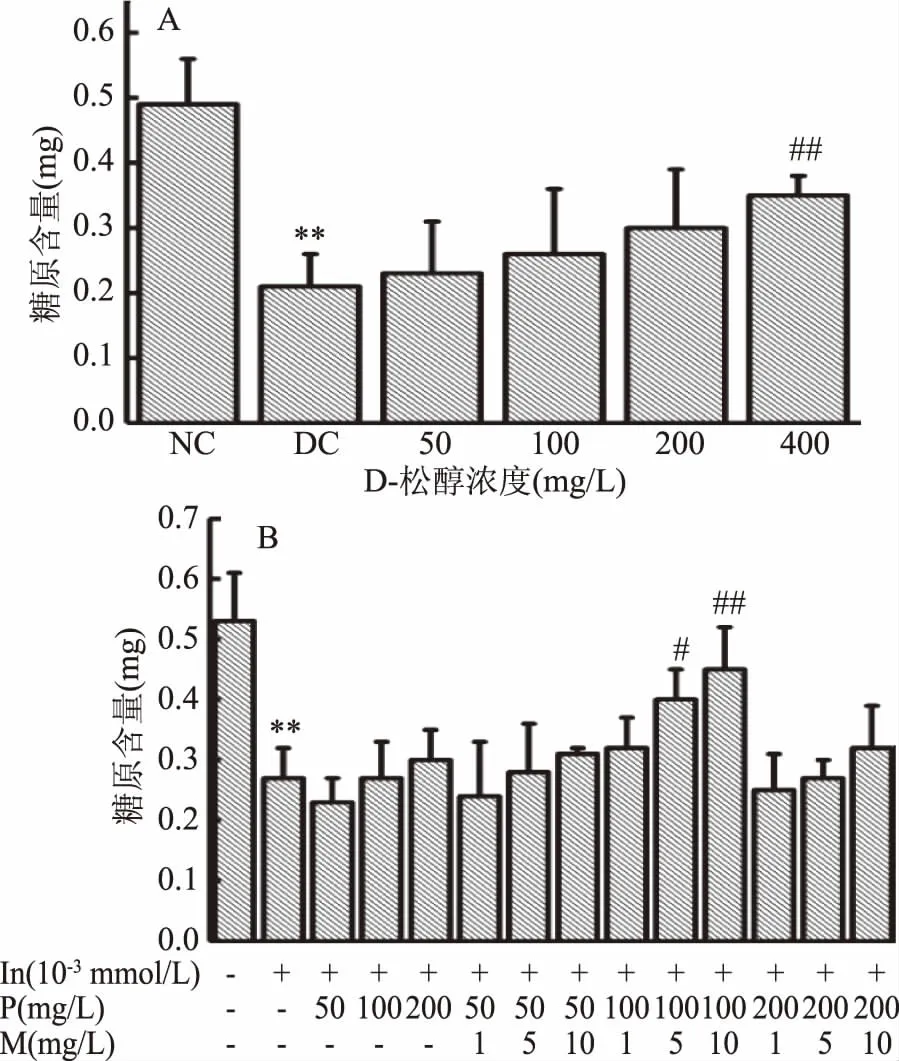
圖4 D-松醇和復(fù)配MnSO4對HepG2細(xì)胞糖原含量的影響Fig.4 Effects of D-pinitol and compound with MnSO4 on glycogen content of HepG2 cells
2.5 受試樣品對HepG2細(xì)胞相關(guān)基因表達(dá)的影響
如圖5,與模型組相比,DP組各基因mRNA表達(dá)水平均未出現(xiàn)顯著性變化;LPM組AMPKα-1、AMPKα-2和GLUT4基因mRNA表達(dá)水平顯著上調(diào)(p<0.05),G6Pase基因mRNA表達(dá)水平顯著下調(diào)(p<0.05);MPM組ISI-1、ISI-2、AMPKα-2和GLUT4基因mRNA表達(dá)水平顯著上調(diào)(p<0.05),AMPKα-1基因mRNA表達(dá)水平極顯著上調(diào)(p<0.01),同時,PEPCK基因mRNA表達(dá)水平顯著下調(diào)(p<0.05),G6Pase基因mRNA表達(dá)水平極顯著下調(diào)(p<0.01);HPM組ISI-1、ISI-2、AMPKα-1、AMPKα-2和GLUT4基因mRNA表達(dá)水平極顯著上調(diào)(p<0.01),PGC-1α和PEPCK基因mRNA表達(dá)水平顯著性下調(diào)(p<0.05),G6Pase基因mRNA表達(dá)水平極顯著下調(diào)(p<0.01)。D-松醇復(fù)配Mn2+可激活I(lǐng)RS-1和IRS-2基因,促進(jìn)下游基因的表達(dá);激活A(yù)MPKα-1和AMPKα-2基因的磷酸化,促進(jìn)糖酵解的發(fā)生;激活PGC-1α基因的磷酸化,降低激活糖異生關(guān)鍵酶造成肝糖輸出的增加,進(jìn)而改善胰島素抵抗;激活PEPCK基因的磷酸化,進(jìn)而促進(jìn)糖異生;激活G6Pase基因的磷酸化,進(jìn)而促進(jìn)下游基因的表達(dá),促進(jìn)糖原分解;激活GLUT4基因的磷酸化,進(jìn)而促進(jìn)下游基因的表達(dá),促進(jìn)葡萄糖轉(zhuǎn)運(yùn)。
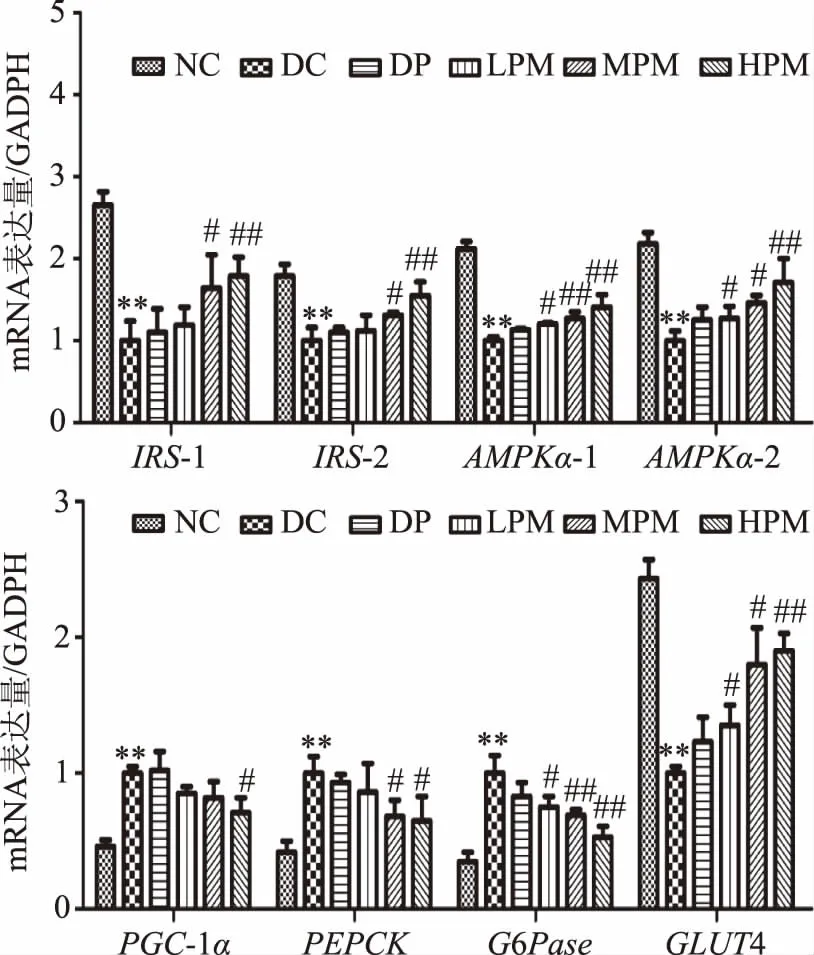
圖5 受試樣品對HepG2細(xì)胞相關(guān)基因mRNA表達(dá)水平的影響Fig.5 Effects of fermented beverage on the concentration of AMPK in gene level in HepG2 cells
3 結(jié)論
本實(shí)驗(yàn)采用胰島素誘導(dǎo)HepG2細(xì)胞,對胰島素作用濃度、作用時間和模型穩(wěn)定時間進(jìn)行研究,建立體外胰島素抵抗模型。在胰島素濃度為1×10-3mmol/L,作用時間為36 h時,細(xì)胞葡萄糖消耗量達(dá)到最低,產(chǎn)生最大的胰島素抵抗效應(yīng)。此時,進(jìn)行D-松醇和復(fù)配MnSO4對HepG2細(xì)胞胰島素抵抗影響的研究,結(jié)果表明,當(dāng)D-松醇濃度為100 mg/L,復(fù)配MnSO4為10 mg/L時,可極顯著的緩解胰島素抵抗。此外,復(fù)配組AMPKα-1、AMPKα-2和GLUT4基因表達(dá)水平均顯著上調(diào)(p<0.05),G6Pase基因mRNA表達(dá)水平顯著下調(diào)(p<0.05)。AMPK對糖代謝具有廣泛的影響,在促進(jìn)葡萄糖轉(zhuǎn)運(yùn),加強(qiáng)糖酵解以及抑制糖異生等生化反應(yīng)中均發(fā)揮一定功能。
本實(shí)驗(yàn)結(jié)果為D-松醇復(fù)配Mn2+緩解HepG2細(xì)胞胰島素抵抗提供科學(xué)依據(jù),但本研究只局限于生理表層和基因表達(dá)方面,將來更需要通過蛋白質(zhì)組學(xué)和代謝組學(xué)等實(shí)驗(yàn)對降血糖機(jī)制進(jìn)一步評價分析,為D-松醇在食品工業(yè)中的研究開發(fā)提供進(jìn)一步的理論幫助。

