釀造酒中氨基甲酸乙酯的研究進展
林宜錦,歐夢瑩,關統偉,*,張習超,尚治豪,李 東,張家旭,趙小林
(1.西華大學微生物研究所,西華大學食品與生物工程學院,四川成都 610039;2.成都蜀之源酒業有限公司,四川成都 611335)
氨基甲酸乙酯(Ethyl Carbamate,EC)又名尿烷,具有一定的抑菌和抗腫瘤活性,在20世紀初期曾被廣泛地應用于醫藥領域[1]。然而,EC在1943年被發現有致癌作用[2],并在隨后的小鼠、大鼠、倉鼠及猴子等哺乳動物試驗中被證實[3]。EC對哺乳動物的多位點致癌作用引起了人們的高度重視。1974年,國際癌癥研究機構(International Agency for Research on Cancer,IARC)將EC列為了2B類致癌物質[4]。此后,又有證據表明EC能夠直接導致人類產生肝癌[5],EC的致癌等級因此被提升至2A類[6]。期間,分子生物學技術的發展讓EC的致癌機制得到了初步解析。在嚙齒動物體內代謝中,EC通過細胞色素P450轉化為N-羥基-氨基甲酸乙酯(約占0.1%)和乙烯基-氨基甲酸乙酯(約占0.5%),前者被代謝產生的活性氧簇(ROS)物質可導致Cu2+調控下的DNA損傷,這種損傷多發生于胸腺嘧啶(T)和胞嘧啶(C)的殘基上;乙烯基-氨基甲酸乙酯則經過轉化加聚物與DNA共價結合而導致細胞癌變[7-8]。近年來,基于公認的動物模型,對EC的致癌作用有了更深入的了解,轉錄因子STAT3、NF-kB[9-11]及細胞外信號蛋白激酶(ERK)[12]等被證明參與EC誘導的腫瘤的發展。另一方面,EC的毒理學研究也開始轉向人體組織或細胞模型。有研究表明,EC可以通過多種途徑誘導人體肝癌細胞(HepG2)死亡,包括誘導氧化應激、降低解毒能力、消耗能量、破壞膜完整性、破壞DNA和蛋白質等[13-14]。隨著相關研究的進行,EC的安全性可能被重新評估。
由于EC在發酵食品和釀造酒中普遍存在,人體通過日常飲食攝入EC不可避免[15]。根據FAO/WHO食品添加劑聯合委員會(JECFA)的數據,人體通過釀造酒攝入EC的平均含量為65 ng·kg-1·d-1,是其他發酵食品和飲品攝入總量的近五倍[16]。有研究表明EC在肝臟清除上可能與乙醇存在復雜的交互作用,不排除乙醇和EC之間具有協同致癌作用[17]。基于上述原因,EC被列為了重點監控對象,加拿大、日本、巴西及歐盟部分國家相繼制定了其在釀造酒中的限量標準[18]。在另一方面,科學家們深入探索了EC在釀造酒中的形成機制,確定了EC及其前體物質的來源與轉化關系,為發展EC的控制措施奠定了理論基礎。目前,物理化學、酶學及代謝工程等手段已經應用于釀造酒生產的各個階段以控制EC的含量。但鑒于中國尚未建立國家標準對釀造酒中的EC污染進行指導和管控,繼續深入針對EC的風險評估、形成機制和控制策略的研究對保障飲酒人群的健康具有重要意義。
1 釀造酒中的EC污染及其風險評估
1.1 釀造酒中EC的污染水平
中國釀造酒的種類繁雜,EC污染在不同酒類的酒精飲料之間存在較大的水平差異(表1)[19-23],參考加拿大制定的EC在釀造酒中的限量標準(葡萄酒30 μg/L,蒸餾酒150 μg/L,水果白蘭地400 μg/L,清酒200 μg/L),多數啤酒中的EC含量處在檢測限以下,葡萄酒中EC的含量一般低于或接近限值,而很多白酒和黃酒中的EC含量顯著高于限值。2015年,衛生部食品安全風險評估中心對我國各地區的890個黃酒樣品進行檢測分析。結果顯示,黃酒中EC的污染水平在6.3~775.8 μg/L(平均為232.9 μg/L),高于烈酒和清酒的限值[23]。另一項針對白酒的檢測中,有48.7%的樣品中EC的含量高于蒸餾酒中EC的限值(150 μg/L)[24]。
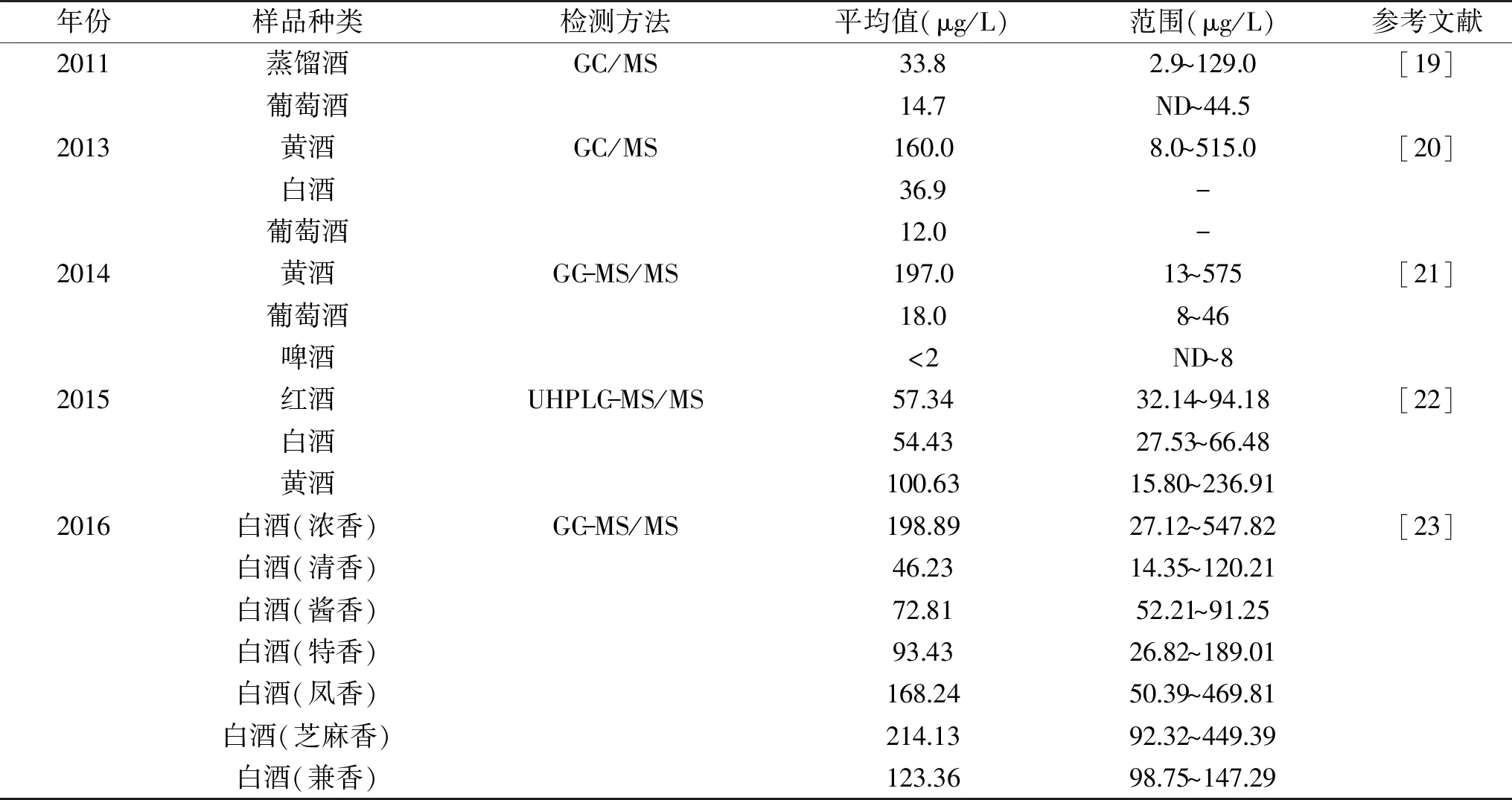
表1 部分酒精飲料中氨基甲酸乙酯含量
此外,EC含量在同類釀造酒中的檢測結果也有明顯的差異,特別是白酒的酒型眾多,EC含量在不同香型(工藝)的白酒中有顯著的差異。不同的檢測方法如氣相色譜-質譜(GC-MS)和高效液相色譜-熒光檢測(HPLC-FLD)對檢測結果也有一定的影響,一般使用HPLC-FLD方法檢測白酒時需要適當調整樣品的酒精度以減少EC峰面積上的誤差[25]。另外,黃酒的陳貯時間會顯著影響EC的檢測結果[26]。
1.2 釀造酒中EC的風險評估
目前,膳食EC的攝入風險主要通過歐洲食品安全委員會(EFSA)推薦的暴露邊界比(Margin of Exposure,MOE)進行評估,即基準劑量下限值(BMDL)與人群膳食暴露量的比值。一般認為MOE值等于10000是公共衛生風險的閾值,MOE值越小表示致癌風險越大,當該值小于3800則需要考慮采取干預措施[26]。由于黃酒和白酒中的EC含量偏高,同時在消費水平上存在明顯的區域和個體差異,它們對飲酒人群的健康威脅要高于普通人群,是風險評估關注的重點。根據第四次和第五次全國總膳食研究(TDS)的數據,2009年人均每日膳食EC攝入估量為8.27 ng/kg BW,高消費人群(P97.5)為45.67 ng/kg BW,低于JECFA建議的每日攝入限值(EDI)80 ng/kg BW,表明中國成年人對EC暴露的風險較低。但是在黃酒消費省份,普通與高消費人群每日黃酒EC的攝入估量分別為290.6和1848.4 ng/kg BW,遠高于EDI限值。結合0.3 mg/kg BW的BMDL10值,黃酒EC攝入量的中位數和高消費人群(P97.5)的MOE值分別為3246和162,具有較高的暴露風險[24]。另據國家食品安全風險評估中心對白酒EC攝入的風險評估顯示,居民人均每日白酒EC攝入估量為8.09 ng/kg BW,MOE值為37083。白酒飲用人群的人均每日白酒EC攝入估量為159.99 ng/kg BW,MOE值為1875,同樣具有較高的暴露風險[27]。
暴露邊界比用于評估EC的暴露風險仍有不足之處。一方面,釀造中還有其他已知或未知的致癌物質,定量分析的方法不能排除酒精和其他致癌物質的交互作用[26]。另一方面,基準劑量下限值是由動物實驗得到,與人體內的毒代作用有較大的差異,特別是在肺泡和小支氣管腫瘤的發生上[28]。而由種族、性別、年齡、遺傳、病史、環境、運動及吸煙狀態等因素引起的人類個體變異更加難以區分,因此從動物外推到一般人群或特定人群(敏感人群)時就存在很大不確定性[29-30]。盡管如此,保守的評估標準對于公共衛生安全是十分必要的。鑒于目前黃酒和白酒中的EC暴露風險顯著高于國內其他酒類,減少飲酒并控制黃酒和白酒中的EC含量就顯得尤為重要。
2 釀造酒中氨基甲酸乙酯的形成機制
2.1 EC的前體物質與生成反應
EC的形成和發酵微生物息息有關,其主要前體物質,尿素、瓜氨酸與氨甲酰磷酸均由微生物積累,氰化物和焦磷酸二乙酯則由原料帶入并經酶促反應生成[18]。這些前體物質在不同釀造酒中對形成EC的貢獻程度有所差異,這取決于發酵微生物的組成體系及其協同代謝過程。
2.1.1 尿素與乙醇反應 在多數釀造中,尿素是形成EC最重要的前體物質之一。尿素由微生物經尿素循環途徑生成,并可被進一步分解為氨和二氧化碳。但是微生物對尿素的利用受到氮分解代謝產物抑制(Nitrogen Catabolite Repression,NCR)的調控。在NCR的多級調控中,Gln3p是最多的GATA型調控因子,受到TOR(Target of rapamycin)信號的控制。當環境中存在優選氮源(谷氨酰胺或天冬氨酸),TORC1通過調控Tap42p介導的Sit4p磷酸化酶使Gln3p磷酸化,與阻遏蛋白Ure2p結合形成Gln3p-Ure2p復合體而被留在細胞質中。只有當細胞缺乏氮營養或用雷帕霉素(其受體是TOR蛋白)處理時,Gln3p才能轉位到細胞核中,激活參與非優選氮源利用和轉運的基因的表達[31-32]。尿素因NCR調控在細胞中大量積累,最終被釋放到周圍介質中與乙醇反應生成EC。大量研究表明,酵母是尿素產生的主要貢獻者,如醬香型白酒與黃酒中的釀酒酵母(Saccharomycescerevisiae)[33]、清香型白酒的異常威克漢遜酵母(Wickerhamomycesanomalus)[34]等。
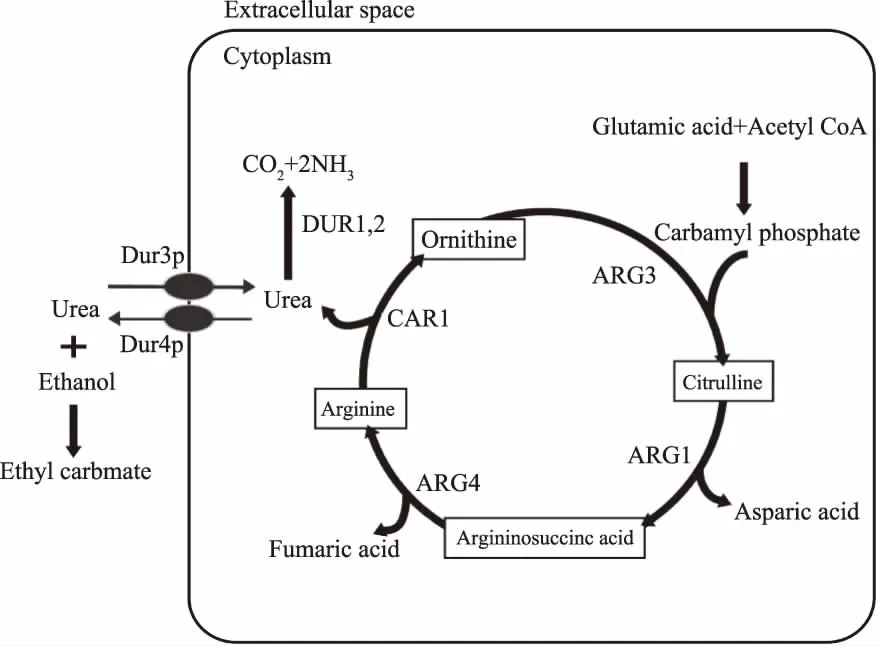
圖1 尿素生成和轉運途徑[35]
2.1.2 瓜氨酸與乙醇反應 瓜氨酸是形成EC的另一種主要前體物質,特別在葡萄酒及其他果酒之中。瓜氨酸主要由以乳酸菌(Lactic acid bacteria,LAB)為主的細菌通過精氨酸脫亞氨酶途徑(Arginine deiminase pathway,ADI)生成[36]。雖然瓜氨酸也是尿素循環的產物之一,但在一株敲除ARG3(編碼鳥氨酸轉氨基酶,OTC)阻斷尿素循環的工程菌中,其產量未見明顯減少,說明這是一條次要途徑[37]。另外,瓜氨酸向精氨琥珀酸的轉化受到pH、氧脅迫和鹽濃度等環境因素的限制,這些因素共同造成了瓜氨酸的積累[38-39]。
2.1.3 氨甲酰磷酸與乙醇反應 氨甲酰磷酸主要通過酵母中氨甲酰磷酸合酶和細菌精氨酸脫亞氨基途徑產生,但一般不被釋放到細胞外,因此大多數情況下被忽略。
2.1.4 其他前體物質與乙醇反應 原料中生氰糖苷酶促(β-葡萄糖苷鍵)分解或高溫裂解生成的氰化物被認為是谷物蒸餾酒中重要的EC前體物質。氰化物在發酵過程中會進一步氧化形成氰酸鹽[40],后者在光照、氧氣或Cu2+催化下與乙醇生成EC[41]。焦磷酸二乙酯曾作為食品添加劑來抑制有害微生物的生長,它可以與RNA酶活性基團中組氨酸的咪唑環反應而抑制RNA酶的活性,也可以與NH3反應生成EC[42],目前,焦磷酸二乙酯在葡萄酒釀造過程中已經很少使用。
2.2 影響EC生成的環境因素
溫度、pH及Cu2+等是EC生成的重要響應因素。如在黃酒的煎酒和貯存過程中,EC含量與溫度在一定范圍內呈現顯著的正相關,與尿素則是負相關[43]。其機理是,在酸性體系中,高溫促使尿素分解產生氰酸鹽和異氰酸鹽,加快與乙醇反應生成EC[44]。瓜氨酸在白酒蒸餾中也有類似的過程[18]。此外,pH對LAB的蘋果酸-乳酸發酵(Malolactic fermentation,MLF)途徑有重要影響,較低的pH可以抑制一些菌株通過MLF途徑利用精氨酸[45]。Cu2+是細胞色素氧化酶的重要輔基[46],也是氰酸鹽向EC轉化的重要催化劑[41]。在高濃度下,Cu2+還可以催化Fenton反應或與硫醇基團結合產生-OH,脅迫酵母細胞的生長[46]。在釀酒原料中,堿式硫酸銅類殺菌劑殘留是Cu2+的主要來源,如波爾多液[CuSO4+Ca(OH)2]被廣泛施用在葡萄園中,用于防治霜毒病等葡萄病害[46]。
3 控制EC水平的技術方法
EC及其前體物質形成機制的確定為控制EC的含量提供了基礎,得到了許多能夠有效降低釀造酒中EC水平的方法,可大致分為改進生產工藝、酶降解和代謝工程三個技術路線。
3.1 改進生產工藝路徑
改進生產工藝可以結合原料處理、發酵工藝優化和下游分離等方面進行綜合調控。在原料上,通過精制處理或蒸汽清洗去除EC前體物質是常見的方法,其次還可以在原料使用添加催化劑用以催化EC前體物質分解,如氰化物催化劑和銅離子催化劑[47]等。但這些精煉手段很可能會造成營養和風味成分的流失以及銅離子造成的殘留和環境污染等問題,因此多作為輔助手段。
EC在釀造過程中的生成受到諸多因素的影響,適當地改進釀造條件可以在一定程度上控制EC的生成。一些添加劑,如沒食子酸和原兒茶酸[48]以及磷酸二銨[49]等可以在一定程度上抑制EC的生成。另外,溫度調整是控制EC形成的重要手段,在煎酒時采用快速降溫或者低溫貯存(4 ℃)的方式可以顯著降低黃酒中的EC水平[43]。而二次蒸餾[50]、高回流比蒸餾和低溫發酵[51]等方式均可以達到控制EC的理想效果。
在釀造酒生產的下游,活性炭或其他特異性吸附材料可被用于去除酒體中的EC,其關鍵在于要減少對其他風味物質的影響,Park等[52]用活性炭過濾去除了烈酒中45%~47%的EC。進一步探索EC的特異性吸附材料是發展EC控制手段的趨勢之一。
3.2 酶降解路徑
3.2.1 脲酶 通過直接在釀造酒中添加脲酶(urease)將尿素降解成氨和二氧化碳是控制EC簡單而有效的方法,篩選能夠生產耐酸和耐乙醇脲酶的菌株曾經一度成為熱門課題。1979年,Suzuki等[53]在小鼠腸道中分離得到了產酸性脲酶的發酵乳桿菌(Lactobacillusfermentum),其生產的脲酶最適pH為4.0,可在15 ℃條件下兩天內將日本清酒中的尿素降至無法檢測的水平(1 ppm)(30 ℃下為15 h)。此后,其他一些具有酸性脲酶生產能力的細菌陸續被篩選出來,如運動節桿菌(Arthrobactermobilis)、腸桿菌屬(Enterobactersp.)等[54]。到20世紀90年代后,酸性脲酶已被應用于實際生產,但是受限于酸性脲酶的活性和產量,該方法的成本還未能得到控制。2006年,Fidaleo等[55]建立了葡萄酒中脲酶降解尿素的擬一級動力學模型,并指出了蘋果酸和pH是其中最重要的可控變量[56]。最近,有研究將羅伊乳桿菌(Lactobacillusreuteri)CICC6124中的酸性脲酶基因簇轉移到乳酸乳球菌(Lactococcuslactis)內構建細胞工廠,在優化條件后,脲酶的產量從1550 U/L提高到了11560 U/L,極大地擴展了脲酶的應用前景[57]。
3.2.2 氨基甲酸酯酶 氨基甲酸酯酶(Urethanase)是能將EC直接分解成乙醇和氨的酰胺類酶。1990年,Kobashi等[58]在小鼠糞便中分離得到了一株檸檬酸桿菌具有生產該酶的能力,但是該菌產生的氨基甲酸酯酶在高濃度乙醇和酸性條件下沒有活性,不能用于實際應用。隨后發現的一些具有乙醇和酸性環境抗性的氨基甲酸酯酶在其他菌株中被發現,但仍受限于酶的降解活性[59-60]。這個問題直到研究人員在大腸桿菌(Escherichiacoli)中表達外源基因才最終得以解決[44]。另一方面,通過固定化(藻酸鈣/殼聚糖)很大程度地提高了產酶菌株對脅迫環境的抗性,提高了降解效率[61]。
3.3 代謝工程路徑
該方法是對發酵微生物的代謝路徑進行人為改造,減少其代謝終產物中尿素的含量,進而控制EC的水平。目前,有兩種代謝調控方法被廣泛應用。
3.3.1 尿素生成與代謝調節 在釀酒酵母中,尿素由精氨酸通過精氨酸酶(由CAR1編碼)分解精氨酸產生,降低精氨酸酶基因的表達水平可以減少尿素生成(圖2)。1990年,Suizu等[62]首先在單倍體酵母菌株中敲除CAR1而使其喪失了精氨酸酶表達能力,該菌的生長和發酵水平和野生型相比沒有明顯差別,具有工業化應用的潛力。在此基礎上,精氨酸酶缺陷的二倍體純合子(car1/car1)酵母[63-65]也被成功構建。除了基因工程手段外,乙基甲磺酸酯(Ethyl Methanesulfonate,EMS)也作為誘變劑用于獲得car1突變體,經過誘變得到的突變體菌株也能達到類似效果[66]。此外,反義RNA和RNA干擾技術也逐漸被用于抑制釀酒酵母CAR1的表達[67]。在野生型酵母(CAR1/CAR1)的污染問題上,編碼蛋白毒素和抗體的dsRNA質粒已被開發用于殺死野生型[68]。
目前,釀酒酵母精氨酸酶表達活性的缺失尚不能完全阻斷尿素和EC的產生,而精氨酸在發酵液中大量積累則會引起流體動力學和酒體風味的變化。為了緩解這一矛盾,研究人員進一步提出通過基因工程手段讓酵母細胞增強對尿素的代謝分解作用。該方法共涉及三個基因的改造,其中DUR1,2(編碼尿素酰胺酶)與尿素的轉運和代謝有關,DUR3(編碼尿素轉運蛋白)與尿素的跨膜運輸有關(圖2)。2006年,Coulon等[69]將DUR1,2通過釀酒酵母PGK1表達系統整合到了工業葡萄酒酵母(UC Davis 522)UPA3基因座中,獲得了基因型、表型和轉錄組幾乎等同于親本的工程菌,使葡萄酒中的EC含量降低了89.1%。該方法也在成功應用于清酒中[70]。進一步地,李曉明等[71]在釀酒酵母N85中過量表達DUR1,2(N85DUR1,2)的基礎上敲除CAR1構建了工程菌N85DUR1,2-c,讓EC的控制效果得到進一步提升。在另一方面,DUR3的過量表達能夠促進非尿素降解型酵母從胞外重新吸收尿素,同樣達到降低發酵環境中尿素含量的目的[72-73]。
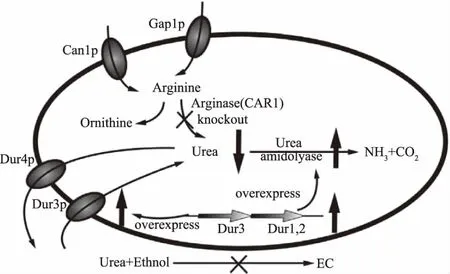
圖2 兩種代謝工程技術抑制尿素的積累[43]
除了轉錄水平調節外,Dur3p的泛素化修飾對尿素轉運也有顯著影響,張鵬等[35]通過定點突變將釀酒酵母Dur3p中兩個潛在的泛素化位點——賴氨酸殘基K556和K571突變為精氨酸作為替代。相對于Dur3p,突變菌Dur3pK556R在添加尿素和谷氨酰胺的YNB培養基中泛素化水平相對降低了20.1%,對應的,尿素和EC含量在黃酒模擬發酵中分別降低了41.3%和55.4%。
3.3.2 NCR調節 如前文所述,尿素的分解代謝受到NCR的限制,抑制NCR正調控因子(Gln3p和Gln1p)核定位信號(Nuclear Location Sequence,NLS)的中磷酸化和負調控因子Ure2p的表達,可使優質氮源對酵母DUR1,2和DUR3的表達抑制降至最低。趙新睿等[74]通過突變釀酒酵母中NLS的磷酸化位點并敲除了URE2基因,讓釀酒酵母中DUR1,2和DUR3的表達得到顯著激活。
代謝工程方法對控制葡萄酒、清酒及黃酒中的EC含量有很大助益,但并不適用于發酵體系異常復雜的酒類,如白酒。不過,有新的研究發現白酒發酵過程的乳桿菌能夠通過ADI途徑與酵母競爭性地降解精氨酸[75-76],一些芽孢桿菌已被開發用于控制白酒發酵中的EC產生。
4 總結與展望
目前,已有大量的調查研究表明人類的全因死亡率與酒精攝入量密切相關。盡管釀造酒中的乙醛是引起癌癥的主要物質,在對EC致癌風險的評估中也無法排除其與EC的交互作用,但EC毒理學研究的現有成果已經可以說明EC對人體的致癌作用是不可忽視的。因此,過去人們也致力于研究EC在釀造酒中的形成機制以及對應的控制措施。但至今為止,能夠應用于實際生產中的控制措施仍然有限。對于那些會引起酒體風味以及營養成分發生改變的控制措施,還需要結合實際的生產過程進行反復驗證才能達到理想的平衡效果。而基因工程手段在與發酵食品有關的應用上需要慎重,可以考慮在發酵過程利用體系中的內源微生物來降解的EC前體物質,特別是對復雜微生物體系的白酒而言。總而言之,中國釀造酒中的EC含量高于風險閾值的情況常有發生,需要針對EC的控制措施做更多地深入研究。另一方面,釀造酒中EC的超標現狀與缺少國家標準的指導不無關系,隨著人們對EC致癌風險的認知逐步加深,建立相關標準已經勢在必行。

