GC-MS法對13種植物油中甾醇和脂肪酸的分布研究
熊小平 楊明 樊淑宏 羅婷婷 徐小平

摘要:該文建立GC-MS法對植物油中的甾醇和脂肪酸含量進行測定,研究常用植物油中甾醇和不飽和脂肪酸的分布規律。采用程序升溫法,由安捷倫毛細管GC柱HP-5MSUI(30m×0.250mm×0.25μm)和HP-88(60m×0.250mm×0.2μm)分離植物油中的甾醇和脂肪酸。結果表明,植物油經皂化,正己烷提取后進樣分析,在24~420μg/mL的范圍內菜籽甾醇等5個甾醇的線性關系良好(R=0.9991~0.9995),檢測限在1~2μg/mL;13種植物油中均檢出β-谷甾醇(含量79.54~6185.42mg/kg),均未檢出菜籽甾醇和麥角甾醇,其中橄欖油和小麥胚芽油中無豆甾醇,牡丹油和山茶籽油中無菜油甾醇。13種植物油均富含不飽和脂肪酸(76%~92%),同時含有較豐富的多不飽和脂肪酸(PUFA)的ω-3系和ω-6系,可按比例調配食用,補充機體修復所需。所建立的GC-MS檢測法可快速靈敏地適用于植物油中的甾醇類和脂肪酸類組分的定量分析。
關鍵詞:植物油;甾醇;脂肪酸;GC-MS
中圖分類號:O657.6
文獻標志碼:A
文章編號:1674–5124(2019)02–0064–08
0 引言
植物甾醇和不飽和脂肪酸是近年來食藥領域特別關注的天然組分,具有較高的食用和藥用價值[1-3]。植物甾醇是一類天然功能活性物質,在植物油中含量較高[4],可作為質量指標用于植物油的定級、認證、油摻雜打假和追溯原始脂質和植物油的來源[5-6]。常見的植物甾醇有谷甾醇、菜油甾醇、豆甾醇、菜籽甾醇和麥角甾醇,β-谷甾醇和菜油甾醇比較豐富,占甾醇的65%和30%[2-3]。脂肪酸是植物油中含量最高的活性營養成分,多以甘油酯的形式存在[7],分為飽和脂肪酸(SFA)和不飽和脂肪酸(UFA),根據雙鍵的數目分為單不飽和脂肪酸(MUFA)和多不飽和脂肪酸(PUFA)[8-9]。中國營養學會推薦脂肪酸日攝入量約20%~30%,且S∶M∶P≈1∶1∶1[10]。其中,ω-3和ω-6系PUFA具有更高的生理活性,且二者的比例對機體有重要影響[11],推薦比例ω-6∶ω-3為(4~6)∶1。ω-3攝入過多會損傷腸粘膜,而攝入ω-6過多易造成癌癥、心血管疾病、關節炎以及自身免疫疾病的發生并抑制ω-3的抗抑郁作用[12-14]。因此,對植物油中的甾醇和脂肪酸進行檢測是十分必要的。
有關植物油中甾醇和脂肪酸的分離檢測已有不少報道,常見的甾醇測定方法有衍生后的GC法[15],其衍生化條件復雜,且對衍生化試劑要求較高;薄層色譜與GC-MS/FID結合的方法[16],其前處理步驟復雜,對實驗人員的技術要求較高;還有報道采用高效液相對甾醇進行分析的方法[17],雖然能較為簡便地測出甾醇總量,但對于甾醇的組成卻無法分析。而針對脂肪酸GC-MS法是較為經典的方法[18],考察的脂肪酸的數量還可以有所增加。本研究擬建立GC-MS的方法,通過皂化等前處理后,對13種常見植物油的5種植物甾醇和37種脂肪酸進行檢測,其前處理方法簡單,實驗操作簡便,檢測甾醇和脂肪酸的種類完善,對甾醇和脂肪酸的分布規律進行了系統考察。為植物油的質量控制和食用指導,提供相關物質基礎和分析方法。
1 材料與儀器
1.1 材料
37種脂肪酸甲酯混標(Sigma-Aldrich);菜籽甾醇(Toronto Research Chemicals,98%);麥角甾醇、豆甾醇(98%,一飛生物);β-谷甾醇、菜油甾醇對照品(98%,PushBio-Technology);氫氧化鉀、氫氧化鈉、氯化鈉(AR,成都市科龍化工試劑廠);無水乙醇(AR,天津市美琳工貿有限公司);正已烷、甲醇(色譜級,賽默飛世爾科技有限公司);14%BF3-甲醇溶液(Sigma-Aldrich);沙棘油、山茶籽油、橄欖油、青刺果油、亞麻籽油、杏仁油、紫蘇油、火麻籽油、小麥胚芽油、葡萄籽油、牡丹油、月見草籽油、清脈油(成都悟道科技有限公司)。
1.2 儀器
XS205電子分析天平(瑞士MettlerToledo公司);HP-5MSUI氣相色譜柱(30m×0.250mm×0.25μm),HP-88氣相色譜柱(60m×0.250mm×0.2μm),GC-MS(7890A)(安捷倫科技有限公司)。
2 實驗方法
2.1 GC-MS條件
2.1.1 甾醇測定
安捷倫HP-5MSUI毛細管柱(30m×0.250mm×0.25μm);進樣器溫度300°C;程序升溫:120°C以12°C/min升至300°C,300°C保持20min;高純氦氣為載氣;流量為1mL/min;進樣量1μL,不分流進樣;溶劑延遲7min。
2.1.2 脂肪酸測定
安捷倫HP-88氣相色譜柱(60m×0.250mm×0.2μm);進樣口溫度260°C;升溫程序:100°C以3°C/min升至150°C,保持2min,以3°C/min升至240°C;載氣為高純氦氣;柱流量為1mL/min;進樣量1μL,分流比40∶1;溶劑延遲4.2min。
2.1.3 質譜條件
離子源溫度230°C;電離源為EI,電子能量70eV;傳輸線溫度300°C;四級桿溫度150°C;掃描質量范圍為35~500amu。
2.2 對照溶液的配制
2.2.1 甾醇
分別取菜籽甾醇、麥角甾醇、菜油甾醇、豆甾醇、β-谷甾醇的對照品各10mg,精密稱定,置于10mL量瓶中并用正已烷溶液稀釋定容作為混合對照儲備液。儲備液置于4°C冰箱內保存備用,測定時取儲備液用正己烷稀釋成含5種甾醇對照品質量濃度為100μg/mL作為對照溶液。
2.2.2 脂肪酸
取37種脂肪酸甲酯混標100μL,置于10mL容量瓶中并用正已烷溶液稀釋定容即得,用于氣相色譜條件優化以及脂肪酸甲酯的定性。
2.3 供試品溶液的制備
2.3.1 甾醇
稱取約0.5g植物油于試管中,加入2mol/L的KOH-C2H5OH溶液5mL,充分振蕩后于75°C水浴皂化60min取出,冷卻后加入5mL水,再用5mL正已烷充分渦旋提取,靜置分層,吸取上層有機相,置離心管,于3000r/min離心20min,取上清液經0.22μm微孔濾膜過濾后供GC-MS分析。
2.3.2 脂肪酸
稱取植物油約0.5g于試管中,加入0.5mol/L的NaOH-CH3OH溶液5mL,充分振蕩后于60°C水浴皂化約30min至油滴消失,然后于60°C持續通入氮氣吹干溶劑,加入14%BF3-CH3OH溶液5mL,通風櫥80°C水浴5min,冷卻后加入8mL正已烷充分渦旋提取,靜置分層,吸取上層有機相,至離心管,于3000r/min離心20min,取上清液經0.22μm微孔濾膜過濾后供GC-MS分析。
2.4 數據處理方法
采用保留時間結合GC-MSNIST08譜庫檢索進行定性,甾醇采用外標法定量,脂肪酸采用面積歸一化法進行定量。
3 結果和討論
3.1 甾醇皂化條件的選擇
由于植物油中的甾醇屬于弱極性化合物,基質中的游離脂肪酸、脂肪酸甘油酯等都會對甾醇的測定產生影響;因此,本研究以火麻籽油為對象,采用皂化處理,通過測定不同條件下油中β-谷甾醇的含量來優化皂化條件。最終確定使用2mol/L的KOH-C2H5OH,在75°C的水浴下皂化60min作為最佳皂化條件。不同條件的皂化結果見表1。
3.2 GC-MS條件選擇
3.2.1 甾醇掃描模式分析
甾醇采取全掃描模式是因為本研究只測定了5種常見的甾醇,若采取選擇離子掃描模式無法檢出其他可能存在的甾醇,而采取全掃描模式結合NIST庫就有可能定性測定出除這5種甾醇外的其他非皂化物。雖然此次全掃描模式下,沒有在13種植物油中檢得有其他種類的甾醇,但是在亞麻籽油、青刺果油、橄欖油、月見草籽油、紫蘇油和清脈油非皂化物中發現存在較大量類似環阿屯醇(19.897min)的物質,如圖1所示,環阿屯醇是甾醇生物合成的一個重要前體化合物,具有抗炎、抗腫瘤、抗氧化、抗菌、抗阿爾茲海默癥等生理活性[19],并且對于植物的生長發育具有顯著影響[20]。
3.2.2 脂肪酸測定時分流比和數據處理方法討論
實驗初期使用混標溶液進行預實驗,是因為不同植物油中含有脂肪酸種類有較大差異,而混標包含了常見的37種脂肪酸,以它為標準進行條件優化更加具有適應性。在前期預實驗過程中,發現在
不分流和分流比為10∶1時,由于進入色譜柱的溶劑量過大,混標溶液中保留時間在4.5min的第1個脂肪酸甲酯峰會被溶劑峰掩蓋,而在分流比為40∶1和100∶1的情況下,其不會被掩蓋,考慮到節約載氣,最終選定分流比為40∶1。
本文采用面積歸一化法進行植物油脂肪酸數據處理也是經過大量的前期預實驗而得出的,取37種脂肪酸甲酯混標對照進樣,采用面積歸一化法進行脂肪酸含量測定,將結果與說明中標示含量進行比較,發現兩者存在差異,準確度在75%~125%范圍內。這里產生的差異可能是來自于混標對照中的溶媒。混標對照的溶媒是二氯甲烷,其具有很強的揮發性,使得混標對照溶液配制過程中具有不可控性,且混標對照品一旦開封就算保存在4°C冰箱,二氯甲烷都會有一定的揮發。因為植物油中脂肪酸成分種類繁多,不同植物油中脂肪酸種類也不盡相同,若全部分別采用單標定量定性測定費時費力,且目前脂肪酸普遍采用GC-MS面積歸一化法進行定性定量測定,所以本研究也最終采用面積歸一化法對目標植物油中的脂肪酸進行分析,若后期需要對幾種重要的脂肪酸進行定量,則可以再采用外標法對其進行準確定量。
3.3 方法學評價
3.3.1 甾醇
1)校正曲線、檢測限和定量限
取混合對照儲備液稀釋成菜籽甾醇、麥角甾醇、菜油甾醇、豆甾醇、β-谷甾醇質量濃度為400,200,100,50,20μg/mL的5組對照品溶液。在2.1.1條件下進樣,記錄色譜圖,分別以5種甾醇峰面積對質量濃度進行線性回歸;不斷稀釋對照溶液進樣以信噪比S/N=3作為檢測限,S/N=10作為定量限,得到結果如表2所示。由表可知,在測定的范圍內,各個甾醇成分的校正曲線的線性較好,且定量限和檢測限符合要求,適用于定量分析。
2)重復性和回收率
重復性:取火麻籽油6份,按照2.3.1下方法配制供試品溶液6份在2.1.1條件下分別進樣,記錄色譜圖,對菜油甾醇、豆甾醇、β-谷甾醇進行含量考察,試驗結果見表3。表明該方法有良好的重復性。
回收率:取9份火麻籽油中加入適量菜籽甾醇、麥角甾醇、菜油甾醇、豆甾醇、β-谷甾醇對照品,使得含對照120%、100%、80%的高中低每個濃度3份樣品,按照2.3.1下方法配制供試品溶液9份在2.1.1條件下分別進樣,結果如表4所示,表明該方法具有良好的準確度。
3.3.2 脂肪酸
1)脂肪酸的鑒定
取混標對照溶液按照2.2.2下方法配置對照溶液,在2.1.2所述條件下進樣,記錄色譜圖,通過NIST08譜庫檢索將其與對照品中含有的脂肪酸甲酯進行一一對應,結果如圖2、表5所示。
2)重復性
取沙棘油6份,按2.3.2下方法配制供試品溶液6份,在2.1.2所述條件下分別進樣,記錄色譜圖,由于沙棘油中脂肪酸種類較多,所以選取了沙棘油的7種主要脂肪酸,即棕櫚酸、棕櫚油酸、硬脂酸、油酸、11-十八碳烯酸、亞油酸和亞麻酸進行含量考察,測定RSD分別為1.6%、1.6%、2.9%、2.1%、4.0%、1.7%、1.8%,結果表明該方法具有良好的重復性。
3.4 含量測定
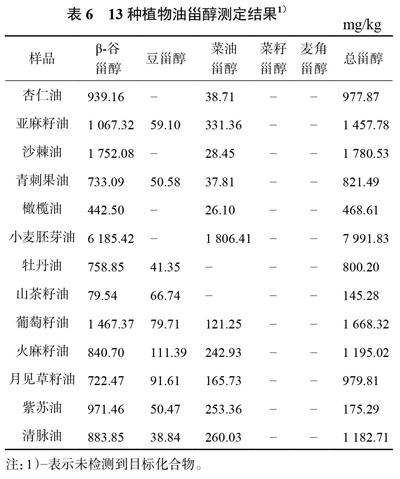
3.4.1 13種植物油中甾醇的分布分析
取甾醇對照品溶液和13種植物油的供試品溶液按照2.1.1條件下進樣,紀錄色譜圖,如圖3和圖4所示。結果表明:菜籽甾醇、麥角甾醇、菜油甾醇、豆甾醇和β-谷甾醇在該條件均能出峰,并且得到有效分離,方法適用于13種植物油中甾醇含量的測定。
在該方法下對13種植物油中的甾醇含量進行檢測,得到結果如表6所示。13種植物油均未檢測到菜籽甾醇和麥角甾醇,而均測得有β-谷甾醇;小麥胚芽油中的菜油甾醇含量最高,為1806.41mg/kg,牡丹油、山茶籽油中則未檢測到菜油甾醇;火麻籽油中豆甾醇含量最高為111.39mg/kg,杏仁油、沙棘油、橄欖油、小麥胚芽油中未檢測到豆甾醇;β-谷甾醇含量最高的是小麥胚芽油為6185.42mg/kg,最低的是山茶籽油為79.54mg/kg。而十三種植物油中,甾醇總含量最高為小麥胚芽油,達7991.83mg/kg,山茶籽油最低,只有145.28mg/kg。
各種甾醇在植物油中的分布差別很大。麥角甾醇和菜籽甾醇都未能檢出,結果也與文獻相符合[21],麥角甾醇作為生物膜的重要組成部分,僅存在酵母等真菌的細胞以及麥角等少數植物中,而菜籽甾醇也僅存在于一些浮游植物和油菜籽陸生植物中。菜油甾醇、豆甾醇以及β-谷甾醇是大部分植物油中都比較常見的甾醇。13種植物油中,小麥胚芽油的總甾醇含量最高,是其他植物油中總甾醇的數倍,也是目前國際公認最好的油脂。其他植物油雖然總甾醇含量不如小麥胚芽油,但是甾醇種類相對豐富,各甾醇比例大小不一,仍然有各自獨特的價值。
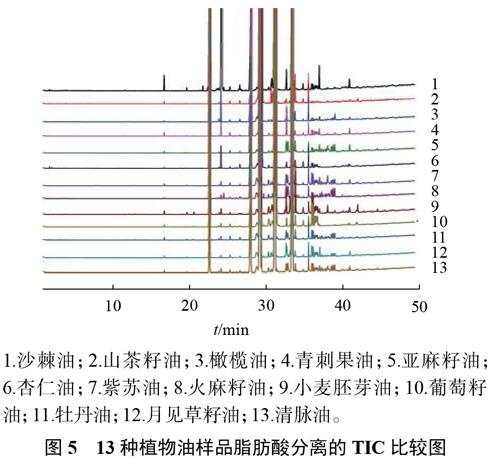
3.4.2 13種植物油中的脂肪酸分布分析
取13種植物油的供試品溶液按照2.1.2條件下進樣,紀錄色譜圖,如圖5所示,結果表明:各種脂肪酸甲酯均能出峰,并能得到有效分離。
取植物油按2.3.2下方法配制成供試品溶液后,在2.1.2條件下進樣,記錄色譜圖,通過結合對照保留時間以及NIST08譜庫檢索對脂肪酸甲酯進行定性,對樣品中存在的但混標中不含有的脂肪酸則直接用NIST08譜庫檢索進行定性,采用面積歸一化法進行定量。對13種植物油的測定結果按照飽和脂肪酸(SFA)、不飽和脂肪酸(UFA)、以油酸為主的單不飽和脂肪酸(MUFA)、多不飽和脂肪酸(PUFA)、以亞麻酸為主的ω-3系多不飽和脂肪酸、以亞油酸為主的ω-6系多不飽和脂肪酸進行分類統計,計算各自分別所占的百分比,結果見表7。
由表可知,青刺果油的飽和脂肪酸含量最高,不飽和脂肪酸最低,分別為23.51%和76.48%;杏仁油含飽和脂肪酸最低,不飽和脂肪酸最高,分別為7.25%和92.75%;以油酸為主的單不飽和脂肪酸含量最高的是山茶籽油為83.60%,最低的則是葡萄籽油為12.53%;多不飽和脂肪酸含量最高的是葡萄籽油為75.24%,含量最低的為山茶籽油為7.00%;以亞麻酸為主的ω-3系多不飽和脂肪酸含量最高的是火麻籽油為61.83%,最低的是山茶籽油僅為0.11%;以亞油酸為主的ω-6系多不飽和脂肪酸含量最高是葡萄籽油為74.15%。
3.5 脂肪酸檢測中ω-3和ω-6系多不飽和脂肪酸比例討論
近年經過對ω-3和ω-6系多不飽和脂肪酸的深入研究發現兩者之間的比例也對人體健康有著重要的影響。ω-3和ω-6系多不飽和脂肪酸在人體內代謝競爭同一種酶,其中一種攝入過多就會抑制和削弱另外脂肪酸的轉化。過多的ω-3攝入會損傷腸粘膜造成腸炎甚至形成潰瘍,而過多地攝入ω-6易造成癌癥、心血管疾病、關節炎以及自身免疫疾病的發生并抑制ω-3的抗抑郁作用,中國營養學會建議ω-3∶ω-6的比值為1∶(4~6)。由實驗結果(表8)可知13種植物油的ω-3∶ω-6比值均不在建議的范圍內,多不飽和脂肪酸含量最高的葡萄籽油ω-3∶ω-6比值最低為1∶149.20,而同樣含多不飽和脂肪酸很高的火麻籽油ω-3∶ω-6比值則是13種植物油中最高的約為1∶0.20。可以看出不同植物油其脂肪酸的組成比例有著很大的差別,單一的植物油并不能充分提供人體所需,所以目前倡導的一定比例的混合食用油是有充分依據的。
4 結束語
本文建立的皂化后的GC-MS法對13植物油中的5種甾醇和37種脂肪酸進行分布研究,具有前處理簡單、操作簡便、檢測甾醇和脂肪酸種類完善等特點。該方法還具有良好的專屬性、準確度和精密度,能準確測定植物油中甾醇和脂肪酸的含量。測定結果可作為質量指標用于植物油的認證、定級、油摻雜打假和追溯植物油的來源。也提示消費者在購買植物油時,不要選擇單一來源的植物油,盡量選擇對身體健康更有益處的調和油。
參考文獻
[1] LERMA-GARCIA M J, SIMO-ALFONSO E F, RAMIS-RAMOS G, et al. Rapid deter mination of sterols in vegetable oils by CEC using methacrylate ester-based monolithic columns[J]. Electrophoresis, 2008(29): 4603-4611.
[2] ALBERICI R M, FERNANDES G D, PORCARI A M, et al. Rapid fingerprinting of sterols and related compounds in vegetable and animal oils and phytosterol enriched-margarines by transmission mode direct analysis in real time mass spectrometry[J]. Food Chemistry, 2016(211): 661-668.
[3] KOZ?OWSKA M, GRUCZYNSKA E, SCIBISZ I, et al. Fatty acids and sterols composition, and antioxidant activity of oils extracted from plant seeds[J]. Food Chemistry, 2016(213): 450-456.
[4] LIN Y, KNOL D, VALK I, et al. Thermal stability of plant sterols and formation of their oxidation products in vegetable oils and margarines upon controlled heating[J]. Chemistry and Physics of Lipids, 2017(207): 99-107.
[5] XU B, ZHANG L, MA F, et al. Deter mination of free steroidal compounds in vegetable oils by comprehensive two- dimensional gas chromatography coupled to time-offlight mass spectrometry[J]. Food Chemistry, 2018(245): 415-425.
[6] LERMA-GARCIA M J, SIMO-ALFONSO E F, MENDEZ A, et al. Fast Separation and Deter mination of Sterols in Vegetable Oils by Ultraperformance Liquid Chromatography with Atmospheric Pressure Chemical Ionization Mass Spectrometry Detection[J]. J. Agric. Food Chem, 2010(58): 2771-2776.
[7] TAHOUN I F. Rapid Method for Assessment of Olive Oil Adulteration with Some Vegetable Oils by Chromatographic Analysis of Fatty Acids Composition[C]//International Conference on Food and Biosystems Engineering, 2015: 44.
[8] JIANG L, ZHENG H, LU H. Application of UV spectrometry and chemometric models for detecting olive oil-vegetable oil blends adulteration[J]. Journal of Food Science and Technology, 2015, 52(1): 479-485.
[9] MA F, YANG Q, MATTHA?US B, et al. Simultaneous deter mination of capsaicin and dihydrocapsaicin for vegetable oil adulteration by immunoaffinity chromatography cleanup coupled with LC-MS/MS[J]. Journal of Chromatography B Analytical Technologies in the Biomedical & Life Sciences, 2016, 1021: 137-144.
[10] STEENHORST-SLIKKERVEER L, LOUTER A, JANSSENH G, et al. Analysis of nonvolatile lipid oxidation products in vegetable oils by normal-phase high-performance liquid chromatography with mass spectrometric detection[J]. Journal of the American Oil Chemists' Society, 2000, 77(8): 837-845.
[11] RYY C, LIU C P, HOU C J, et al. Comparison of fatty acid composition and oxidative stability of peanut oils prepared from spring and fall crops of peanuts[J]. Journal of Agricultural & Food Chemistry, 1995, 43(3): 676-679.
[12] Animal and vegetable fats and oils-Preparation of methyl esters of fatty acids: PN-EN ISO 5509: 2001[S]. Geneva: International Organization for Standardization, 2011.
[13]伍新齡,王鳳玲,關文強.植物油脂肪酸甲酯化方法比較與含量測定[J].食品研究與開發,2015(7):84-87.
[14]張征,鄒潔,顏春榮,等.不同甲酯化方法對植物油脂肪酸組成測定的影響[J].食品科學,2011,32(s2):61-65.
[15]LECHNERM, REITERB, LORBEERE.Determinationoftocopherolsandsterolsinvegetableoilsbysolid-phaseextractionandsubsequentcapillarygaschromatographicanalysis[J].JournalofChromatographyA, 1999(857): 231-238.
[16]陳帥,畢艷蘭,汪學德,等.GC-MS/FID法分析玉米胚芽油中的甾醇和甾醇酯[J].中國糧油學報,2017(5):131-137.
[17]張麗霞,畢艷蘭,張康逸.植物甾醇醇與甾醇酯的分離分析方法研究[J].糧油加工與食品機械,2006(2):53-55.
[18]劉冰.GC-MS分析測定5種植物油中脂肪酸成分研究[J].食品工業,2014,35(4):222-224.
[19]張忠廉,羅祖良,石宏武,等.植物藥活性成分環阿屯醇藥理、生理活性及其研究展望[J].中國中藥雜志,2017,42(03):433-437.
[20]GAS-PASCUALE, BERNAA, BACHTJ, etal.Plantoxidosqualenemetabolism: cycloartenolsynthase-dependentsterolbiosynthesisinnicotianabenthamiana[J].PLoSONE, 2014, 9(10): e109156.
[21]盛漪,華偉,谷文英.植物甾醇資源在食品原料中分布[J].糧食與油脂,2002(5):40-41.

