板栗鐵型超氧化物歧化酶基因(CmFeSOD)的克隆及原核表達
韓 珊,劉裕峰,朱天輝,劉應高,譙天敏, 李姝江,汪煜伶,徐纓絡,莫義英
(四川農業大學 林學院,成都 611130)
板栗(CastaneamollissimaBl),又名栗,屬殼斗科栗屬堅果類植物,起源于中國,歷史悠久,是中國的特產植物,也是世界上重要的干果植物之一。栗疫病(Chestnut blight)的出現,使美洲板栗遭到幾乎滅絕的威脅,歐洲板栗也遭受巨大的危害[14]。中國板栗是對栗疫病抗病性最好的種[15],這可能是由于其與栗疫病菌[Cryphonectriaparasitica(Murrill) Barr.]共演化的結果[16]。本試驗對板栗CmFeSOD基因的克隆及原核表達進行研究,為揭示CmFeSOD基因與抗栗疫病之間的分子機制,并為利用基因工程技術培育抗病性林木提供理論依據和基因資源。
1 材料與方法
1.1 試驗材料
板栗品種‘石豐’由四川農業大學林學院崇州基地提供。
1.2 總RNA的提取及cDNA的合成
取100 mg健康板栗幼葉(生長3個月),利用液氮充分研磨后,使用植物總RNA提取試劑盒(GK型,北京華越洋生物科技有限公司,中國)提取總RNA,提取的RNA通過紫外分光光度計測定質量濃度和純度;參照公司PrimeScriptTMⅡ1st Strand cDNA Synthesis Kit試劑盒(6210A,TaKaRa,日本)的操作說明書,合成第一鏈 cDNA。
1.3 CmFeSOD基因的克隆
對板栗轉錄組數據(http://www.fagaceae.org/)和 GenBank(https://www.ncbi.nlm.nih.gov/)中已報道的其他植物SOD 基因序列進行 Blast 序列比對,根據保守序列設計1對特異性引物CmFeSOD-F1:5′-ATGGCTTTCCGGCCTCTAT-3′和CmFeSOD-R1:5′-TCAAGGGCATTCTTTCTCA-3′。以cDNA(2 μg/μL)為模板進行PCR擴增,反應程序為:94 ℃ 預變性 3 min;94 ℃變性 30 s,55 ℃復性 30 s,72 ℃ 延伸 1 min,35 個循環;72 ℃ 終延伸 7 min,4 ℃保存擴增產物。PCR產物經 10 g/L 瓊脂糖凝膠電泳檢測后,切取目的片段,使用膠回收試劑盒(DP209,天根生化科技有限公司,中國)進行純化回收,回收片段與 pMD19-T 載體(TaKaRa,日本)連接,轉化到大腸桿菌DH5α感受態細胞,于Amp/X-gal/LB平板上進行藍白斑篩選,隨機挑取經PCR鑒定后的陽性克隆菌液,送上海美吉生物醫藥科技有限公司測序。
1.4 CmFeSOD基因序列的生物信息學分析
利用軟件DNAMAN(Ver.6.0,Lynnon biosoft,美國)查找序列的開放閱讀框(Open reading frame,ORF),并將其翻譯為氨基酸序列,通過NCBI中的Blast(http://blast.ncbi.nlm.nih.gov/)進行核苷酸序列和氨基酸序列同源性比對。分別運用ProtParam(http://web.expasy.org/protparam/)和ProtScale(http://web.expasy.org/protscale/)對其編碼蛋白的理化性質和疏水性進行分析。利用ScanProsite(http://prosite.expasy.org/scanprosite)對其編碼蛋白的功能位點及功能域進行分析,通過SPOMA(https://npsa-prabi.ibcp.fr/)對蛋白的二級結構進行預測。分別使用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)和SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)對其編碼蛋白的跨膜區和信號肽進行預測,使用SWISS-MODEL(http://swissmodel.expasy.org/SWISS-MODEL.html)進行蛋白三級結構預測。利用MEGA(Ver.6.0,Research center for genomics and bioinformatics,日本)繪制系統進化樹。
1.5 原核表達載體的構建及鑒定
根據板栗CmFeSOD基因序列設計擴增引物CmFeSOD-F2:5′-CGGGATCCATGGCTTT- CCGGCCTCTAT-3′(下劃線為BamHⅠ酶切位點)和CmFeSOD-R2:5′-CCCAAGCTTTCA-AGGGCATTCTTTCTCA-3′(下劃線為HindⅢ酶切位點)。以 pMD19-T-CmFeSOD質粒為模板(2 μg/μL)進行PCR擴增,反應程序同“1.3”。PCR產物經10 g/L瓊脂糖凝膠電泳檢測后,進行目的片段純化回收。以 pET-28a 作為表達載體,對回收片段進行BamHⅠ和HindⅢ雙酶切,分別回收酶切產物,使用T4DNA連接酶 16 ℃連接 12 h。將獲得的 pET28a-CmFeSOD重組質粒轉入EscherichiacoliBL21(DE3)進行卡那霉素(Kanamycin,Kan)(100 μg/mL)抗性篩選,挑取單菌落于LB液體培養基擴增培養后進行PCR鑒定,提取陽性克隆菌液質粒,經BamHⅠ和HindⅢ雙酶切鑒定后,送上海美吉生物醫藥科技有限公司測序。
1.6 CmFeSOD蛋白的誘導表達與檢測
挑取含有pET28a-CmFeSOD重組質粒的BL21(DE3)單菌落,接種于含Kan(100 μg/mL)抗生素的LB液體培養基中,恒溫 37 ℃、200 r/min振蕩培養 12 h。按體積比1∶100進行菌液擴增培養,當菌液光密度OD600約為0.6~0.8時,分別進行不同條件的誘導。首先進行不同濃度(終濃度為 0.2 mmol/L、0.4 mmol/L、0.6 mmol/L、0.8 mmol/L和 1.0 mmol/L)的IPTG誘導 3 h,再進行不同時間長度(1 h、2 h、3 h、 4 h、5 h和6 h)的誘導,最后進行不同溫度 (25 ℃、30 ℃和 37 ℃)的誘導,收集1 mL菌液進行SDS-PAGE電泳檢測,篩選最優條件,并對不同溫度誘導下的目的蛋白進行可溶性分析。所有樣品檢測均以IPTG誘導的pET28a-BL21(DE3)和未誘導的pET28a-BL21(DE3)、pET28a-CmFeSOD-BL21(DE3)作為對照。
2 結果與分析
2.1 板栗CmFeSOD基因的克隆與序列分析
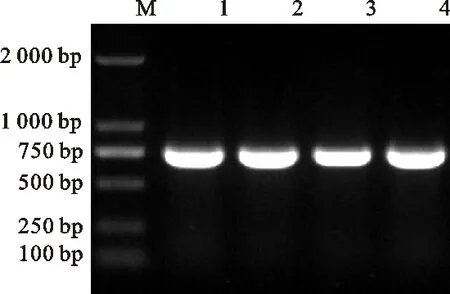
利用特異性引物CmFeSOD-F1和CmFeSOD-R1對板栗cDNA進行PCR擴增,結果發現與預期片段大小相符的單一條帶(圖 1),回收該片段與pMD19-T載體連接轉化后,經菌落PCR檢測發現相同大小的條帶(圖 2)。測序表明板栗CmFeSOD基因序列長度為 705 bp(圖 3)。通過DNAMAN分析發現,克隆獲得的cDNA序列無非編碼區,為一個完成的ORF,編碼 234 個氨基酸。該核苷酸序列與GenBank中已報道的SOD基因序列的Blastn比對結果表明,該片段堿基序列與白樺(KP711291.1)、煙草(X14482.1)等植物SOD基因cDNA序列的一致性為82%~90%。表明該基因屬于超氧化物歧化酶基因家族成員之一,將該基因cDNA序列提交GenBank數據庫,獲得登錄號:KY312852,命名為CmFeSOD基因。
2.2 CmFeSOD蛋白的氨基酸序列分析
采用ProtParam軟件推算CmFeSOD蛋白質分子質量為26.016 5 ku,理論等電點為6.86,該蛋白由20 種氨基酸組成,其中以亮氨酸(Leu)使用最為頻繁,占氨基酸總量的12.0%,以半胱氨酸(Cys)使用最少,僅占氨基酸總量的0.4%。
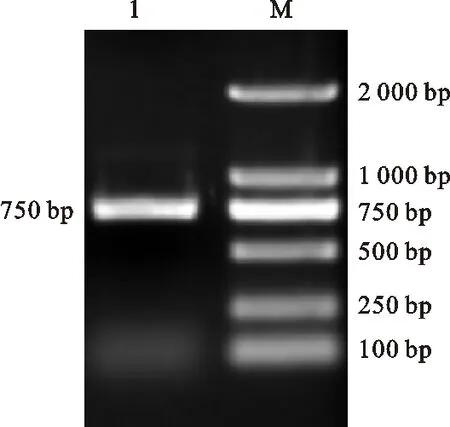
1.CmFeSO基因PCR產物 PCR products ofCmFeSODgene; M.DNA marker(DL2000,Takara,Japan)
圖1 板栗葉組織中CmFeSOD基因的PCR擴增
Fig.1 PCR amplification ofCmFeSODgene from leaf tissue of chestnut
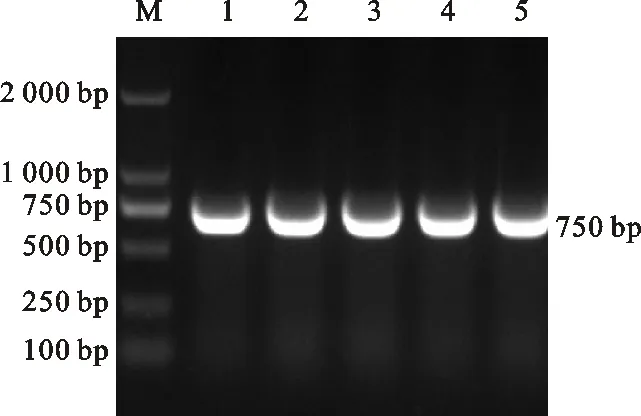
M.DNA marker(DL2000,Takara,Japan); 1~5.pMD19-T-CmFeSOD-DH5α PCR產物 PCR products of pMD19-T-CmFeSOD-DH5α
圖2 重組質粒pMD19-T-CmFeSOD-DH5αPCR檢測
Fig.2 Detection ofCmFeSODgene in arecombinant plasmid of pMD19-T-CmFeSOD-DH5α based on PCR amplification
CmFeSOD蛋白具有酸性氨基酸21個,堿性氨基酸20個,分別占氨基酸總量的8.97%和8.55%,推算其分子式為C1178H1813N317O342S4。預測該蛋白為穩定蛋白(不穩定系數為34.87),脂肪系數為89.62,平均親水系數為-0.323,屬親水性蛋白。由圖4可見,CmFeSOD蛋白具有Sod_Fe_C、Sod_Fe_N、PLN02471和SodA結構域,這些區域均為SOD蛋白家族特有的保守功能域。利用Prosite工具發現鐵錳超氧化物歧化酶信號位點(Manganese and iron superoxide dismutase signal site)-DVWEHAYY,位于蛋白序列的第195~202氨基酸。氨基酸序列同源性及多重序列對比分析發現(圖5),CmFeSOD蛋白與其他植物SOD蛋白序列一致性較高,均在80%以上。遺傳進化分析表明,板栗與核桃親緣關系較近,可能由同一個始祖進化而來(圖6)。

加粗字體表示起始密碼子 Blod fonts indicated start codon; *表示終止密碼子 Asterisk indicated stop codon; 下劃線表示鐵錳超氧化物歧化酶信號位點 Capital letters underlined using single line indicated signal site of iron-manganese superoxide dismutase
圖3CmFeSOD基因的cDNA序列及其所推導的氨基酸序列
Fig.3 cDNA sequence and deduced amino acid sequence ofCmFeSODgene

圖4 CmFeSOD蛋白保守結構域Fig.4 Conserved domains of CmFeSOD protein
2.3 CmFeSOD蛋白結構預測分析
是否具有蛋白質跨膜區域對于了解蛋白的結構、功能、方位以及在細胞中的作用部位有重要意義,CmFeSOD蛋白的跨膜區域分析顯示,該蛋白不存在跨膜區域,推測其存在于細胞質中。信號肽的分析有助于認識和了解該蛋白是否參與跨膜轉移,CmFeSOD蛋白信號肽預測結果表明,該蛋白不存在信號肽,屬于非分泌型蛋白。蛋白質多肽鏈本身的折疊和盤繞構成蛋白質的二級結構,主要有α-螺旋、β-轉角、無規則卷曲和延伸鏈,這些部分是蛋白質分子實現其功能和構象的主要區域,CmFeSOD蛋白的二級結構由35.90%的α-螺旋,31.20%的無規則卷曲,20.09%的延伸鏈和12.81%的β-轉角組成(圖7-a)。利用HhblitsS工具發現CmFeSOD蛋白三級結構同源模板為擬南芥AtSOD蛋白(4c7u.1),其與CmFeSOD蛋白序列相似性達86%,覆蓋率為85%,利用WISS-MODEL在線軟件構建CmFeSOD蛋白三級結構(圖7-b)。
2.4 pET28a-CmFeSOD重組載體的構建
使用帶酶切位點的引物CmFeSOD-F2和CmFeSOD-R2,以pMD19-T-CmFeSOD質粒為模板,擴增CmFeSOD基因片段,瓊脂糖凝膠電泳檢測到預期大小的片段并純化回收,將目的片段與pET-28a載體分別進行BamHⅠ/HindⅢ雙酶切,分別回收酶切后的目的片段與載體,使用T4DNA連接酶連接并進行轉化,挑取單菌落進行PCR鑒定(圖8、圖9)。
2.5 CmFeSOD蛋白原核表達的SDS-PAGE 分析
在37 ℃下進行不同IPTG濃度(終濃度為0.2、0.4、0.6、0.8和1.0 mmol/L)誘導表達pET28a-CmFeSOD-BL21(DE3) 3 h,以未誘導的pET28a-CmFeSOD-BL21(DE3)、pET28a-BL21(DE3)以及加入至終濃度為0.6 mmol/L IPTG誘導3 h后的pET28a-BL21(DE3)空載體作為對照。經蛋白電泳發現,pET28a-CmFeSOD-BL21(DE3)在不同濃度下均能誘導出大量的目的蛋白(圖10),目的蛋白大小約為29 ku。預測CmFeSOD蛋白分子質量為26.016 5 ku,外加3 ku pET28a 6*his標簽序列,約為29 ku,與表達的目的蛋白大小相符。同時,隨著IPTG濃度增加,目的蛋白的表達量在緩慢增長,當IPTG終濃度達到0.4 mmol/L后,表達量達到最大。因此,以終濃度為0.4 mmol/L IPTG誘導最佳。

黑底白字表示完全一致的氨基酸序列 White lefferings with black background indicated a complete identical amino acid sequences; 白底黑字表示高度保守的氨基酸序列 Black lefferings with white background represented highly conserved amino acid sequences; 白底灰字表示非保守的氨基酸序列 Gray fonts highlighted with white background represented non-conservative amino acid sequences; α-螺旋顯示為大波浪曲線 α-helix was displayed as large squiggles; η-螺旋顯示為小波浪曲線 η-helix was displayed as small squiggles; 嚴格的β-轉角呈現為TT字母 Strict β-turn was shown as TT letters; β-鏈呈現為箭頭 β-strand was rendered as black solid arrows
圖5 CmFeSOD蛋白與其他植物SOD蛋白的多重序列對比
Fig.5 Multiple sequence alignment of deduced protein of CmFeSOD with SOD proteins of other plants

圖6 Neighbor-joining(NJ)方法構建CmFeSOD蛋白與其他植物SOD蛋白的系統進化樹Fig.6 Phylogenetic tree between CmFeSOD protein and SOD proteins of other plants based on Neighbor-Joining (NJ) method
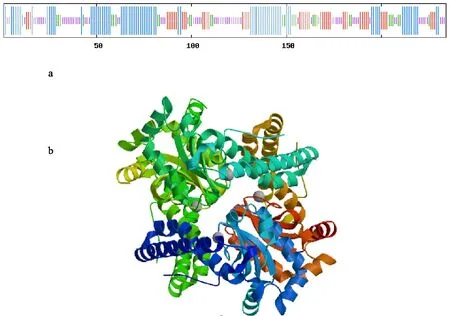
a.CmFeSOD蛋白的二級結構 Secondary stucture of CmFeSOD protein; 藍色表示α-螺旋 Blue color indicated alpha helix; 紫色表示無規則卷曲 The purple color indicated random coil; 紅色表示延伸鏈 Red color indicated extended strand; 綠色表示β-轉角 Green color indicated beta turn;b.CmFeSOD蛋白的三級結構 Tertiary structure of CmFeSOD protein
圖7 CmFeSOD蛋白的二級結構和三級結構預測
Fig.7 Predicted secondary and tertiary structures of CmFeSOD protein
在37 ℃、0.4 mmol/L IPTG條件下,進行不同時間長度(0、1、2、3、4、5、6 h)的誘導。由圖11可見,隨著誘導時間的增加,目的蛋白的表達量呈上升趨勢,誘導時間達到3 h以后趨于平穩,達到飽和狀態。因此,pET28a-CmFeSOD-BL21(DE3)在37 ℃、0.4 mmol/L IPTG條件下的最佳誘導時間為3 h。
為確定融合蛋白誘導表達的最適溫度,并評估在不同溫度條件下誘導的融合蛋白可溶性。pET28a-CmFeSOD-BL21(DE3)以終濃度為0.4 mmol/L IPTG分別在25 ℃、30 ℃和37 ℃下誘導3 h。SDS-PAGE電泳檢測發現,在不同溫度條件下,除對照外均能誘導出目的蛋白。pET28a-CmFeSOD-BL21(DE3)在不同溫度條件下所表達的目的蛋白均以包涵體形式存在,在 30 ℃誘導條件下獲得的包涵體最豐富(圖12)。因此,30 ℃為最優誘導表達溫度。
M.DNA marker(DL2000,Takara,Japan); 1~4.pET28a-CmFeSOD-DH5α PCR產物 PCR products of pET28a-CmFeSOD-DH5α
圖8 重組質粒pET28a-CmFeSOD-DH5α的PCR檢測
Fig.8 Detection of pET28a-CmFeSOD-DH5αbased on PCR amplification
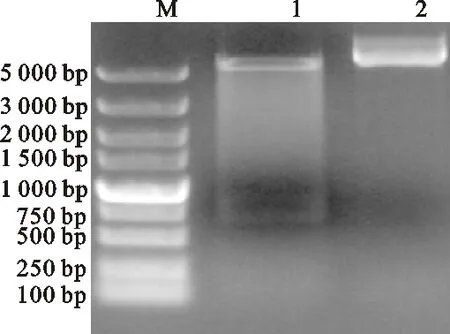
M.DNA marker(DL2000,Takara,Japan); 1.pET28a-CmFeSOD雙酶切產物 Product of pET28a-CmFeSODdigested by double endonucleases,BamHⅠ/HindⅢ; 2.未酶切pET28a-CmFeSODUndigested pET28a-CmFeSOD
圖9 pET28a-CmFeSOD雙酶切鑒定
Fig.9 Identification of pET28a-CmFeSODdigestedby double endonucleases,BamHⅠ/HindⅢ
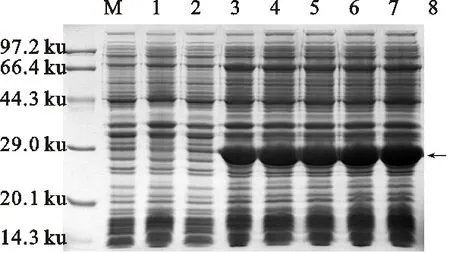
M.標準蛋白質分子質量 Protein molecular mass marker; 1.pET28a-BL21(DE3)未誘導 pET28a-BL21 (DE3) without IPTG; 2.pET28a-BL21(DE3)誘導 (IPTG終濃度為0.6 mmol/L) Induction of pET28a-BL21 (DE3) with 0.6 mmol/L IPTG; 3~8.終濃度為0、0.2、0.4、0.6、0.8、1.0 mmol/L IPTG誘導pET28a-CmFeSOD-BL21(DE3) Induction of pET28a-CmFeSOD-BL21(DE3) with 0,0.2 mmol/L ,0.4 mmol/L ,0.6 mmol/L ,0.8 mmol/L ,1.0 mmol/L IPTG,respectively.
圖10 融合蛋白pET28a-CmFeSOD-BL21(DE3)誘導濃度優化
Fig.10 Optimal concentration of fusion proteinpET28a-CmFeSOD-BL21(DE3) induced bydifferent concentrations of IPTG
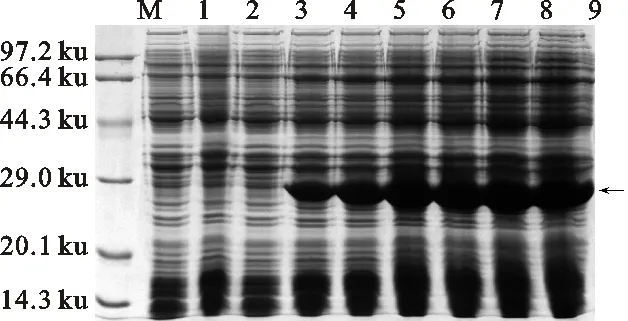
M.標準蛋白質分子質量 Protein molecular mass marker; 1.pET28a-BL21(DE3)未誘導 pET28a-BL21 (DE3) without IPTG; 2.pET28a-BL21(DE3)誘導 (IPTG終濃度為0.4 mmol/L) 3 h pET28a-BL21 (DE3) was induced by IPTG of a concentration of 0.4 mmol/L for 3 h ; 3~9.pET28a-CmFeSOD-BL21(DE3)誘導0 h、1 h、2 h、3 h、4 h、5 h、6 h pET28a-CmFeSOD-BL21(DE3) was induced for 0 h,1 h,2 h,3 h,4 h,5 h,6 h,respectively.
圖11 融合蛋白pET28a-CmFeSOD-BL21(DE3)誘導時間優化
Fig.11 Optimal time of fusion protein pET28a-CmFeSOD-BL21(DE3) inducedin different length of time
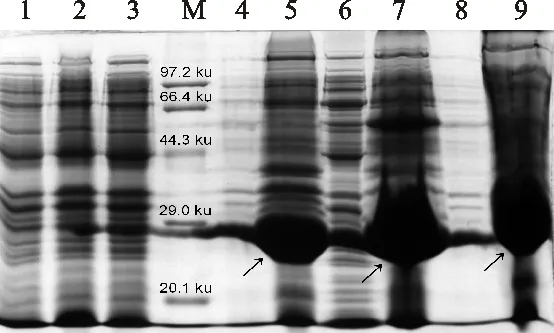
M.標準蛋白質分子質量 Protein molecular mass marker; 1.pET28a-BL21(DE3)未誘導 Induction of pET28a-BL21(DE3) without IPTG; 2.pET28a-BL21(DE3)誘導 (IPTG終濃度為0.4 mmol/L) 3 h pET28a-BL21 (DE3) was induced by IPTG of a concentration of 0.4 mmol/L for 3 h; 3.pET28a-CmFeSOD-BL21(DE3)未誘導 pET28a-CmFeSOD-BL21(DE3) without IPTG; 4.pET28a-CmFeSOD-BL21(DE3)25 ℃誘導上清 Supernatant of pET28a-CmFeSOD-BL21(DE3) was induced at 25 ℃; 5.pET28a-CmFeSOD-BL21(DE3)25 ℃誘導沉淀 Sediment of pET28a-CmFeSOD-BL21(DE3) was induced at 25 ℃; 6.pET28a-CmFeSOD-BL21(DE3)30 ℃誘導上清 Supernatant of pET28a-CmFeSOD-BL21(DE3) was induced at 30 ℃; 7.pET28a-CmFeSOD-BL21(DE3)30 ℃誘導沉淀 Sediment of pET28a-CmFeSOD-BL21(DE3) was induced at 30 ℃; 8.pET28a-CmFeSOD-BL21(DE3)37 ℃誘導上清 Supernatant of pET28a-CmFeSOD-BL21(DE3) was induced at 37 ℃; 9.pET28a-CmFeSOD-BL21(DE3)37 ℃誘導沉淀 Sediment of pET28a-CmFeSOD-BL21(DE3) was induced at 37 ℃
圖12 融合蛋白pET28a-CmFeSOD-BL21(DE3)誘導溫度優化及可溶性檢測
Fig.12 Optimal temperature of fusion proteinpET28a-CmFeSOD-BL21(DE3) induced atcondition of differed temperatures andsolubility detection of protein
3 討 論
植物遭受病原菌侵染后會誘發活性氧的迸發,被認為是植物抵抗病原菌侵染的特征反應[17],SOD作為植物體內的活性氧清除劑,能催化超氧陰離子自由基的歧化反應,解除其毒害作用,保護植物細胞膜的結構與功能[18],從而使得SOD與植物的抗病性緊密聯系在一起。
本研究結果發現,從板栗中克隆CmFeSOD基因的核苷酸序列及其所編碼的氨基酸序列與其他植物同源物均具有很高的同源性。生物信息學分析發現,板栗SOD蛋白具有Sod_Fe_C、Sod_Fe_N結構域和鐵錳超氧化物歧化酶信號位點,表明板栗SOD屬于FeSOD類型。已有報道表明銀杏[19]、菘藍[20]和小麥[21]等多種植物也具有同一類型的FeSOD。CmFeSOD蛋白三級結構以擬南芥AtSOD蛋白(pdb,4c7u.1)[22]為模板構建獲得,表明CmFeSOD可能與AtSOD具有相似的功能。進化樹分析顯示,板栗與喬木樹種中的核桃親緣關系最近,與草本植物中的葡萄親緣關系最近,與單子葉植物中的小果野芭蕉親緣關系最近。
本研究在3 種溫度(25 ℃、30 ℃和37 ℃)條件下誘導獲得的目的蛋白均以包涵體形式存在,該結果與小麥FeSOD基因[21]的重組表達情況相同,但其使用的原核表達載體為pET-DuetI;韋澤秀等[23]使用相同的pET28a載體表達青稞(HordeumvulgareL.var.nudumHK.f.)CML19基因獲得的重組蛋白也主要以包涵體形式存在。而高健等[24]使用pQE-30原核表達載體表達特異種質煙草(HZHN)FeSOD基因能獲得活性為402 U/g的可溶性蛋白;汪瀅等[25]進行發菜SOD基因的原核表達也能獲得較多的可溶性目的蛋白,其使用的是pET32a載體。可見,不同的原核表達載體,對目的蛋白可溶性的表達具有一定程度的影響。
4 結 論
本研究首次從板栗中獲得1個長度為705 bpCmFeSOD基因的cDNA序列,其編碼蛋白具有FeSOD超家族特有的序列特征和保守結構區域,在進化上十分保守。通過原核表達在30 ℃,添加0.4 mmol/L IPTG,誘導3 h獲得的CmFeSOD蛋白表達量最高,分子質量約為29 ku,其主要以包涵體的形式存在。

