嘧啶型抗血小板藥物的合成研究進展
張佳斐 張芝琳 朱艷芳 曹帥帥 張娟
摘要:人體正常的凝血過程離不開血小板在血管損傷部位的活化聚集,但是凝血過多和血小板黏附聚集會引起血管內血栓的形成。血栓的形成會導致發病率和死亡率的顯著提高。此外,血小板活化后,還會增強腫瘤細胞的外滲和轉移。因此抗凝藥物的發展極其重要,抗血小板藥物是其中重要的組成部分。本文對嘧啶型抗血小板藥物的合成方法進行綜述,為進一步研究抗血小板藥物提供參考。
關鍵詞:抗血小板藥物;嘧啶;合成方法
人體內血栓的形成會導致發病率和死亡率的顯著提高[1],血小板在血栓的形成中起著決定性的作用。血小板與膠原蛋白、凝血酶、ADP等因素接觸時會被激活,然后引起一系列的反應,包括血小板聚集、致密和促凝活性的提高。血栓分為動脈血栓和靜脈血栓。動脈血栓的形成最終導致急性心肌梗死和中風等疾病。靜脈血栓形成是由靜脈系統內的多種原因引起的,最終導致靜脈血栓栓塞。在歐洲,每年有50萬人死于靜脈血栓,這一數字超過了艾滋病、乳腺癌、前列腺癌和交通事故死亡人數的總和。20世紀以后,靜脈血栓形成的發生率在迅速提高,近年來的住院人數增加了10-30倍[2]。
此外,血小板在腫瘤轉移、計數腫瘤細胞遷移和侵襲中起著至關重要的作用[3]。血小板活化后,血小板內容物被釋放到腹膜間隙,會增強腫瘤細胞的外滲和轉移[4]。Wenzel課題組發現使用血小板聚集抑制劑西洛地唑后,小鼠體外血小板聚集性下降,血小板腫瘤復合體的形成減少[5]。因此,抗血小板藥物的合成研究至關重要。目前,廣泛使用抗血小板藥物有阿司匹林和噻吩吡啶類藥物。雖然兩種抗血小板藥物阿司匹林和氯吡格雷聯合使用療效較好,但仍有相當一部分患者因氯吡格雷抗血小板作用引起的個體差異而發生不良事件[6]。
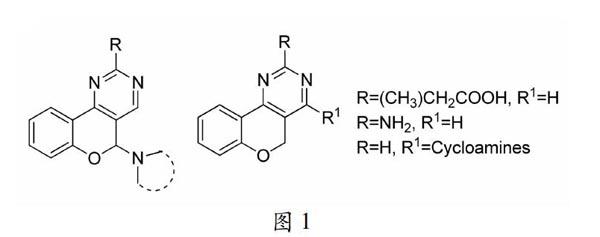
因嘧啶衍生的化合物具有抗炎、鎮痛、體內抗腫瘤等特性[7],為科學家們提供了一個重要的藥效結構合成研究平臺。一些嘧啶衍生物[8.9],具有良好的體外抗血小板活性和體內抗血栓作用(圖l) 。
目前為止,許多制備毗啶衍生物的方法已被報道。在2016年,Borazjani課題組[10]采用硅膠鍵合的N一丙基哌嗪鈉丙酸酯作為非均相固體堿催化劑,合成了苯并吡喃[2,3-D]嘧啶。該方法具有催化劑可多次循環使用,且催化劑的催化活性損失不明顯的優點。在2011年,杜洪光課題[11]組合成了硫代吡啶衍生物,經抗血小板活性測試,其中一些化合物具有部分抗血小板凝聚作用。Giridhar課題組[12]于2012年,通過四步反應合成了一系列的2一氨基嘧啶化合物,其中一個化合物藥效是阿司匹林的兩倍。Okuda課題組[13-16]合成了一系列三環和五環嘧啶衍生化合物,這些嘧啶衍生物可以被用作體外血小板聚集的抑制劑。
總結與展望
抗血小板治療的藥物開發是一個重要的研究領域,現有的抗血小板藥物合成方法通常步驟較多,因此很有必要探索新的合成方法,從而有效降低其生產成本。隨著我們對抗血小板藥物構效關系的更加明確,相信在不久的將來,能夠開發出更加安全、有效的抗血栓形成的藥物。
[參考文獻]
[1 ]Ageno W, Gallus A S,Wittkowsky A. et al.[J]. Chest,2012,141(2):44.
[2]Fan P,Gao Y, Zheng M, et al.[J]. Journal of ThoracicDisease, 2018,10(3):2011-2025.
[3] Belloc C,Lu H. Soria C,et al.[J].International Journal ofCancer,1995, 60(3):413-417.
[4] Boucharaba A,Serre C M,Sandra Gres, et al.[J].Journalof Clinical Investigation, 2005, 114(12):1714-1725.
[5] Wenzel J,Zeisig R, Fichtner I.[J].Clinical&Experimen-tal Metastasis. 2010,27(1):25-34.
[6] Angiolillo D J,Capodanno D,Goto S.[J].European HeartJournal. 2010,31(1):17-28.
[7] Bruno O, Schenone S,Ranise A, et al.[J]. Bioorganic&Medicinal Chemistry, 2001,9(3):629-636.
[8] Bruno O, Brullo C, Schenone S,et al.[J]. Bioorganic&Medicinal Chemistry, 2004,12(3):553-561.
[9] Bruno O, Brullo C, Schenone S,et al.[J]. Bioorg MedChem,2006,14(1):121-130.
[10]Niknam K, Borazjani N.[J]. Monatshefte fur Chemie -Chemical Monthly, 2016,147(6):1129-1135.
[11]Liu G,Xu J,Park K C,et al.[J]. Tetrahedron, 2011.67(29):5156-5161.
[12]Giridhar R. Tamboli R S,Ramajayam R, et al.[J]. Euro-pean Joumal of Medicinal Chemistry, 2012,50(33):428-432.
[13] Kensuke Okuda, Takashi Nikaido, Takashi Hirota. [J].Cheminform, 2013, 44(31):1619-1625.
[14] Kensuke Okuda, Jun-ichi Takano, Takashi Hirota. [J].Journal of Heterocyclic. Chemistry, 2014, 51(3):661-668.
[15] Okuda K, Hirota T,Sasaki K.[J].Journal of HeterocyclicChemistry,2015,51(6): 1607-1614.
[16] Okuda K, Zhang Y X. Hirota T,et al.[J]. Journal of Het-erocyclic Chemistry, 2015, 52(3):888-895.

