循環(huán)血CCL2、CCL5、CXCL10在HBV相關性肝病中表達水平的差異及相關性分析
陳星,戢敏,喻雪琴,陳芳,梅怡晗,楊旺春
(1.川北醫(yī)學院附屬醫(yī)院感染科,四川 南充 637000;2.首都醫(yī)科大學朝陽醫(yī)院,北京 610041;3.岳池縣人民醫(yī)院感染科,四川 廣安 638350)
趨化因子是一種由免疫細胞產生的具有趨化白細胞功能的細胞因子,可上調整合素的表達水平,還能促進細胞脫顆粒和生物活性物質釋放,促進細胞增殖的作用[1],其在炎癥、肝組織纖維化、腫瘤逃逸、血管生成等機體多種病理生理過程中發(fā)揮主導作用,部分趨化因子及其衍生物或抑制物具有潛在的臨床應用前景。按照N末端前2 個半胱氨酸位置不同,趨化因子分為4大類:CC亞族、C亞族、CXC 亞族、和CX3C亞族。其中,CCL2是炎癥啟始因子,它與單核細胞表面受體CCR2結合,使單核細胞聚集到炎癥的發(fā)生部位,誘導與促進組織炎癥的發(fā)生[2];CCL5能驅化T淋巴細胞、 NK細胞,進而調節(jié)免疫功能。HBV感染后形成的慢性肝組織炎癥是以Th1型細胞釋放的促炎性因子介導為主,而CCL5通過調控Th1細胞釋放促炎性因子,從而達到對肝組織炎癥的調節(jié)作用。此外,趨化因子中的CCL5及其配體還可通過調節(jié)T淋巴細胞的免疫作用,從而促進肝星狀細胞(HSC)的活化、增殖及浸潤來調控肝組織纖維化的形成[3]。趨化因子中的CXCL10也參與了對T淋巴細胞一系列調控作用,從而導致病毒持續(xù)存在及肝組織炎癥的發(fā)生、發(fā)展[4]。本研究的目的是了解CCL2、CCL5、CXCL10在HBV相關性肝病患者中的差異表達及其臨床意義,以期找到HBV相關性肝病治療的新思路與方法。
1 資料與方法
1.1 資料
選取2017年01月至2017年12月在川北醫(yī)學院附屬醫(yī)院治療的乙肝病毒攜帶者20 例(男性13 例,女性7 例),年齡18~60 歲,平均年齡38.6 歲;慢性乙型肝炎患者75 例,其中慢性乙型肝炎輕度30 例(男性24 例,女性6 例),年齡18~61 歲,平均年齡38.9 歲,慢性乙型肝炎中度25 例(男性16 例,女性9 例),年齡18~62 歲,平均年齡39.1 歲,慢性乙型肝炎重度20 例(男性14 例,女性6 例),年齡18~63 歲,平均38.2 歲;重型乙型肝炎患者20 例(男性15 例,女性5 例),年齡18~60 歲,平均39.7 歲;HBV相關肝硬化患者20 例(男性14 例,女性6 例),年齡18~67 歲,平均38.9 歲;乙肝肝癌患者20 例(男性16 例,女性4 例),年齡18~65 歲,平均39.2歲。
納入標準:(1)患者知情同意;(2)HBV相關性肝病診斷需符合中華醫(yī)學會制定的標準[5];(3)入院時未接受免疫調節(jié)和抗病毒治療。排除標準:(1)排除其它嗜肝病毒感染以及其它原因所致的肝組織炎癥;(2)合并其它疾病與非嗜肝病毒感染。選取同期20 例無HBV感染的健康志愿者為對照組(男性15 例,女性5 例),年齡18~62歲,平均9.4歲,HBV相關性肝病患者與對照組在年齡、性別比較差異無統(tǒng)計學意義(P>0.05)。
1.2 方法
所有研究對象均于入院后治療前采集靜脈血5 mL并分作兩份,1 份自然抗凝后以1 000 r/min 離心10 min,取上清液采用酶聯(lián)免疫吸附法測定血清中CCL2、CCL5、CXCL10水平,檢測試劑盒購于武漢新啟迪生物科技有限公司;HBV血清標志物檢測使用Abbott/AxSYM試劑盒檢測HBV感染標志物;HBV-DNA采用Mx3000 p 熒光實時定量PCR儀(美國Stratagene 公司) 檢測;肝功能采用 7600-020全自動生化分析儀檢測,嚴格按試劑盒說明書操作。
1.3 統(tǒng)計學分析
2 結果
2.1 慢性乙型肝炎患者循環(huán)血CCL2、CCL5、CXCL10表達水平與病情程度間的相關性分析
慢性乙型肝炎患者輕、中、重度組循環(huán)血CCL2、CCL5、CXCL10的表達水平與乙肝病毒攜帶者、健康對照組比較顯著升高,且慢性乙型肝炎患者重度組水平最高,五者間比較,F(xiàn)值分別為824.90,595.51,810.41,差異具有統(tǒng)計學意義(P<0.01)。見表1。
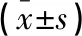

組別例數CCL2(pg/mL)CCL5(pg/mL)CXCL10(pg/mL)健康對照組2037.46±1.4447.35±1.6135.47±2.92乙肝病毒攜帶組2036.59±1.9445.93±2.0134.60±2.04慢性乙型肝炎輕度組3050.90±3.76?61.30±4.22?53.33±5.75?慢性乙型肝炎中度組2560.41±3.33#77.14±4.41#82.06±3.51#慢性乙型肝炎重度組20 81.77±2.79△90.66±4.05△102.30±7.30△F值824.90595.51810.41P值0.0010.0010.001
*P<0.05,與對照組相比;#P<0.05,與輕度組相比;△P<0.05,與中度組相比。
2.2 HBV相關性肝病患者間循環(huán)血CCL2、CCL5、CXCL10表達水平差異的相關性分析
在HBV相關性肝病患者間,隨著病情加重其循環(huán)血CCL2、CCL5、CXCL10表達水平呈逐漸升高趨勢,且重型乙型肝炎組升高水平最明顯,六組間比較,F(xiàn)值分別為226.77、196.14、133.09,其差異具有統(tǒng)計學意義(P<0.01)。見表2。
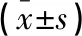

組別例數CCL2(pg/mL)CCL5(pg/mL)CXCL10(pg/mL)健康對照組2037.46±1.4447.35±1.6135.47±2.92乙肝病毒攜帶者組2036.59±1.9445.93±2.0134.60±2.04慢性乙型肝炎組7562.15±12.93?74.41±12.69?75.96±20.94?重型乙型肝炎組25102.73±5.52#108.74±8.81#121.35±7.26#HBV相關性肝硬化組2091.25±3.96△102.28±6.17△107.13±8.56△HBV相關性肝癌組20101±7.76▲108.26±7.68▲109.08±11.36F值226.77196.14133.09P值0.0010.0010.001
*P<0.05,與對照組相比;#P<0.05,與慢性乙型肝炎組相比;△P<0.05,與重型肝炎相比組相比;▲P<0.05,與肝硬化相比。
2.3 HBV相關性肝病患者循環(huán)血CCL2、CCL5、CXCL10表達水平與HBV-DNA載量間的關系
慢性乙型肝炎組患者循環(huán)血CCL2、CCL5、CXCL10水平與HBV-DNA載量呈正相關系(r值分別為0.32、0.3、0.41,P<0.05);HBV相關性肝癌組CCL2水平與HBV-DNA載量呈正相關系(r值為0.57,P<0.05),其余各HBV相關性肝病組的CXCL10、CCL2、CCL5水平與HBV-DNA載量無相關關系(P>0.05)。見表3。
表3HBV相關性肝病患者循環(huán)血CCL2、CCL5、CXCL10表達水平與HBV-DNA載量間的關系

HBV-DNA(ng/mL)CCL2(ng/mL)r值P值CCL5(ng/mL)r值P值CXCL10 (ng/mL)r值P值健康對照組//////乙肝病毒攜帶者組0.250.28-0.020.940.230.34慢性乙型肝炎組0.320.010.370.010.410.00 慢性乙型重型肝炎組0.320.16-0.340.14-0.150.52HBV相關性肝癌組0.570.010.200.410.240.32HBV相關性肝硬化組-0.090.720.030.90-0.050.82
2.4 HBV相關性肝病患者循環(huán)血CCL2、CCL5、CXCL10表達水平間的關系
慢性乙型肝炎組CCL2、CCL5、CXCL10表達水平間呈正相關系(r值為0.88、0.88,P<0.05),其余各HBV相關性肝病患者組CCL2、CCL5、CXCL10表達水平間無相關關系(P>0.05)。見表4。
表4HBV相關性肝病患者循環(huán)血CCL2、CCL5、CXCL10表達水平間的關系

CXCL10 (ng/mL)CCL2(ng/mL)r值P值CCL5(ng/mL)r值P值健康對照組-0.160.490.460.04乙肝病毒攜帶者組0.300.19-0.340.14慢性乙型肝炎組0.880.000.880.00慢性乙型重型肝炎組0.260.29-0.530.02HBV相關性肝癌組-0.150.54-0.140.95HBV相關性肝硬化組-0.260.26-0.330.16
3 討論
HBV相關性肝病是以肝組織炎性細胞浸潤或肝組織纖維化為特征的慢性感染性疾病,特異性細胞毒性T淋巴細胞(CTL)參與對HBV的清除作用。對慢性乙型肝炎患者循環(huán)血研究發(fā)現(xiàn),CCL2、CCL5、CXCL10等表達水平升高明顯,并且隨著肝組織炎癥好轉,趨化因子表達水平可降至正常。肝組織纖維化是HBV相關性肝病慢性化后的共同病理過程,如肝纖維化得不到有效控制可引起肝硬化。有研究表明[6],趨化因子一方面通過召集炎性細胞聚集,誘導激活、增殖肝星狀細胞,另一方面抑制纖維蛋白溶解酶活性,阻止肝細胞外細胞基質或纖維組織分解,導致肝纖維化形成、肝硬化的發(fā)生發(fā)展。HBV相關性肝細胞癌是肝組織中常見的惡性腫瘤,乙肝肝細胞癌本質上是肝組織炎癥反復刺激與持續(xù)發(fā)生與基因突變的結果之一,同時也是趨化因子召集炎性細胞聚集后對肝組織長期損傷的結果。腫瘤細胞產生的趨化因子能夠驅化免疫細胞到腫瘤部位參與宿主特異性抗腫瘤反應,同時產生的趨化因子又能激活腫瘤炎癥的發(fā)生,從而發(fā)生趨化因子介導下的惡性循環(huán)[7]。
本研究結果顯示,慢性乙型肝炎患者輕、中、重度組循環(huán)血CCL2、CCL5、CXCL10的表達水平與乙肝病毒攜帶者、健康對照組相比較,呈顯著升高,慢性乙型肝炎患者重度組水平最高,五者間比較,F(xiàn)值分別為824.90,595.51,810.41,差異有統(tǒng)計學意義(P<0.01),且隨著炎癥程度的加重而表達水平升高明顯,表明3種趨化因子在肝組織中有重要的炎癥調控作用。CCL2是肝臟炎癥發(fā)生起的始因子,張浩等[8]研究表明CCL2驅化巨噬細胞和單核細胞進入肝細胞內,清除乙肝病毒的同時誘導肝組織炎癥反應的發(fā)生與持續(xù),并且還可反應肝組織炎癥及纖維化程度,這與本實驗結果相符。CCL5是另一種常見的趨化因子,它主要表達于肝星狀細胞,當CCL5與肝星狀細胞上的受體CCR5結合時激活肝星狀細胞,誘發(fā)肝組織纖維化的發(fā)生。Zimmermann等[9]研究發(fā)現(xiàn)CCR5可以通過PI3K及氧化還原途徑來促進肝星狀細胞遷徙,在使用CCR5抑制劑或CCL5受體拮抗劑可明顯改變肝組織纖維化程度[10]。同時本研究發(fā)現(xiàn),CXCL10隨著慢性乙型肝炎炎癥程度加重其表達水平增加明顯,表明CXCL10也參與了肝組織炎癥的發(fā)生、發(fā)展。HBV感染肝細胞后,刺激肝細胞或肝臟血管內皮細胞表達大量的趨化因子CXCL10,同時CXCL10刺激受體CXCR3,使表達CXCR3的T細胞轉移到感染后的肝細胞,誘導肝細胞的損傷與炎癥反應的發(fā)生。有學者通過免疫組織化學法檢測CHB患者的CXCL10及CXCR3,發(fā)現(xiàn)兩者含量的增加是預測肝組織纖維化程度的獨立危險因素[11]。在分析HBV相關性肝病患者間循環(huán)血CCL5、CCL2、CXCL10表達水平差異時發(fā)現(xiàn),循環(huán)血CCL2、CCL5、CXCL10的表達水平間差異具有顯著的統(tǒng)計學意義(P<0.05),在HBV相關性肝病患者間,隨著病情加重其循環(huán)血CCL5、CCL2、CXCL10表達水平呈逐漸升高趨勢,且重型乙型肝炎組表達水平最高,顯示在肝組織炎癥加重時,趨化因子的表達水平同樣增加明顯。本研究發(fā)現(xiàn),HBV相關性重型肝炎及HBV相關性肝癌組的CCL2、CCL5、CXCL10峰度最高,作者認為可能與HBV相關性重型肝炎發(fā)生時,大量肝細胞壞死的同時釋放大量的的CCL2、CCL5、CXCL10,同時誘導TB淋巴細胞聚集在肝組織處,加重肝細胞損傷,以此形成惡性循環(huán)。但在肝臟癌癥發(fā)生時,癌細胞旁的巨噬細胞等通過釋放大量的IL-10、生長因子-β(transforming growth factor-beta,TGF-β)等細胞因子,干擾正常的抗腫瘤免疫,最終引起腫瘤細胞大量生長[12],同時肝癌細胞分泌大量的CCL2、CCL5、CXCL10趨化因子,這些驅化因子又可驅化免疫細胞來清除癌細胞。
HBV感染肝細胞后,肝臟免疫系統(tǒng)被激活,大量的CCL2、CCL5、CXCL10等趨化因子被釋放,誘發(fā)系列免疫反應、肝組織發(fā)生炎癥損傷。因此HBV-DNA載量與趨化因子表達水平、各個趨化因子之間有著千絲萬縷的關系。本研究發(fā)現(xiàn),慢性乙型肝炎組患者 HBV-DNA載量與CCL2、CCL5、CXCL10成明顯的正相關(P<0.05),這符合王亞東等[13-14]的研究結果。同時,王亞東等[13]研究發(fā)現(xiàn),慢性乙型肝炎患者循環(huán)CXCL10在乙肝患者的免疫耐受期、清除期,以及重度肝炎期呈依次升高趨勢,重度肝炎期升高最顯著。Zhou等[15]學者研究發(fā)現(xiàn),HBx能使核因子NF-KB發(fā)生錯位,從而使CCL2、CCL5、CXCL10等趨化因子基因的啟動子區(qū)域-122到-133段與NF-KB結合,誘導促進了趨化因子轉錄。同樣在慢性乙型肝炎組,CCL2、CCL5與CXCL10成明顯的正相關(r值0.88,P<0.05),但重型肝炎組、肝硬化組、肝癌組趨化因子與HBV DNA、趨化因子間無明顯相關性,這可能與在肝臟疾病慢性化、纖維化后期,趨化因子的釋放產生與HBV的刺激、肝細胞不斷的壞死與再生、宿主免疫功能差異等有關,但HBV與趨化因子的相互作用機制、趨化因子之間相互關系究竟如何,尚需進一步研究。
綜上,雖然趨化因子已被發(fā)現(xiàn)與HBV相關性肝病關系密切,但其在HBV感染后機體免疫應答調節(jié)機制中的具體方式與功能;在HBV感染慢性化、重癥化、纖維化及肝細胞癌變等具體機制;趨化因子及其受體之間以及趨化因子之間的調控機制等方面都有待進一步探索。此外,趨化因子抑制劑、拮抗劑有可能成為治療HBV相關性肝病的一種新途徑。

