纖維蛋白原與多發性骨髓瘤患者預后的關系
翟紅,趙國江,鄒興立,劉洋,魏錦
(1.川北醫學院臨床醫學系,四川 南充 637000;2.攀枝花市中心醫院血液內科,四川 攀枝花 617000)
多發性骨髓瘤(multiple myeloma,MM)是一種漿細胞惡性腫瘤性疾病,其發病率占血液系統腫瘤的10%,僅次于淋巴瘤[1],居第二位。好發于中老年人,男性多于女性[2]。目前,該病沒有有效辦法可以治愈,其預后不一,生存期從數天到數十年不等。很多因素與骨髓瘤的預后相關,如年齡、血紅蛋白水平、β2-MG水平、白蛋白水平、肌酐、ISS分期等。纖維蛋白原(fibrinogen,FIB),即凝血因子I,是一種由肝臟合成并分泌的糖蛋白,也是血漿中含量最高的凝血因子,正常人血漿中濃度為2~4 g/L。其在凝血酶的作用下轉變為纖維蛋白,從而使血液凝固。研究[3-7]表明,FIB在多種惡性腫瘤中存在高表達,且與腫瘤的分期、治療反應、預后等密切相關。劉瑞萍等[8]研究顯示,與健康體檢者對照組相比,骨髓瘤患者血漿中FIB水平明顯升高,且I期、II期MM患者的血漿FIB水平顯著低于III期患者,治療有效者,血漿FIB水平較治療前明顯降低。但關于FIB與多發性骨髓瘤患者預后關系的研究較少。本研究擬通過分析多發性骨髓瘤患者血漿中FIB水平與預后相關因素的關系,探討其在MM患者預后中的意義。
1 資料與方法
1.1 資料
選取2010年1月至2015年12月在川北醫學院附屬醫院初診的多發性骨髓瘤患者117例,診斷標準均符合《血液病診斷及療效判斷標準》。患者在治療前均有完整臨床資料并堅持隨訪,排除意義未明的單克隆丙種球蛋白病、無癥狀性骨髓瘤、嚴重感染、嚴重活動性出血、漿細胞白血病的患者。最終有84 例患者入組,其中男性53 例,女性31 例,年齡41~88 歲,中位發病年齡為60 歲。
1.2 方法
收集確診為多發性骨髓瘤患者的初診化療前的Hb、β2-MG、Cr、ISS分期等指標,隨訪截止至2016年12月31日。總體生存期(overall survival,OS)指從確診開始到死亡或者隨訪結束的時間。
1.3 統計學分析
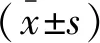
2 結果
2.1 多發性骨髓瘤患者FIB最佳臨界值及與患者臨床指標的關系
84 例骨髓瘤患者FIB均值為3.51 g/L,標準差為1.10,符合正態分布。取均值3.51 g/L為臨界值,將84 例患者分為高FIB組(FIB>3.51 g/L)和低FIB組(FIB≤3.51 g/L),其中高FIB組37例,低FIB組47例。低FIB與高FIB組患者在性別、β2-MG水平的差異有統計學意義(P<0.05),與低FIB組相比,高FIB組男性比例更高,β2-MG水平偏高。而在年齡、ISS分期、Hb、Cr、骨髓瘤類型、ALB水平、骨髓中瘤細胞比例、治療方案等方面比較,差異無統計學意義。見表1。

表1 MM患者FIB與其他臨床指標的關系[n(%)]
2.2 多發性骨髓瘤患者FIB與生存期的關系
全程隨訪84 例患者,高FIB組其中位生存時間為38個月,低FIB組與高FIB組相比,其中位生存時間明顯延長,差異有統計學意義(χ2=4.251,P<0.05)。見圖1。

2.3 危險因素分析
利用Cox比例風險回歸模型,將84 例MM患者進行單因素危險因素分析,結果表明,FIB>3.51 g/L、Cr、骨髓中瘤細胞比例升高是多發性骨髓瘤患者預后不良的危險因素(P<0.05)。見表2。進一步多因素分析表明FIB>3.51 g/L、Cr、骨髓中瘤細胞比例升高、ALB降低是影響MM患者預后的獨立危險因素(P<0.05)。見表3。

表2 多發性骨髓瘤患者總生存期單因素分析

表3 多發性骨髓瘤患者總生存期多因素分析
3 討論
多發性骨髓瘤是來源于漿細胞的惡性腫瘤,不同患者的預后存在顯著差異,且影響患者預后的因素很多,主要包括β2-MG、血清ALB水平、Hb、Ca、M蛋白水平、Cr、骨骼破壞情況等。基于上述因素建立的兩個分期標準Durie-Salmon分期標準(DS分期)和ISS分期標準目前在臨床上廣泛應用。但這兩個分期標準均存在不足,如DS分期的影像學結果受主觀影響較大;ISS分期中II、III期的分層效果不明顯等[9]。細胞遺傳學異常是影響多發性骨髓瘤患者預后的重要因素,1號染色體斷臂(1p)缺失與骨髓瘤患者不良預后相關,進一步的研究通過熒光原位雜交技術(fluorescence in situ hybridization,FISH)證實, 1p21,1p22和1p32的缺失是不良預后的獨立危險因素[10]。Larsen等[11]研究表明,骨髓瘤患者初診時漿細胞標記指數是骨髓瘤患者獨立的預后因素。但這些檢查對實驗室的要求較高,且價格昂貴,難以廣泛開展。因此,尋找更為簡便、經濟、實用的指標用于判定骨髓瘤患者預后尤為重要。
近幾年,越來越多的研究表明,治療前FIB水平與多種實體腫瘤比如卵巢癌[12]、食管鱗癌[13]、陰莖癌[14]、小細胞肺癌[15]等的預后密切相關。研究[12]顯示,在卵巢癌患者中,與FIB≤450.0 mg/dl,FIB>450.0 mg/dl的患者腫瘤分期偏晚,且術后殘留更多腫瘤組織,無病生存期(disease-free survival,PFS)和總體生存時間均明顯縮短。Ma等[14]研究表明,術前較高的FIB水平與陰莖癌患者不良預后密切相關,提示術前FIB水平可能是判斷陰莖癌預后的獨立指標。FIB與多發性骨髓瘤患者預后關系的研究尚較少。本研究顯示,與低FIB組(FIB≤3.51 g/L)相比,高FIB組(FIB>3.51 g/L)中男性患者比例更高、β2-MG水平較高、中位生存時間縮短。單因素和多因素分析表明,FIB升高是影響多發性骨髓瘤患者預后的獨立危險因素。FIB在多發性骨髓瘤患者中升高可能與其血液呈高凝狀態有關。亦有研究認為[15-16],FIB升高可能與腫瘤細胞產生癌促凝物質,癌促凝物質可以不依賴凝血因子Ⅶ而直接激活凝血因子Ⅰ即FIB有關。FIB升高常常提示預后不良,但其機制尚未完全明確。另有研究認為[17],FIB可能參與腫瘤細胞與內皮細胞的粘附,從而參與腫瘤的血行轉移。此外,FIB片段可能促進腫瘤新生血管形成,且FIB在腫瘤組織中沉積可作為腫瘤細胞粘附和轉移的細胞外基質,促進腫瘤的侵襲和轉移[18-19]。FIB-血小板微血栓可能還有保護腫瘤細胞對抗宿主免疫監視系統的作用,從而導致腫瘤細胞的生長和發展[20]。
本研究結果還顯示,FIB與患者性別有關,這可能是由于樣本數量較少所致。FIB與β2-MG相關,可能與腫瘤組織細胞破壞釋放毒素對血管內皮損傷、腫瘤血管過度增生等導致其具有不同程度的凝血和纖溶異常,而β2-MG在惡性腫瘤中合成和釋放增多有關[21]。單因素分析發現,FIB>3.51 g/L、Cr、骨髓中瘤細胞比例升高是多發性骨髓瘤患者預后不良的危險因素,但本研究未表明年齡、治療方案、ISS分期與預后相關,可能也與樣本量較少有關,進一步加大樣本量,相關性可能會顯現出來。
綜上所述,FIB可以作為多發性骨髓瘤患者預后判斷的一個獨一危險因素,FIB升高提示預后不良,總體生存期縮短。凝血功能檢測操作簡單,費用較低,其聯合血常規、肝腎功能、骨髓形態學等檢查,對多發性骨髓瘤的早診斷、早治療及判斷患者預后具有重要價值,可廣泛用于臨床實踐。

