小鼠生殖細胞特異性轉錄因子SOHLH1調控Sox30基因表達的機制
齊婉婧,孫 奇,李 媛,張 雪,金美玉,何 巖,鄭志紅
(中國醫科大學實驗動物部,沈陽 110001)
雄性生殖細胞經歷一系列特定基因程序性表達,使具有有絲分裂活性的原始生殖細胞發育為成熟精子的過程被稱為精子發生。精子發生起源于精原干細胞,經歷精原細胞的有絲分裂期和精母細胞的減數分裂期[1],在精子形成期圓形精子細胞經歷復雜的結構重塑最終成為成熟精子[2]。精卵發生特異表達螺旋-環-螺旋轉錄因子1 (Spermatogenesis- and oogenesis-specific bHLH transcription factor-1,Sohlh1)編碼357個氨基酸含有一個bHLH結構域,SOHLH1可以形成異源二聚體或同型二聚體并與DNA上的E-box序列(CANNTG)結合[3]調控下游基因表達。SOHLH1在雄性生殖細胞中特異表達,主要表達于A1-A4型精原細胞,在Int型及B型精原細胞中該蛋白逐漸消失[4]。SOHLH1是涉及精原細胞分化的重要轉錄因子[4],調控c-Kit表達[5]、與SOHLH2形成異源二聚體下調Stra8表達[6-8]并參與精子發生相關的重要信號通路[9]從而影響精原細胞發育和減數分裂。本課題組前期研究發現Sohlh1基因敲除純合子雄性小鼠不育,精原細胞發育及分化異常導致進入減數分裂的精母細胞減少,精母細胞大量凋亡,無成熟精子產生。基因芯片檢測結果顯示出生后7天野生型雄鼠與Sohlh1基因敲除雄鼠睪丸組織中Sox30、Rnf17等精子發生中關鍵基因均出現表達差異[10],推測SOHLH1可能直接或間接調控Sox30基因轉錄。
Sox30是睪丸生殖細胞特異表達基因Sox(Sry-related High Motility Group (HMG) box)家族H亞族唯一的成員,含有3個外顯子,編碼蛋白具有一個HMG box結構域[11],參與性腺發生、精子發生[12]并且與頂體形成相關[13]。Sox30基因敲除雄性小鼠無生育能力,精子發生阻滯于精子形成期,圓形精子細胞核表面沒有參與頂體形成的頂體顆粒[14]。目前,關于轉錄因子調控Sox30表達未見文獻報道。我們利用生物信息學預測Sox30基因上游啟動子區域,發現存在SOHLH1轉錄因子結合的E-box序列,本研究旨在探究精原細胞早期發育相關的重要轉錄因子SOHLH1參與精子發生后期相關基因Sox30的轉錄調控機制,并進一步篩選Sox30基因啟動子序列上SOHLH1特異性結合位點的DNA序列。
1 材料和方法
1.1 實驗動物
本實驗中共使用7周齡的SPF級C57BL/6J雄性小鼠9只(三次重復實驗),體重約22~24 g(誤差不大于10%),來源于中國醫科大學實驗動物部[SCXK(遼) 2018-0004]。取材在中國醫科大學實驗動物科學部屏障動物實驗設施進行[SYXK(遼)2018-0008],并按實驗動物使用的3R原則給予人道的關懷。本實驗經中國醫科大學實驗動物福利與倫理委員會(Institutional Animal Care and Use Committee, IACUC)審查通過,審批編號:No. 2017018。
1.2 主要試劑與儀器
Tris平衡酚(鼎國生物技術有限公司,北京),PCR引物(Genescript,南京),Q5? High-Fidelity DNA Polymerase(Cat.#M0491S,NEB,美國),Axygen mini-prepare 質粒提取試劑盒(Cat.AP-MN-P-50)、AxyPrep DNA凝膠回收試劑盒(Cat.AP-GX-50)、AxyPrep PCR清潔試劑盒(Cat.AP-PCR-50)(Axygen,美國),pMD18-T Vector、E.coliDH5α感受態大腸桿菌、限制性內切酶HindⅢ和KpnⅠ(寶生物公司,大連),pGL3-Basic質粒、pRL-TK質粒(Promega,美國),T4DNA連接酶(NEB,美國),pcDNA3.0-Sohlh1真核表達質粒(本課題組構建)[15],轉染試劑LipofectamineTM3000(Invitrogen,美國),Dual-Luciferase? Report Assay Systerm試劑盒(Cat.# E1980,Promega,美國),EZ-ChIPTM-Chromatin Immunoprecipitation Kit試劑盒(Cat#17-371RF,Millipore,美國),SOHLH1抗體(3∶50,ab41520,Abcam,美國),PCR儀(Bio-Rad,美國),Galaxy R二氧化碳培養箱(RS Biotech,德國),多功能酶標儀(M200 PRO,Tecan,瑞士)。
1.3 實驗方法
1.3.1 基因組DNA提取
剪取成年C57BL/6J雄鼠0.5 cm鼠尾組織,放入1.5 mL 離心管中并分別加入500 μL鼠尾消化液和5 μL蛋白酶K,55℃水浴鍋中消化過夜。鼠尾消化液配置方法如下:取NaCl 2.93 g,SDS 2.5 g,1 mol/L Tris-HCl(pH 8.0)5 mL,0.5 M EDTA(pH 8.0)10 mL混勻后定容至500 mL。酚氯仿法提取基因組DNA,產物4℃保存。
1.3.2Sox30基因啟動子區域SOHLH1結合位點分析及引物設計
針對Sox30轉錄起始位點上游2000 bp范圍內啟動子DNA序列使用Jasper軟件預測SOHLH1特異性結合位點E-box(CANNTG),根據評分及位點分布設計合成引物,構建三個啟動子熒光表達質粒1784 bp-Sox30-promoter、984 bp-Sox30-promoter、876 bp-Sox30-promoter,啟動子區域PCR引物序列為Sox30-JD1784-F:5’-TCTGCTTGATATCCTTCCCTTT CA-3’,Sox30-JD1784-R:5’- GTGCGAGAACCCTGG AATCA-3’,Sox30-JD984-F:5’-TTACTCAACAGTCG GCAC-3’,Sox30-JD984-R:5’-CGAGAACCCTGGAA TCAT-3’,Sox30-JD876-F:5’- AAGCACTTCAAAGGA CAT-3’,Sox30-JD876-R:5’- CGAGAACCCTGGAA TCAT-3’。
1.3.3 PCR擴增Sox30基因啟動子片段
以C57BL/6J雄鼠鼠尾DNA為模板進行PCR擴增,在50 μL PCR反應總體系內使用Q5? High-Fidelity DNA Polymerase擴增所需DNA片段,反應條件:98℃ 8 s,54℃ 30 s,72℃ 1 min,30個循環,72℃延伸10 min。1.5%瓊脂糖凝膠電泳進行PCR擴增產物檢測,切膠回收目的片段。
1.3.4 構建Sox30啟動子全長和截短序列的pGL3-Sox30熒光素酶報告質粒
純化回收的DNA片段與pMD18-T Vector 16℃連接過夜。連接產物轉化E.coliDH5α感受態大腸桿菌,提取質粒DNA進行測序,篩選正確連接的菌種提取質粒。限制性內切酶HindⅢ和KpnⅠ雙酶切所提取的Sox30質粒DNA和pGL3-Basic質粒載體骨架,使用TaKaRa公司說明書提供的雙酶切體系。T4DNA連接酶反應體系16℃連接過夜,連接產物轉化感受態大腸桿菌,挑菌落克隆提取質粒DNA,測序鑒定。
1.3.5 轉染293T細胞并檢測雙熒光素酶報告基因系統熒光素酶活性
于37℃、5% CO2的培養箱中培養HEK293T細胞,當細胞處于對數生長期時,將細胞接種于96孔板中培養16 h,匯合度達到80%時進行轉染。將構建好的pGL3-Sox30啟動子螢光素酶報告質粒(0.4 μg/孔)、pcDNA3.0-Sohlh1真核表達質粒(0.4 μg/孔)和內參pRL-TK質粒(0.008 μg/孔)按照LipofectamineTM3000實驗手冊共轉染293T細胞。
37℃、5% CO2在培養箱中培養48 h后,將共轉染的HEK293T細胞取出,棄掉96孔板中培養基,每孔加入100 μL 1×PBS清洗細胞,棄掉PBS。根據Dual-Luciferase? Report Assay Systerm操作手冊指導,樣品放入M200 PRO多功能酶標儀檢測螢火蟲熒光素酶活性及海腎熒光素酶活性,保存數據進行計算及統計分析。
1.3.6 染色質免疫共沉淀(ChIP)實驗篩選SOHLH1結合位點
頸椎脫位法處死成年C57BL/6J雄鼠取雙側睪丸組織剝離出曲細精管,實驗方法參照文獻所述[10],甲醛處理新鮮睪丸組織DNA與蛋白交聯,按照EZ-ChIPTM- Chromatin Immunoprecipitation Kit試劑盒說明書提取SOHLH1抗體結合的DNA片段。根據雙熒光素酶報告基因實驗篩選出的Sox30核心啟動子片段及SOHLH1結合位點設計ChIP實驗所需qRT-PCR引物(引物序列分別為ChIP-892 bp-105F:5’-ATTACTCAACAGTCGGCACTGG-3’,ChIP-892 bp-105R:5’- TGTGTGATTATTCTGCGCCTC-3’,ChIP-837 bp-177F:5’- GAGGCGCAGAATAATCAC-3’,ChIP-837 bp-177R:5’- AGGACGCTTTAGCAAG TC-3’,ChIP-449 bp-101F:5’- GGAGGTAGTGGGAC ATAG-3’,ChIP-449 bp-101R:5’- CCACCATTATCCT GCTTA-3’, ChIP-514 bp-151F:5’- GGTTTATCAG GCTCTGC-3’,ChIP-514 bp-151R:5’-TTGCTCT TCACCTATGT-3’)。
1.4 統計學方法
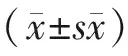
2 結果
2.1 構建pGL3-Sox30啟動子區域熒光素酶報告質粒
以C57BL6/J小鼠基因組DNA為模板,PCR擴增得到長度分別為1784 bp、984 bp和876 bp的啟動子區域DNA片段,雙酶切后使用T4DNA 連接酶與pGL3-Basic載體連接。質粒DNA經測序并進行序列比對,證實連入載體中的啟動子片段與預期一致,獲得目標序列正確連接的pGL3-Sox30-876 bp、pGL3-Sox30-984 bp和pGL3-Sox30-1784 bp質粒。如圖1所示。

注:M:TaKaRa DL2000 Maker;孔道1:Sox30啟動子1784 bp目的片段;孔道2:Sox30啟動子984 bp目的片段;孔道3:Sox30啟動子876 bp目的片段。圖1 Sox30啟動子DNA序列PCR擴增產物電泳Note. M, TaKaRa DL2000 Maker. Lane 1, Sox30 promoter 1784 bp target fragment. Lane 2, Sox30 promoter 984 bp target fragment. Lane 3, Sox30 promoter 876 bp target fragment.Figure 1 Sox30 promoter DNA sequence via PCR amplification of the electrophoresis products
2.2 雙熒光素酶實驗驗證轉錄因子SOHLH1對Sox30基因啟動子區的轉錄調節作用
將構建好的pGL3-Sox30啟動子區域螢光素酶報告質粒、pcDNA3.0-Sohlh1真核表達質粒和內參TK共同轉染293T細胞,檢測不同啟動子片段的熒光素酶活性,進行統計分析比較(圖2)實驗結果顯示,共同轉染Sox30啟動子熒光表達載體和pcDNA3.0-Sohlh1真核表達質粒的實驗組與轉染pGL3-Basic空載載體的對照組相比,實驗組的熒光強度有不同程度增強,SOHLH1可以激活Sox30基因轉錄,證明該基因存在延時翻譯現象。共轉染了pGL-Sox30-876 bp質粒的實驗組熒光活性最強,推測Sox30核心啟動子片段位于區域內。
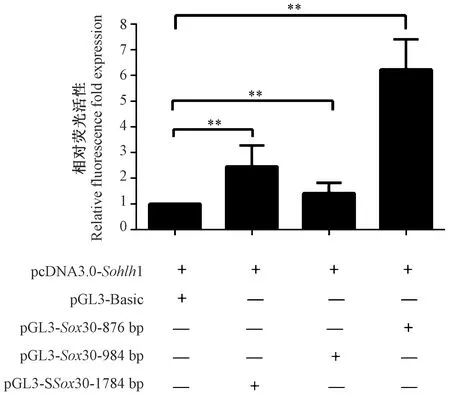
注:誤差線代表重復實驗的平均數±標準誤差;**P<0.01。圖2 轉錄因子SOHLH1對Sox30基因啟動子序列轉錄調控作用Note. Error bars represent the mean ± standard error of repeated experiments. **P<0.01.Figure 2 Transcriptional regulation of the Sox30 gene promoter sequence by the transcription factor SOHLH1
2.3 ChIP實驗篩選轉錄因子SOHLH1與Sox30基因啟動子區的主要結合位點
ChIP實驗中與SOHLH1抗體結合的DNA片段洗脫純化后qRT-PCR進行檢測。ChIP結果(見圖3)顯示SOHLH1可以結合于Sox30啟動子片段-876 bp中-544 bp E-box (CAACTG)、-489 bp E-box(CAGGTG)、-166 bp E-box(CAACTG)、-101 bp E-box(CATATG),這四個E-box位點起直接轉錄激活作用。SOHLH1與-489 bp (CAGGTG)位置E-box位點的結合作用較強,預示此位點為Sox30基因啟動子上的主要轉錄激活位點。

注:A:Sox30 -544 bp E-box (CAACTG) ChIP實驗結果;B:Sox30 -489 bp E-box (CAGGTG) ChIP實驗結果;C:Sox30-166 bp E-box (CAACTG) ChIP實驗結果;D:Sox30 -101 bp E-box (CATATG) ChIP實驗結果。IgG:陰性對照;誤差線代表三次重復實驗的平均數±標準誤差;與IgG相比,**P<0.01。圖3 轉錄因子SOHLH1與Sox30基因啟動子序列上E-box位點的結合作用Note. A, Sox30 -544 bp E-box (CAACTG) ChIP test result. B, Sox 30-489 bp E-box (CAGGTG) ChIP test result. C, Sox30 -166 bp E-box (CAACTG) ChIP test result. D, Sox30 -101 bp E-box (CATATG) ChIP test results. IgG was the negative control. Error bars represent the mean ± standard error of three replicate experiments. Compared with IgG, **P<0.01.Figure 3 Binding of the transcription factor SOHLH1 to the E-box site on the Sox30 gene promoter sequence
3 討論
在雄性小鼠中SOHLH1蛋白特異表達于精原干細胞和A1-A4型精原細胞中,是精子發生過程中關鍵的轉錄因子[4]。Sox30基因編碼的SOX30蛋白具有一個HMG box結構域,是性腺發生和精子發生中頂體形成相關的轉錄因子[11-14]。本研究構建了Sox30啟動子熒光素酶質粒,利用Sohlh1真核表達質粒進行共轉染實驗,通過熒光素酶活性檢測實驗證明SOHLH1對Sox30基因存在直接轉錄激活作用。并且通過ChIP實驗證明SOHLH1結合于Sox30基因轉錄起始位點上游-544 bp、-489 bp、 -166 bp和-101 bp處的E-box序列對Sox30產生直接轉錄激活作用,并發現位于-489 bp (CAGGTG)位置的E-box位點與轉錄因子SOHLH1的結合作用較強,預示著此E-box位點為Sox30基因啟動子上的主要轉錄激活位點,表明精原細胞早期發育相關轉錄因子SOHLH1可以直接激活精子發生相關基因Sox30的轉錄。
SOHLH1在精原細胞中表達,Sox30 mRNA在出生后4-7天雄鼠睪丸組織中可通過RT-PCR檢測到,此階段的睪丸組織中只存在精原干細胞和精原細胞,說明此時Sox30 mRNA的轉錄發生于這兩種細胞內,與本研究中所證實的SOHLH1在精子發生早期直接激活Sox30基因轉錄的調控機制相符。而SOX30蛋白存在于精子發生后期的圓形精子細胞中,對頂體形成的過程起關鍵作用[14],結合本研究的結論,說明在精子發生的早期Sox30基因就被激活轉錄,mRNA處于翻譯抑制狀態直至圓形精子階段才啟動翻譯。由于這兩種轉錄因子表達及翻譯的時空特異性,推測本文所證實的SOHLH1直接調控Sox30基因轉錄的機制涉及了精子發生中存在的延時翻譯現象。在精子發生過程中,參與精子形成相關的基因甚至在雄性生殖細胞發育的早期如精原細胞中已經開始轉錄,mRNA在細胞發育至后期時才被翻譯為蛋白質并發揮功能[16-21]。雖然目前關于延遲翻譯現象的推論較多,但延遲翻譯基因的具體表達調控機制尚不清楚。本研究通過證明精子發生早期精原細胞中重要轉錄因子SOHLH1對圓形精子細胞頂體形成相關基因Sox30的直接轉錄調控機制,豐富了精子發生中延時翻譯表達調控的現象,并為精原細胞延遲翻譯調控機制的研究提供了線索。

