白蛋白的功能化載體研究及臨床應(yīng)用*
吳藝舟 陳雨佳,2 沈義凱,3 馮翮飛 孫 杰
南京醫(yī)科大學(xué) 1 基礎(chǔ)醫(yī)學(xué)院細(xì)胞生物學(xué)系 2 第一臨床醫(yī)學(xué)院2016級八年制臨床醫(yī)學(xué) 3 2017級八年制臨床醫(yī)學(xué) 4 護(hù)理學(xué)院2016級護(hù)理學(xué),江蘇省南京市 211166; 5 南京醫(yī)科大學(xué)公共衛(wèi)生學(xué)院,江蘇省醫(yī)藥農(nóng)藥獸藥安全性評價(jià)與研究中心
白蛋白是人血清中含量最多的蛋白質(zhì),在成年人血液中達(dá)到40~55g/L,其功能主要維持血液的正常滲透壓和運(yùn)輸小分子物質(zhì)。在傳統(tǒng)臨床應(yīng)用中,白蛋白主要作為血漿容量擴(kuò)充劑廣泛用于出血、休克、燒傷、惡性腫瘤、紅白細(xì)胞增多癥等治療。近年來隨著冷凍電鏡等技術(shù)的蓬勃發(fā)展,白蛋白的高級空間結(jié)構(gòu)得以深入研究,尤其在結(jié)合小分子物質(zhì)方面。最新報(bào)道顯示白蛋白具有多種可調(diào)節(jié)的分子結(jié)合位點(diǎn),能夠進(jìn)行化學(xué)或物理修飾,有望開發(fā)成為綠色安全的新型納米藥物載體。
1 白蛋白的高級空間結(jié)構(gòu)
人血清白蛋白(Human serum albumin)含有35個(gè)半胱氨酸,形成17對二硫鍵和1個(gè)自由的半胱氨酸。白蛋白由三個(gè)同源結(jié)構(gòu)域構(gòu)成,其中結(jié)構(gòu)域Ⅰ和Ⅱ成90°直角,結(jié)構(gòu)域Ⅱ和Ⅲ成45°(圖1)。每個(gè)結(jié)構(gòu)域又分為A、B兩個(gè)子域,兩個(gè)子域均由4~6個(gè)α螺旋結(jié)構(gòu)組成[1-2]。不同物質(zhì)與白蛋白的結(jié)合位置不同,可以通過選擇性水解白蛋白產(chǎn)生的片段與配體結(jié)合的方法,研究白蛋白與配體的結(jié)合位點(diǎn)。在目前已發(fā)現(xiàn)的這些結(jié)合位點(diǎn)中,位于結(jié)構(gòu)域ⅡA(Drug Site 1,結(jié)合口袋Ⅰ)和結(jié)構(gòu)域ⅢA(Drug Site 2,結(jié)合口袋Ⅱ)的兩個(gè)口袋狀結(jié)合位點(diǎn)作用最為廣泛(圖1)。口袋的結(jié)合特異性基本取決于它們的形狀以及極性殘基在疏水性口袋內(nèi)壁上的特定分布,同時(shí)也與電荷中和、氫鍵相互作用有關(guān)[3]。
結(jié)合口袋Ⅰ是水楊酸鹽、膽紅素、磺胺藥物及其他多種藥物的結(jié)合位點(diǎn)(圖1)。由于所結(jié)合的配體均為大分子,所以這一口袋結(jié)構(gòu)相對較大,彈性極好,甚至可以同時(shí)結(jié)合2個(gè)不同的配體[4]。結(jié)合口袋Ⅰ位于結(jié)構(gòu)域ⅡA核心處,包含了全部6個(gè)α螺旋結(jié)構(gòu)和1個(gè)結(jié)構(gòu)子域IB的環(huán)形螺旋結(jié)構(gòu)[3]。由1個(gè)中心區(qū)域形成大結(jié)合腔,從其中延伸出3個(gè)不同的子室,這3個(gè)不同的子室可結(jié)合不同的藥物。右側(cè)的子室可結(jié)合苯巴比妥、華法林等,左側(cè)子室可結(jié)合苯基丁烷和CMPF(3-羧基-4-甲基-5-丙基-2-呋喃丙酸),而前側(cè)子室可結(jié)合氧吩丁酮和華法林。結(jié)合位點(diǎn)Ⅰ的入口由結(jié)構(gòu)子域ⅡB和ⅢA所包圍,這些子域的氨基酸殘基有助于結(jié)合吲哚美辛,并容納碘帕胺、苯丁酮和華法林等[3]。
結(jié)合口袋Ⅱ是甲狀腺素、色氨酸和雙氟尼、安定、布洛芬等一些藥物的結(jié)合位點(diǎn),其空間結(jié)構(gòu)小于結(jié)合口袋Ⅰ(圖1)。結(jié)合口袋Ⅱ是由結(jié)構(gòu)子域ⅢA的全部6個(gè)α螺旋結(jié)構(gòu)組成,還包括1個(gè)預(yù)先形成的極性疏水腔。結(jié)合口袋Ⅱ主要的藥物結(jié)合區(qū)域?qū)?yīng)結(jié)合口袋Ⅰ的中央部分。與結(jié)合位點(diǎn)Ⅰ相比,結(jié)合位點(diǎn)Ⅱ的入口處無阻礙,更容易暴露在溶劑中,有利于藥物結(jié)合[3]。除了上述兩個(gè)主要的結(jié)合口袋外,白蛋白的結(jié)構(gòu)子域ⅠB和ⅢB等結(jié)構(gòu)上也存在如保泰松等藥物結(jié)合位點(diǎn)。
2 參與生物分子代謝
白蛋白是一種非特異性的運(yùn)輸?shù)鞍祝隗w內(nèi)能與許多難溶性的小分子有機(jī)物和無機(jī)離子可逆地結(jié)合形成易溶性的復(fù)合物,從而提高藥物的溶解率、降低生物毒性,因此白蛋白是一種天然的運(yùn)輸載體。白蛋白參與膽固醇的代謝過程,膽固醇可分別與白蛋白的結(jié)合口袋Ⅰ和結(jié)合口袋Ⅱ結(jié)合[5]。分子一側(cè)帶有負(fù)電荷的酸性基團(tuán)的芳香性羧酸,如L-色氨酸、甲狀腺素等可與結(jié)構(gòu)域Ⅱ結(jié)合[6]。甲狀腺素可與白蛋白的結(jié)構(gòu)域ⅡA、ⅢA和ⅢB中的4個(gè)位點(diǎn)結(jié)合,而脂肪酸可與甲狀腺素競爭結(jié)合這些位點(diǎn)。此外脂肪酸在與白蛋白結(jié)合后還能進(jìn)一步誘導(dǎo)后者的結(jié)構(gòu)改變,產(chǎn)生第5個(gè)結(jié)合位點(diǎn)與甲狀腺素結(jié)合[7]。
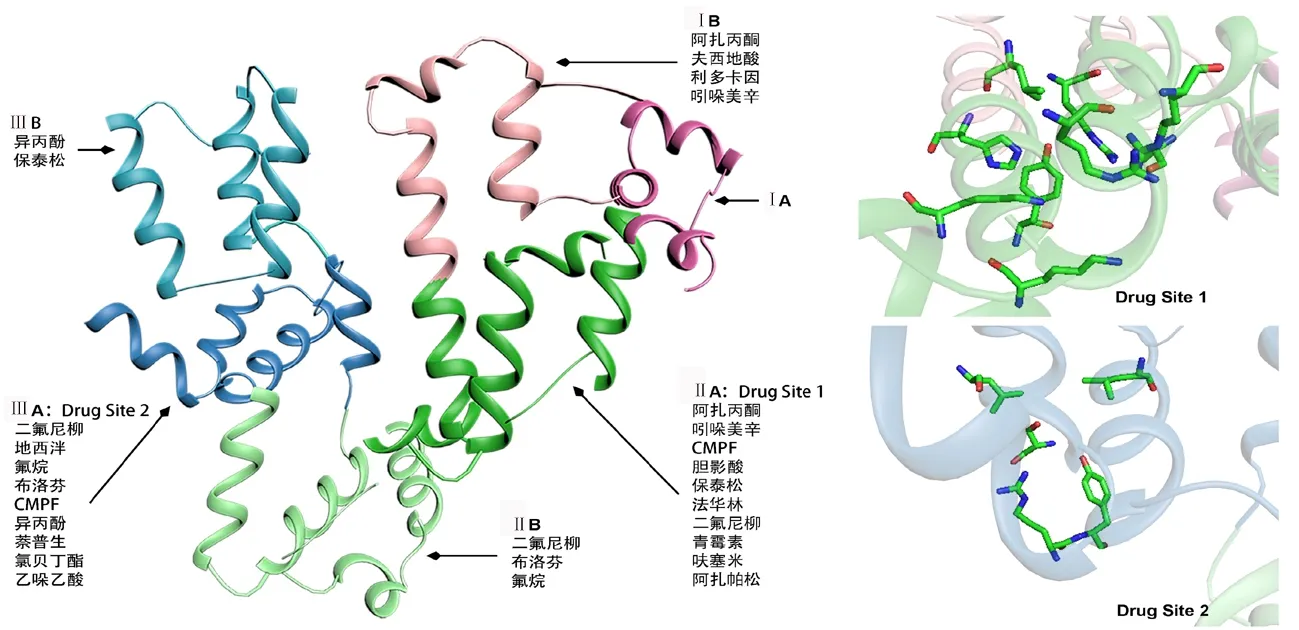
圖1白蛋白空間結(jié)構(gòu)和藥物結(jié)合位點(diǎn)
3 參與藥物分子代謝
能夠與白蛋白結(jié)合的藥物分子非常多,其相互作用主要由四種類型組成:疏水相互作用、氫鍵、范德華力和靜電相互作用[8]。結(jié)合口袋Ⅰ識別二羧酸及分子中心帶有負(fù)電荷的體積較大的雜環(huán)分子如青霉素等,也識別其他藥物如法華林、保泰松、呋塞米、鞣花酸等(圖1)。結(jié)合口袋Ⅱ識別萘普生、布洛芬、地西泮、氯貝丁酯等(圖1)。此外,利多卡因和夫西地酸等主要結(jié)合在結(jié)構(gòu)子域IB[3]。
4 參與納米藥物的靶向傳遞
白蛋白納米藥物是以白蛋白作為載體包封或吸附藥物,經(jīng)固化分離而形成的實(shí)心球體。目前以白蛋白為載體的藥物蛋白偶聯(lián)物大多是在交聯(lián)劑的作用下通過藥物或其衍生物與白蛋白的游離氨基相連接,例如臨床最早使用的氨甲蝶呤白蛋白偶聯(lián)物[9]。白蛋白能夠包裹的藥物有抗腫瘤藥、抗結(jié)核藥、降血糖藥、抗生素、激素、支氣管擴(kuò)張劑等,可通過靜脈注射、肌肉注射、關(guān)節(jié)腔內(nèi)注射、口服、呼吸系統(tǒng)等多途徑給藥[10]。一方面,白蛋白納米藥物進(jìn)入體循環(huán)后主要被肝、腎、骨髓等處網(wǎng)狀內(nèi)皮系統(tǒng)的巨噬細(xì)胞吞噬,具有器官靶向性。另一方面,白蛋白納米藥物可以通過gp60受體/calveolin-1/SPARC通路實(shí)現(xiàn)藥物分子穿過腫瘤血管內(nèi)皮細(xì)胞并靶向運(yùn)輸至腫瘤細(xì)胞。在這一過程中,白蛋白納米藥物首先結(jié)合到血管內(nèi)皮細(xì)胞表面的受體,如gp60受體。通過激活calveolin-1誘導(dǎo)細(xì)胞膜內(nèi)陷形成直徑為50~100nm有被小泡。有被小泡以跨細(xì)胞方式轉(zhuǎn)運(yùn)進(jìn)入其中的白蛋白納米藥物,將其由基底外側(cè)質(zhì)膜釋放到細(xì)胞間隙。進(jìn)一步通過腫瘤組織細(xì)胞外基質(zhì)高表達(dá)的SPARC等蛋白介導(dǎo)運(yùn)輸至腫瘤細(xì)胞[11-12]。
5 參與金屬離子代謝
白蛋白與金屬離子的結(jié)合可以抑制自由基的產(chǎn)生。由于存在1個(gè)自由的半胱氨酸殘基Cys-34,白蛋白成為血管內(nèi)還原性巰基的主要來源。這些巰基是活性氧和活性氮的清除劑,尤其是超氧化物、過氧化亞硝酸鹽等。銅離子是促進(jìn)這些自由基產(chǎn)生的重要離子,白蛋白通過結(jié)合自由的銅離子來抑制自由基生成[13]。白蛋白主要含有四個(gè)金屬離子的結(jié)合位點(diǎn):(1) 多肽鏈N端(N-terminal site,NTS)。該位點(diǎn)是白蛋白結(jié)合金屬離子的標(biāo)志性位點(diǎn),由蛋白序列N端的三個(gè)殘基Asp-Ala-His組成。這個(gè)結(jié)合位點(diǎn)的主要特征是肽鍵的氮原子與金屬離子配位,由同時(shí)存在的末端自由胺和His-3激活。這四個(gè)配位原子的配位結(jié)構(gòu)更傾向于形成金屬離子的平面絡(luò)合物,例如Cu2+和Ni2+。(2)還原型Cys-34。Cys-34使得白蛋白易于形成含半胱氨酸或谷胱甘肽的異型二硫化物[14]。白蛋白部分變性后以Cys-34硫醇鹽的形式結(jié)合金屬離子。Cys-34位于子域IA的第二和第三α螺旋結(jié)構(gòu)之間。X射線衍射分析顯示這一區(qū)域還存在其他潛在的金屬結(jié)合的殘基,例如Asp-38與His-39,但它們不與Cys-34同時(shí)結(jié)合金屬離子[14]。(3)金屬結(jié)合位點(diǎn)A(MBS /Site A His-67)。核磁共振和圓二色性研究表明白蛋白結(jié)構(gòu)域I的His-67咪唑氮是Cd2+和Zn2+的主要結(jié)合位點(diǎn)。Asn-99的羰基、Asp-249的羧酸以及His-247的咪唑和酰胺氧也參與結(jié)合Zn2+。此外,MBS 也是Cu2+和Ni2+的第二結(jié)合位點(diǎn)[15-16]。(4)金屬結(jié)合位點(diǎn)B。這是Cd2+的第二結(jié)合位點(diǎn),與Site A的親和力大致相同。Site B同時(shí)也是Mn2+的主要結(jié)合位點(diǎn),但對Zn2+的親和力較低[15]。
6 參與金屬納米顆粒的體內(nèi)自發(fā)合成
本課題組首次報(bào)道在哺乳動物的心血管系統(tǒng)中可以自發(fā)合成金屬納米顆粒并揭示其合成機(jī)制[17]。通過攝入含有低濃度鋅離子的飲用水,可以在動物外周血中檢測到大量的生物氧化鋅納米顆粒,表征結(jié)果顯示其結(jié)構(gòu)核心為粒徑約6nm的氧化鋅納米晶體,外側(cè)覆蓋血清白蛋白。通過在白蛋白溶液中添加鋅離子,可以在體外環(huán)境中模擬生物氧化鋅納米顆粒的合成過程。可見金屬離子進(jìn)入心血管系統(tǒng)后,能夠被血清白蛋白大量捕獲并結(jié)合形成生物納米顆粒。筆者由此提出當(dāng)大量金屬離子進(jìn)入體內(nèi)后,能夠自發(fā)結(jié)合至白蛋白形成金屬納米顆粒即“金屬庫”,從而有效降低游離態(tài)金屬離子的強(qiáng)氧化及毒副作用。與鋅離子或者化學(xué)合成的氧化鋅納米晶體相比較,病理和免疫學(xué)等實(shí)驗(yàn)均證實(shí)生物氧化鋅納米顆粒具有低毒性和良好的生物相容性。可以進(jìn)一步對其修飾抗癌藥物,實(shí)現(xiàn)了靶向誘導(dǎo)體內(nèi)腫瘤細(xì)胞凋亡的作用[17]。以上結(jié)果表明白蛋白不但是體內(nèi)合成生物納米顆粒的關(guān)鍵分子,還是發(fā)揮藥物修飾連接的新型載體。
7 白蛋白納米藥物的臨床開發(fā)前景
近年來基于白蛋白的功能化生物材料在制備方法、表面改性、臨床應(yīng)用等方面不斷取得新進(jìn)展。白蛋白可制成多種劑型如微球、納米粒等,所包埋的藥物多為抗腫瘤藥,主要用于靜脈注射途徑給藥。其他用法也逐漸增多,如包埋焦磷酸鐵用于口服制劑,通過高親和力白蛋白可以降低游離態(tài)藥物的濃度。目前的研究熱點(diǎn)是使用金屬離子、酶或者葉酸等修飾白蛋白,提高白蛋白與藥物的結(jié)合率和穩(wěn)定性,從而提升藥物的利用率。例如二價(jià)鈣離子或二價(jià)鎂離子與白蛋白的結(jié)合有利于暴露其亞油酸結(jié)合位點(diǎn),可促進(jìn)亞油酸與白蛋白的結(jié)合[18]。通過酶或葉酸修飾,使白蛋白某些基團(tuán)活化,也能促進(jìn)白蛋白與藥物結(jié)合。例如葉酸與白蛋白在縮合劑作用下形成偶聯(lián)復(fù)合體,由于腫瘤細(xì)胞表面葉酸含量顯著高于正常細(xì)胞,葉酸和白蛋白偶聯(lián)可使得白蛋白載藥系統(tǒng)的腫瘤靶向效率顯著提升。
在臨床應(yīng)用方面,美國食品和藥物管理局(FDA)批準(zhǔn)使用人類的血清白蛋白,提取自人血漿或者通過基因重組表達(dá)產(chǎn)生。目前生產(chǎn)多用人血漿為原料,采用低溫乙醇法和層析法[19]。然而原料供應(yīng)是最大問題,例如捐獻(xiàn)者可能存在的病毒感染等因素也限制了白蛋白生產(chǎn)。因此白蛋白來源的明確、穩(wěn)定和安全仍然是一個(gè)巨大挑戰(zhàn),尤其在病毒感染的情況下必須要謹(jǐn)慎篩選適合的捐獻(xiàn)者。 優(yōu)化生產(chǎn)方式、尋找替代蛋白是今后發(fā)展面臨的主要問題,如應(yīng)用基因工程手段生產(chǎn)重組白蛋白等將有助于解決這一問題。
- 醫(yī)學(xué)理論與實(shí)踐的其它文章
- 健全手術(shù)室護(hù)理查對制度對降低手術(shù)室護(hù)理糾紛效果
- 情境教學(xué)法在《航空救護(hù)》課程中的應(yīng)用和探討*
- 個(gè)體化營養(yǎng)干預(yù)對妊娠期糖尿病患者血糖控制及妊娠結(jié)局的影響
- IMB護(hù)理措施在腹腔鏡宮頸癌根治術(shù)后患者尿潴留預(yù)防中的作用
- 綜合護(hù)理在乳腺癌術(shù)后化療患者護(hù)理中的應(yīng)用研究
- 優(yōu)質(zhì)護(hù)理服務(wù)模式對突發(fā)性耳聾患者負(fù)性情緒、護(hù)理效果及護(hù)理滿意度影響分析

