鹽酸莫西沙星原料藥微生物限度檢測方法驗證
孫蓉 潘玲利 張軍東

摘 要 目的:建立合適的鹽酸莫西沙星原料的微生物限度檢測方法,對該方法進行驗證,確保適用。方法:根據中國藥典2015版指導原則,采用薄膜過濾法,分別以聚山梨酯80和氯化鎂作為中和劑,比較對鹽酸莫西沙星的抑菌活性的影響。結果:加入氯化鎂作為中和劑可以較好的消除鹽酸莫西沙星的抑菌活性。結論:該方法準確,可靠,操作方便,適用于鹽酸莫西沙星原料的微生物限度檢測。
關鍵詞 鹽酸莫西沙星 微生物限度 薄膜過濾法
中圖分類號:R927.11 文獻標志碼:A 文章編號:1006-1533(2019)13-0068-05
Methodological validation of microbial limit test for moxifloxacin hydrochloride
SUN Rong1*, PAN Lingli2, ZHANG Jundong1**
(1. Shanghai Haohai Biotechnology Co., Ltd., Shanghai 201613, China; 2. Shanghai Li Kang Rui Biological Engineering Co., Ltd., Shanghai 201707, China)
ABSTRACT Objective: To establish a suitable method for the detection of the microbiological limit in moxifloxacin raw material and to verify the method so as to ensure its application. Methods: The effects of polysorbitol 80 and magnesium chloride as neutralizers on the antibacterial activity of moxifloxacin itsself in microbiological limit test were compared by membrane filtration method based on the Guideline of Chinese Pharmacopoeia 2015 Edition. Results: The antibacterial activity of moxifloxacin itsself could be better eliminated when magnesium chloride was added. Conclusion: This method is accurate, reliable, and convenient to operate and is suitable for the detection of microbial limits in moxifloxacin hydrochloride raw materials.
KEy WORDS moxifloxacin hydrochloride; microbial limit; membrane filtration method
鹽酸莫西沙星為第四代新型喹諾酮類抗菌藥物,具有廣譜抗菌活性,抗菌的作用機制為抑制拓撲異構酶Ⅱ和拓撲異構酶Ⅳ,阻斷細菌DNA合成,主要優勢是耐藥性極低,為1.8×10-9~1×10-11,特別是不易與其他喹諾酮類抗生素產生交叉耐藥。與第三代喹諾酮類藥物相比,它進一步提高了對革蘭陽性菌如肺炎球菌的抑制活性,同時也可以有效抑制厭氧菌。抗非發酵菌(假單胞菌屬和洋蔥伯克霍爾德菌(Burkholderia cepacia)除外)、葡萄球菌、肺炎鏈球菌、腸球菌和厭氧菌的活性是環丙沙星和氧氟沙星的2~16倍;抗大腸埃希菌的活性是環丙沙星的50%,而抗沙眼衣原體、肺炎衣原體和支原體的活性都比環丙沙星高[1]。鹽酸莫西沙星開發的制劑包括片劑,滴眼液,注射液,療效顯著[2-6]。
由于鹽酸莫西沙星自身的抗菌活性,常規檢測方法未必能真實反映其原料藥中的微生物負載,但藥品微生物限度是藥品安全性的重要指標之一,法規文件也對此提出了明確要求[7]。所以,進行微生物限度檢查時,要求供試品自身在試驗的條件下能有效排除其抑菌作用,使其不干擾染菌的限度檢驗,檢測方法通過驗證可以確認供試品所采用的檢查方法和檢驗條件適用[8-9]。
為消除鹽酸莫西沙星的抑菌活性,準確檢測出每克原料實際微生物負載量,本研究確認培養基適用性之后,采用薄膜過濾法,選擇氯化鎂溶液作為中和劑,并以聚山梨酯80作為中和劑同時比較,旨在驗證該方法適用于鹽酸莫西沙星原料藥中微生物限度的檢測。
1 材料和方法
1.1 菌株與培養基
實驗所用菌株為即用型定量菌株,金黃色葡萄球菌CMCC(B)26003(批號20181008);枯草芽胞桿菌CMCC(B)63501(批號20180908);銅綠假單胞菌CMCC(B) 10104(批號20180809);白色假絲酵母CMCC(F) 98001(批號20180904);黑曲霉CMCC(F) 98003(批號20180817)。以上菌株均為3代,全部購自浙江泰林生物技術股份有限公司。其凍干粉直接用商品配套溶液復溶,配制成菌懸液濃度為每0.1 ml不超過100 cfu。
胰酪大豆胨瓊脂培養基(批號20181025)和沙氏葡萄糖瓊脂培養基(批號20170837),均購自浙江泰林生物技術股份有限公司;胰酪大豆胨瓊脂對照培養基(批號135025-201603)和沙氏葡萄糖瓊脂對照培養基(批號135013-201502),購自中國食品藥品檢定研究院。
1.2 藥品與試劑
鹽酸莫西沙星原料(印度瑞迪實驗制藥股份有限公司,批號ABKH005846),氯化鎂(國藥集團化學試劑有限公司,批號20181130),pH 7.2無菌磷酸鹽緩沖液(自制,批號20181127)。
1.3 儀器
BHC-1300IIA2生物安全柜(蘇州時金凈化設備科技有限公司);LRH-250生化培養箱(上海合恒儀器有限公司);LRH-100生化培養箱(上海合恒儀器有限公司);ES-315全自動滅菌鍋(日本Tomy公司);KBF220一次性使用集菌過濾培養器(溫州維科生物實驗設備有限公司);XK97-A菌落計數器(邦西儀器科技(上海)有限公司)。
1.4 方法
1.4.1 培養基適用性檢查
按定量菌株要求分別配制好菌懸液,使每0.1 ml菌液濃度不超過100 cfu;按照培養基說明書要求,配制好培養基。取金黃色葡萄球菌、銅綠假單胞菌和枯草芽胞桿菌菌懸液各0.1 ml,分別各注入2個無菌平皿中,立即傾注胰酪大豆胨瓊脂培養基,混勻,凝固,于30~35℃倒置培養3 d。白色假絲酵母和黑曲霉同法操作菌,但于30~35 ℃倒置培養5 d;同時,還將他們置于沙氏葡萄糖瓊脂培養基20~25 ℃培養5 d。細菌和真菌均須用相應的對照培養基替代被檢培養基進行上述試驗。
逐日觀察需氧菌和真菌的菌落生長情況,進行菌落計數,取平均值計算比值。觀察比較試驗菌在被檢培養基上與相應的對照培養基上的菌落的數量、形態和大小。
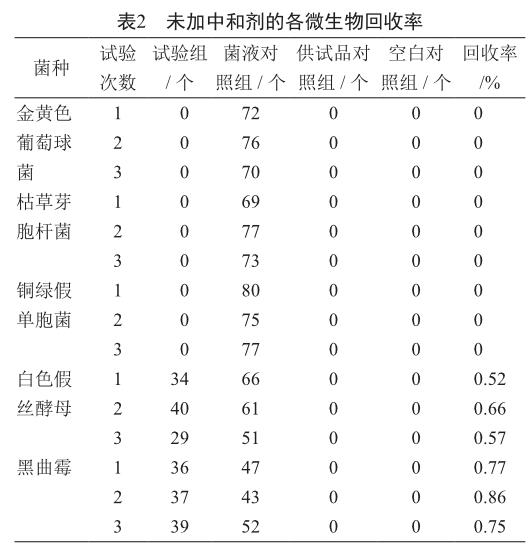
1.4.2 未加中和劑
稱量鹽酸莫西沙星原料10 g,溶于1 000 ml pH 7.2無菌磷酸鹽緩沖液,作為1∶100的供試液。
1)試驗組 取供試液100 ml與0.1 ml的金黃色葡萄球菌的菌懸液混勻,過濾,用700 ml pH 7.2無菌磷酸鹽緩沖液沖洗,每次100 ml,沖洗7次;將濾膜取出,菌面向上,貼于胰酪大豆胨瓊脂培養基平皿上(平行制備2個平皿),于30~35 ℃倒置培養不超過3 d,進行菌落計數。銅綠假單胞菌和枯草芽胞桿菌同法操作。而白色假絲酵母和黑曲霉須同法操作各制備2張濾膜,分別貼于胰酪大豆胨瓊脂培養基平皿和沙氏葡萄糖瓊脂培養基平皿上,置于30~35 ℃和20~25 ℃倒置培養不超過5 d。
2)菌液對照組 取稀釋液100 ml代替供試液,加入0.1 ml的菌懸液(不超過100 cfu),混勻,過濾,按試驗組同法操作。
3)供試品對照組 取供試液100 ml,不接入試驗菌,按照試驗組同法操作。
4)空白對照組 用稀釋液100 ml代替供試液,不接入試驗菌,按照試驗組同法操作。
試驗組菌數回收率=(試驗組菌落數-供試品對照組菌落數)/菌液對照組菌落數×100%。
上述試驗獨立平行操作3次。
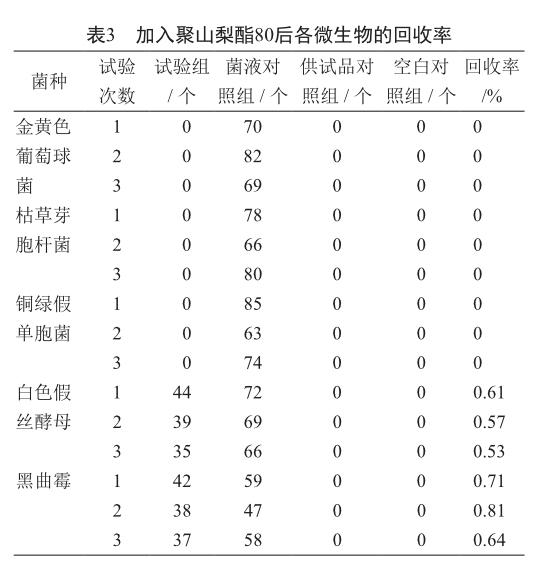
1.4.3 中和劑加入試驗
分別以4.0%聚山梨酯80和2 mol/L氯化鎂為中和劑,各組每100 ml培養基中加入了5 ml中和劑,其余按1.4.2操作。
2 結果
2.1 培養基適用性
被檢與對照培養基菌落平均數的比值均在0.5~2范圍內,且菌落形態大小與對照培養基的菌落一致(表1),說明培養基適用性檢查符合要求。
2.2 不加中和劑
鹽酸莫西沙星對細菌的抑菌活性較強,檢測需氧菌總數時需要添加合適的中和劑抑制其自身的抗菌活性;白色假絲酵母和黑曲霉的回收率在0.5~2.0之間(表2),符合藥典規定要求,表明可直接進行霉菌和酵母菌的微生物限度檢測。
2.3 加入中和劑
2.3.1 聚山梨酯80
加入聚山梨酯80對需氧菌的生長沒有明顯影響,表明其不能抑制鹽酸莫西沙星自身的抗菌活性,但其對霉菌和酵母菌的檢測沒有影響(表3)。
2.3.2 氯化鎂
氯化鎂作為中和劑加入可較好地消除鹽酸莫西沙星的抑菌活性,適用于需氧菌總數的檢測,而對霉菌和酵母菌的檢測沒有影響(表4)。
3 討論
不同的產品,或者同一產品用途不同,微生物限度的檢測方法都存在差異,需要建立合適的方法[10-17]。根據中國藥典2015版通則1105要求[18],本研究首先確認了培養基適用性,然后驗證計數方法適用性,即微生物限度檢測方法適用性。
鹽酸莫西沙星在水中溶解度不是特別好,選擇pH 7.2磷酸鹽緩沖液,可以提高溶解度,并且溶液pH穩定。鹽酸莫西沙星配成1∶100的供試液,取100 ml,采用薄膜過濾法,單張薄膜菌落數即可為每克原料的微生物負載量,無需換算,符合檢測限度要求的量。
鹽酸莫西沙星屬于喹諾酮類藥物,對金黃色葡萄球菌、銅綠假單胞菌,枯草芽胞桿菌有明顯抑制作用,未加中和劑或加中和劑聚山梨酯80時,這三種細菌的回收率均為0。據文獻報道[19],氟喹諾酮類藥物與Mn2+、Mg2+等金屬離子絡合,可降低其生物活性。本研究比較了培養基中不加中和劑、加入中和劑聚山梨酯80和氯化鎂對其自身抗菌活性的影響,結果顯示氯化鎂作為中和劑具有較好的抑制其自身抗菌活性的效果,與文獻報道一致。細菌和真菌的回收率大都可達0.5以上,僅枯草芽胞桿菌有一次回收率為0.49。中國藥典2015版規定[18]:若各試驗組菌數的回收率均符合要求,照所用的供試液制備方法及計數方法進行該供試品的需氧菌總數、霉菌和酵母菌總數計數。方法適用性確認時,若采用上述方法還存在一株或多株試驗菌的回收達不到要求,那么選擇回收最接近要求的方法和試驗條件進行供試品的檢查。
根據微生物限度驗證結果可知,鹽酸莫西沙星對白色假絲酵母和黑曲霉的抑菌活性不強,無論加中和劑與否,回收率均在0.5~2.0之間。根據中國藥典2015版要求,回收率在0.5~2.0之間,可認為該方法適用,即可用于霉菌和酵母菌的檢測。
本研究表明,胰酪大豆胨瓊脂培養基中加入氯化鎂中和劑,可用于檢測需氧菌總數;沙氏葡萄糖瓊脂培養基不加中和劑,可用于檢測霉菌和酵母菌總數。符合中國藥典檢測抗菌藥物微生物限度的有關要求。也許還有更合適的試劑或更合適的濃度可以更好地消除鹽酸莫西沙星自身的抑菌活性,研究人員將繼續探索,以期發現更合適的抑菌中和劑。
參考文獻
[1] 張英, 趙志剛, 張杰. 莫西沙星——一種新的氟喹諾酮類藥物[J]. 中國臨床藥理學雜志, 2002, 18(5): 396-400.
[2] Keating GM. Moxifloxacin 0.5% ophthalmic solution: in bacterial conjunctivitis[J]. Drugs, 2011, 71(1): 89-99.
[3] McDonald MB, Protzko EE, Brunner LS, et al. Efficacy and safety of besifloxacin ophthalmic suspension 0.6% compared with moxifloxacin ophthalmic solution 0.5% for treating bacterial conjunctivitis[J]. Ophthalmology, 2009, 116(9): 1615-1623.
[4] Garg P, Mathur U, Sony P, et al. Clinical and antibacterial efficacy and safety of besifloxacin ophthalmic suspension compared with moxifloxacin ophthalmic solution[J]. Asia Pac J Ophthalmol (Phila), 2015, 4(3): 140-145.
[5] Mather R, Karenchak LM, Romanowski EG, et al. Fourth generation fluoroquinolones: new weapons in the arsenal of ophthalmic antibiotics[J]. Am J Ophthalmol, 2002, 133(4): 463-466.
[6] Kowalski RP, Dhaliwal DK, Karenchak LM, et al. Gatifloxacin and moxifloxacin: an in vitro susceptibility comparison to levofloxacin, ciprofloxacin, and ofloxacin using bacterial keratitis isolates[J]. Am J Ophthalmol, 2003, 136(3): 500-505.
[7] 國家食品藥品監督管理局藥品審評中心. 已上市化學仿制藥(注射劑)一致性評價技術要求(征求意見稿)[EB/OL].(2017-12-22) [2019-01-28]. http://www.cde.org.cn/news. do?method=largeInfo&id=314333.
[8] 謝委, 馬永貴, 張光勛, 等. 阿托伐他汀鈣片微生物限度檢查方法學驗證[J]. 中國藥師, 2013, 16(3): 471-473.
[9] 黃依玲. 醫院制劑微生物限度檢查方法的重新驗證[J]. 中國現代藥物應用, 2013, 7(9): 3-4.
[10] 劉濤, 朱斌, 韋濤, 等. 氧氟沙星栓微生物限度檢查方法探討[J]. 臨床合理用藥雜志, 2010, 3(20): 4-5.
[11] 萬進, 林蒙, 謝委, 等. 鹽酸左氧氟沙星凝膠微生物限度檢查方法驗證[J]. 醫藥導報, 2015, 34(11): 1486-1489.
[12] 李春梅. 阿可拉定原料微生物限度檢查方法驗證研究[J].山東化工, 2016, 45(20): 47-48; 52.
[13] 胡文紅, 程春雷, 王德利. 應用中和劑對氟喹諾酮類藥物微生物學檢查方法的影響[J]. 食品與藥品, 2011, 13(11): 417-420.
[14] 殷建國. 微生物限度檢查應注意的若干問題[J]. 中國藥事, 2004, 18(7): 456.
[15] 劉戈, 邱唯佳, 費夷敏. 替硝唑栓微生物限度檢查方法適用性試驗研究[J]. 上海醫藥, 2016, 37(13): 73-76.
[16] 張媛媛 張玥莉. 丹參多酚酸鹽微生物限度檢查方法的建立[J]. 上海醫藥, 2017, 38(3): 72-74.
[17] 占景華, 石鶴坤, 鐘淵福, 等. 他克莫司膠囊微生物限度檢查法驗證的探討[J]. 實用藥物與臨床, 2014, 17(11): 1442-1445.
[18] 國家藥典委員會. 中華人民共和國藥典2015版四部[M].北京: 中國醫藥科技出版社, 2015: 140-144.
[19] 張加玲, 樊慧芝, 潘景浩. 電化學方法研究氟喹諾酮類藥物與金屬鎂、錳離子的相互作用[J]. 山西臨床醫藥, 1996, 5(4): 311-313.

