基于氣相色譜-質譜聯用技術的食管鱗癌細胞代謝組學分析
崔艷艷,張彥婷,張璐玉,王文杰,馬珊珊,劉紅濤,楊大偉,關方霞
1)鄭州大學生命科學學院 鄭州 450001 2)聊城市人民醫院中原生物醫學研究院 山東聊城 252002
食管鱗癌(esophageal squamous cell carcinoma,ESCC)是我國乃至世界范圍內較為常見的消化系統惡性腫瘤之一,其惡性程度高、易轉移、預后差[1]。由于ESCC早期無明顯癥狀,并且缺乏有效的早期診斷方法,很多臨床上確診的ESCC患者已到中晚期,只能采取以手術為主、放化療為輔的綜合治療,往往預后差、生存期短[2],因此尋找早期診斷的特異標志物及有效治療靶點是提高ESCC治療效果的主要途徑。代謝組學是以小分子代謝物為研究對象,對組織、細胞及體液中所有代謝產物進行定性和定量分析[3]。腫瘤的產生是環境因素與遺傳因素共同作用的結果,這些因素將導致與腫瘤相關的基因及蛋白質表達異常,同時也體現在代謝物水平的改變[4]。通過代謝組學揭示腫瘤細胞中整體代謝物的改變,發現和篩選基于代謝物的特征性生物標志物,將有助于揭示腫瘤發生發展的代謝機制,為早期診斷和發病機制的研究提供新的思路和理論依據[5]。隨著代謝組學技術的不斷發展,大量腫瘤代謝標志物[6]已被鑒定,如卵巢癌[7]、前列腺癌[8]、結直腸癌[9]等疾病,越來越多的標志性差異代謝產物被用于輔助臨床診斷與治療。本研究利用氣相色譜-質譜(GC-MS)聯用技術對人ESCC細胞及正常食管上皮細胞的代謝差異進行探究,應用多變量統計分析對代謝產物進行模式識別,篩選重要的差異代謝物,并結合代謝通路分析,揭示ESCC整體性代謝的改變。
1 材料與方法
1.1儀器、試劑及細胞①主要儀器和試劑:GC-MS儀7890-5975(美國安捷倫公司);真空濃縮儀(德國Labconco公司);甲氧基胺鹽酸鹽、吡啶、N-甲基-N-(三甲基硅基)三氟乙酰胺(MSTFA)均購自美國Sigma公司。②細胞株及培養基:人ESCC細胞株EC1、Eca109、TE1和正常食管上皮細胞Het-1A由鄭州大學第一附屬醫院細胞生物學實驗室保存;DMEM高糖培養基、標準胎牛血清、PBS購自以色列Biological Industries公司。
1.2細胞培養細胞在75 cm2的培養瓶中用含體積分數10%胎牛血清和雙抗的培養基于37 ℃、體積分數5%CO2條件下培養,每種細胞培養4瓶,1瓶進行細胞計數,3瓶用于實驗,當細胞融合度達到85%時進行后續實驗。
1.3細胞樣品制備棄細胞培養基,用PBS洗滌3次后將培養瓶放在冰上并加入4 mL體積分數為80%的冷甲醇,-80 ℃放置20 min后,于冰上用細胞推刮器刮下細胞,轉移到2 mL離心管中。4 ℃、14 000 r/min離心5 min,取上清置于新的15 mL離心管中,細胞沉淀中加入500 μL冷甲醇,渦旋振蕩1 min后繼續在4 ℃、14 000 r/min條件下離心5 min,取上清和之前的上清混合在一起,均分成3管,每個細胞系均分裝9個平行管,然后用真空離心儀離心濃縮。
1.4樣品衍生在每個樣品中加入50 μL 20 g/L的甲氧基胺鹽酸鹽溶液(溶解于吡啶),40 ℃振蕩90 min。待其冷卻到室溫后,每個樣品中加入50 μL MSTFA,40 ℃反應60 min。12 000 r/min離心10 min后,取上清液,轉移到含有襯管的自動進樣瓶中。
1.5GC-MS分析進樣口溫度:280 ℃;柱始溫:70 ℃,保持3 min,再以5 ℃/min升溫至300 ℃,保持5 min;載氣:高純氦,流速為1.2 mL/min;進樣方式:5∶1進樣;進樣體積:1 μL。
電子轟擊離子源:70 eV;傳輸線溫度:280 ℃;溶劑延遲:4.8 min;離子源溫度:230 ℃;四級桿溫度:150 ℃;掃描范圍:33~600 m/z。
1.6數據處理將GC-MS數據從Agilent MSD ChemStation導出為netCDF格式,采用自動質譜解卷積與識別系統(AMDIS)在批處理模式下對netCDF文件進行去卷積處理,AMDIS去卷積設置為:分辨率中等、靈敏度低、形狀要求中等,元件寬度設為10。經過AMDIS處理后得到兩種格式的數據:*.ELU和*.FLN。將*.ELU文件上傳到SpectConnect(www.spectconnect.mit.edu,可以校正保留時間漂移和選擇出現75%以上的代謝物),然后得到相對量、保留時間、積分峰和基峰4個數據集,用于統計分析。*.FLN文件用于搜索NIST質譜庫(包括NIST 08、Wiley、Replib和Fiehn數據庫),定性代謝物。多元統計分析和單變量統計分析所用軟件為加拿大阿爾伯特大學開發的集質譜數據處理、多元統計分析和代謝途徑分析為一體的MetaboAnalyst。
2 結果
2.1代謝譜分析EC1、Eca109、TE1和Het-1A細胞經過GC-MS聯用技術檢測分析后,獲得典型的總離子流色譜圖,見圖1。共鑒定出103種化合物,包括各種氨基酸、糖類、脂類、類固醇類及尿素、磷酸等小分子代謝物。

A:Het-1A;B:EC1;C:Eca109;D:TE1
2.2主成分分析對4種細胞的代謝物進行主成分分析,得分圖見圖2。主成分1解釋了總差異的36.8%,主成分2解釋了總差異的19.0%;4株細胞在主成分分析得分圖中得到了很好的區分。

圖2 4種細胞代謝輪廓的主成分分析得分圖
2.3差異代謝途徑的篩選數據經過預處理后得到代謝途徑差異圖,見圖3,顏色越深說明代謝差異性越顯著,圓圈越大說明檢測到該代謝途徑的代謝產物越多。根據圖3共篩選出9條ESCC細胞與正常食管上皮細胞的差異代謝途徑,包括類固醇激素的生物合成,初級膽汁酸的生物合成,脂肪酸代謝,半乳糖代謝,賴氨酸降解,丙酮酸代謝,氨基酰基-tRNA生物合成,半胱氨酸和蛋氨酸代謝,丙氨酸、天冬氨酸和谷氨酸代謝。共涉及氨基酸代謝、能量代謝及糖代謝,其中氨基酸代謝途徑中檢測到的差異性代謝物最多。
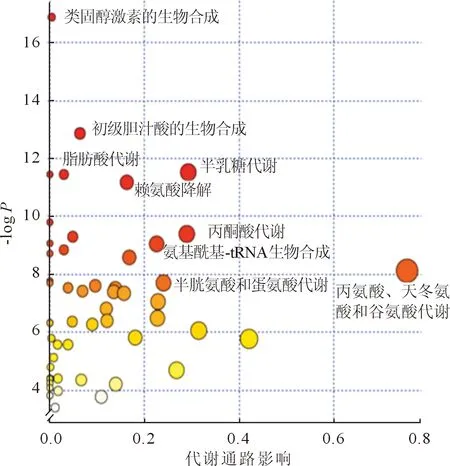
圖3 ESCC細胞與Het-1A細胞差異代謝途徑分析
2.4差異代謝物的篩選及其變化趨勢分析ESCC細胞與Het-1A細胞的差異代謝物基本可以分為下面幾類:氨基酸類物質,賴氨酸、苯丙氨酸、天冬酰胺、丙氨酸、谷氨酸、色氨酸、蛋氨酸、酪氨酸和纈氨酸等在ESCC細胞中上調;糖代謝物質,塔格糖在ESCC細胞中上調,葡萄糖下調;脂類物質,單棕櫚酸酯和膽固醇在ESCC細胞中上調。
3 討論
代謝組學通過考察生物體系受刺激或擾動前后的代謝物譜及其動態變化來研究生物體系的代謝網絡。與基因組學、轉錄組學和蛋白質組學相比,代謝組學更接近于表型,能更直接、更準確地反映生物體的生理、病理狀態[10]。腫瘤細胞為滿足快速增殖的需求,必須改變細胞內的代謝模式來產生大量的能量和物質,因此腫瘤的發生發展過程中必然伴隨著代謝改變,在當前腫瘤研究中,代謝組學的應用發揮著越來越重要的作用[11]。
本研究通過基于GC-MS的代謝組學分析了ESCC細胞與Het-1A細胞的代謝差異,結果表明差異代謝途徑主要涉及氨基酸代謝、糖代謝及能量代謝,其中賴氨酸、苯丙氨酸、丙氨酸、谷氨酸、天冬酰胺、色氨酸、蛋氨酸、酪氨酸、纈氨酸、塔格糖、單棕櫚酸酯及膽固醇等小分子代謝物在ESCC細胞中的含量均升高,葡萄糖含量減少。Wang等[12]同樣發現在食管癌組織中纈氨酸和蛋氨酸含量升高,葡萄糖含量降低。Yang等[13]也發現在食管癌組織中丙氨酸和谷氨酸含量升高。本研究中作者發現ESCC細胞中氨基酸含量明顯升高,這提示腫瘤細胞為實現快速增殖而攝取大量的氨基酸。而ESCC細胞中葡萄糖減少,說明常伴有糖代謝紊亂,可能是由于Warburg效應的存在,腫瘤細胞更多地消耗葡萄糖來維持自身的能量需求,是腫瘤細胞糖酵解增強的結果[14]。此外,ESCC細胞中膽固醇含量高于正常細胞,研究[15]表明,膽固醇代謝異常會引起各種疾病,其含量升高與某些惡性腫瘤的風險增加有關,且高膽固醇是腫瘤治療的一個不良預后因素。
主成分分析得分圖可以反映組間離散程度,圖中每一個點代表一個樣本,可以較直觀地顯示不同組別之間的整體差異。該研究結果顯示,主成分1解釋了總差異的36.8%,主成分2解釋了總差異的19.0%。4株細胞在主成分分析得分圖中得到了很好的區分,說明4株細胞在代謝上有明顯的差異。
總之,腫瘤的發生發展往往伴隨著代謝物的改變。本研究中所發現的這些差異代謝物為進一步理解腫瘤的病理機制及篩選早期診斷標志物提供了一定的理論依據。當然,這些結果還需大量臨床樣本和進一步的細胞及動物實驗進行驗證,還需結合患者血清、血漿、尿液或組織的代謝組學分析,以獲得更加完整全面的代謝物圖譜。

