基于網絡藥理學探究三七治療冠心病的潛在作用機制Δ
黃桂鋒,鄭曉虹,麥喆钘,楊詔鈞,林雪瑩,李俊哲(.汕頭市潮陽區大峰醫院心血管內科,廣東汕頭5500;.廣州中醫藥大學第二臨床醫學院,廣州 50405;.廣州中醫藥大學第一臨床醫學院,廣州50405)
隨著社會經濟的發展和人們生活質量的提高,高脂、高糖的飲食習慣日漸普遍,導致冠狀動脈粥樣硬化性心臟病(以下簡稱“冠心病”,CHD)的發病率和病死率逐年增加,已嚴重影響到人們的生活質量[1]。CHD指冠狀動脈血管發生動脈粥樣硬化病變而引起血管腔狹窄或阻塞,造成心肌缺血、缺氧或壞死而導致的心臟病,病情嚴重可導致患者猝死[2-3]。CHD在臨床的藥物治療思路主要包括抗血小板聚集、調脂、擴張冠脈、減輕心肌耗氧量、改善心臟重構等[4-6]。目前,隨著中醫藥的蓬勃發展,中藥在輔助治療CHD方面發揮了重要作用。本研究團隊發現,臨床上采用血栓通注射液或膠囊聯合常規藥物治療CHD往往可以取得更好的療效[7-8]。而血栓通相關制劑的主要藥味均為三七[9-10],因此本研究團隊認為三七在CHD治療過程中可發揮巨大的作用。現代藥理學研究也證實,三七總皂苷可改善能量代謝障礙,促進受損組織對能量物質的利用,有利于組織結構和功能的恢復;有利于清除自由基和抗氧化應激,減少細胞損傷;能調控細胞凋亡信號通路,明顯減少心肌細胞凋亡,可在一定程度上減少CHD誘因的產生,從而降低CHD的發生風險[11-12]。三七化學成分復雜,對相關疾病的治療具有多成分、多靶點、多途徑等特點,但是目前對其藥理學研究僅停留在單成分研究或其對某種動物模型和某個/某幾個相關因子的影響,尚無法很好地解釋其在治療CHD中作用廣泛、效果良好的特點,其化學活性成分和作用機制均不明確。
網絡藥理學是以系統生物學為基礎,利用生物網絡數據庫、各種生物網絡構建方法和生物網絡分析技術,通過網絡構建工具,系統闡述“藥物-基因-靶點-疾病”之間復雜網絡關系的一門交叉學科[13]。本研究應用網絡藥理學的方法,分析三七的化學成分、作用靶標、信號通路,并進行京都基因與基因組百科全書(KEGG)通路富集分析以及基因本體(GO)分類富集分析,揭示三七的多靶標、多通路協同作用機制,旨在發掘其治療CHD的新靶點和新通路,為臨床治療CHD提供新思路,同時也為三七的臨床應用提供科學依據。
1 資料與方法
1.1 三七活性成分的獲取
利用中藥系統藥理學分析平臺(TCMSP,http://lsp.nwu.edu.cn/)檢索三七的化學成分。以“三七”為關鍵詞在該平臺進行檢索,獲得其化學成分的信息,包括分子名、分子量、脂水分配系數、半衰期、口服吸收度(OB)和類藥性(DL)等。由于并非所有成分均能作為藥物進入人體內發揮作用,所以根據TCMSP平臺的推薦,選取同時滿足“OB值大于30%”“DL值大于0.18”這兩個納入條件[14]的化學成分,作為三七的活性成分。
1.2 三七治療CHD的作用靶標基因的獲取
1.2.1 三七活性成分靶標基因的獲取 采用Discovery Studio 4.0軟件對“1.1”項下獲取的三七活性成分進行預處理:選擇“Minimize ligands”模塊,選擇“CHARMm”力場,能量優化算法采用“共軛梯度法”和“最陡下降法”,對活性成分進行能量最小化分析;分子多構象生成選擇“BEST”模式進行。通過Chembiodraw Ultra 12.0軟件繪制三七活性成分的3D結構圖,然后將所有活性分子的3D結構上傳到DRAR-CPI服務器(http://cpi.bio-x.cn/drar/),并基于反向分子對接方法對活性成分和靶標間相互作用的親和性進行評分。按照該服務器推薦,選定Z-score值小于-0.5的蛋白[15]作為三七活性成分的靶標蛋白,并記錄活性成分和靶標蛋白的對應關系。然后通過UniProtKB數據庫(https://www.uniprot.org/)檢索活性成分靶標蛋白的分子名,檢索字段為“All Fields”,限定物種為“Human”,從而獲取靶標蛋白的相應基因與其UNIPROTKB編號(UPID)。
1.2.2 CHD疾病靶標基因的獲取 分別在GeneCards數據庫(https://www.genecards.org/)和DisGeNET數據庫(http://www.disgenet.org/)中進行檢索,以“Coronary heart disease”或“CHD”為關鍵詞,獲取CHD疾病靶標基因。
1.2.3 三七治療CHD的成分-疾病靶標基因的獲取采用Excel 2007軟件錄入三七活性成分靶標基因和CHD疾病靶標基因,對兩者進行對比并篩選出交集基因,作為三七治療CHD的成分-疾病靶標基因(簡稱為“作用靶標”);同時,篩選出上述靶標基因對應的UPID。
1.3 有效成分-作用靶標基因網絡的構建
根據“1.2.3”項下篩選獲得的作用靶標基因,從“1.1”項下獲取的三七活性成分中篩選出三七中可能具有CHD治療作用的活性成分,作為有效成分。將這些有效成分和作用靶標基因及兩者間的對應關系文件導入Cytoscape 3.6.0軟件,構建有效成分-作用靶標基因網絡,并對網絡可視化圖譜進行讀取和分析。
1.4 核心靶標的獲取
1.4.1 潛在核心靶標的獲取 將“1.2.3”項下獲得的三七治療CHD的作用靶標基因的UPID導入String數據庫(https://string-db.org),限定物種條件為“Homo sapiens”,檢索獲取作用靶標基因的相互作用網絡關系。再將這一相互作用網絡關系文件導入Cytoscape 3.6.0軟件,繪制作用靶標基因的相互作用網絡。采用該軟件的“Network Analyzer”工具對相互作用網絡進行分析并計算各作用靶標的連接度(Degree)。Degree值代表某個靶標與其可能具有相互作用關系的其他靶標數量,該值越高則意味著該靶標在三七治療CHD中發揮的作用可能越大。篩選Degree值最大的5個作用靶標作為潛在核心靶標。根據各個作用靶標的Degree值調整節點的面積大小,繪制作用靶標的相互作用網絡圖(Degree值越大則節點面積越大),并對圖譜進行讀取和分析。
1.4.2 潛在核心靶標與有效成分之間結合力的分子對接驗證 將“1.4.1”項下獲得的潛在核心靶標導入System Dock Web Site服務器(http://systemsdock.unit.oist.jp/iddp/home/index),按照服務器原始參數設定,將潛在核心靶標與“1.3”項下獲得的三七治療CHD的有效成分進行分子對接,得到對接評分(Docking score),用來評價有效成分與潛在核心靶標的結合力,以驗證核心靶標的真實性。當對接評分>4.25時,表示成分和靶標具有一定的結合能力;當對接評分>5.0時,表示其結合能力較強;當對接評分>7.0時,表示其結合能力很強[16]。
1.5 重要信號通路和分子功能的獲取
將“1.2.3”項下獲得的三七治療CHD的作用靶標基因導入DAVID數據庫(https://david.ncifcrf.gov/),設置“Select Identifier”為“UNIPROT ACCESSION”、“List Type”為“Gene List”,選擇“Functional Annotation Tool”,獲得KEGG通路富集分析和GO分類富集分析的結果,并重點關注GO分類富集分析結果中的分子功能(Molecular function,MF)部分。選取P<0.001[17]的信號通路和分子功能,并根據富集基因數由多到少排序,選取排名前20位的信號通路和分子功能,結合現有文獻,從中篩選三七治療CHD的重要信號通路和分子功能并進行分析。
1.6 重要信號通路的“有效成分-作用靶標-信號通路”網絡構建
通過DAVID數據庫,在篩選重要信號通路的同時,找出富集于上述信號通路中的作用靶標基因,并與“1.2.3”項下獲得的三七治療CHD的作用靶標基因進行對比,篩選出交集靶標。將這些交集靶標與“1.3”項下獲得的三七治療CHD的有效成分相配對,然后將配對關系文件導入Cytoscape 3.6.0軟件,構建出重要信號通路的“有效成分-作用靶標-信號通路”的網絡關系圖,對圖譜進行讀取并分析三七治療CHD的分子機制。
2 結果
2.1 三七活性成分的篩選結果
從TCMSP平臺上檢索到三七所含的化學成分有119個,符合納入條件的活性成分共5個,分別為豆甾醇(Stigmasterol)、β-谷固醇(Beta-sitosterol)、人參皂苷rh2(Ginsenoside rh2)、槲皮素(Quercetin)、三七皂苷r1(Notoginsenoside r1),詳見表1。

表1 三七活性成分Tab 1 Active components of Panax notoginseng
2.2 三七治療CHD作用靶標基因的篩選結果
在DRAR-CPI服務器中對三七的5個活性成分進行反向分子對接后,結果Z-score值小于-0.5的靶標有147個;通過UniProtKB數據庫獲得其對應的基因和UPID;再將上述靶標基因與GeneCards和DisGeNET數據庫中的CHD相關基因比對、取交集后,篩選出三七治療CHD的作用靶標基因96個,詳見表2。
2.3 有效成分-作用靶標網絡的構建結果
根據作用靶標基因的篩選結果,從三七的5個活性成分中篩選出5個有效成分(見表1),即活性成分均為有效成分。經有效成分與作用靶標基因配對后繪制出有效成分-作用靶標基因網絡圖(見圖1)。由圖1可見,網絡中共有101個節點,包括5個有效成分和96個作用靶標基因,其中矩形節點代表有效成分,圓形節點代表作用靶標基因;另有134條邊線,代表5個有效成分與96個靶標基因之間存在134種作用關系,其中槲皮素可與83個靶標基因產生作用。由該網絡可見,同一作用靶標基因可對應不同的有效成分,而同一有效成分也可以作用于不同的靶標基因,表明三七治療CHD具有多成分、多靶標的特點。
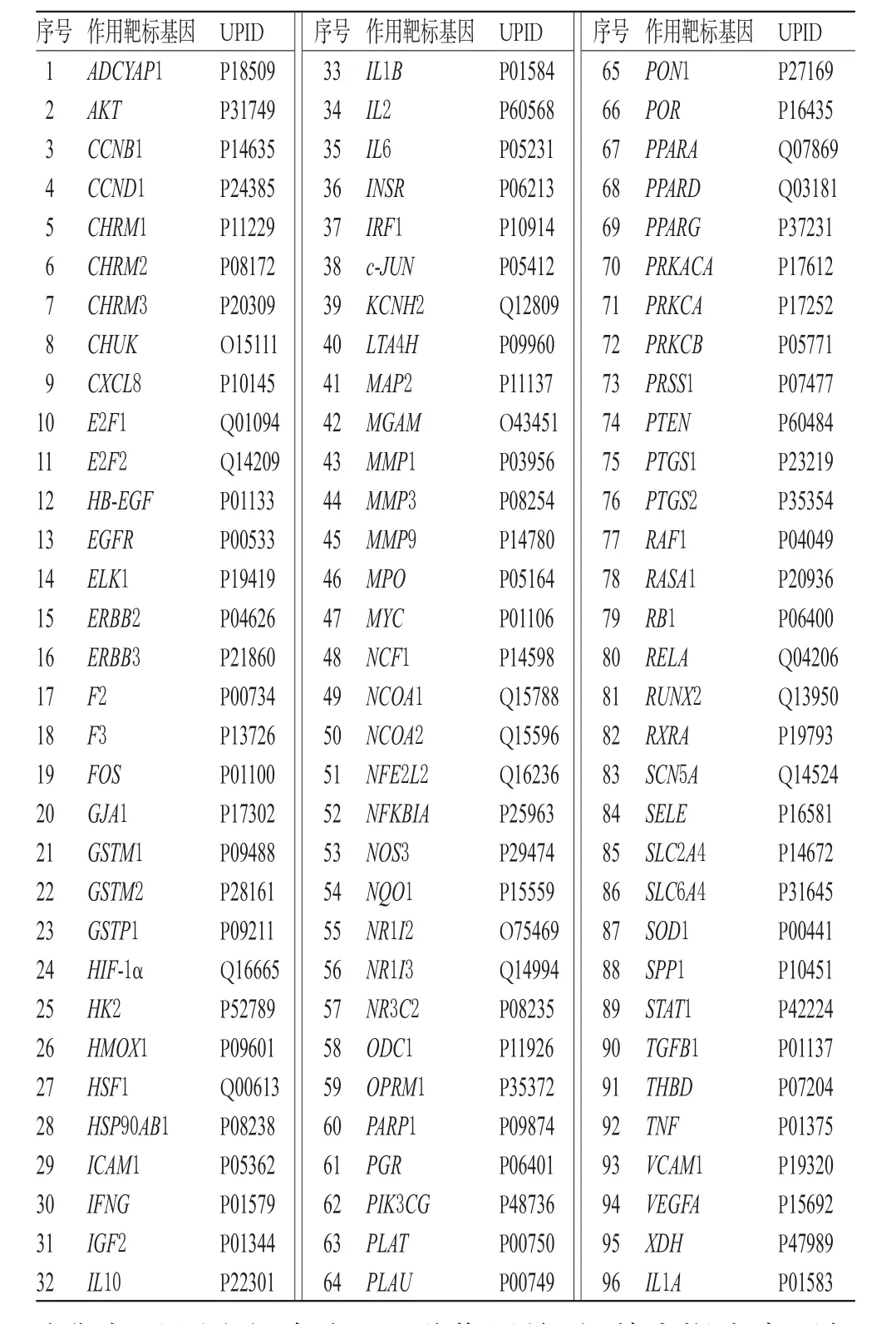
表2 三七治療CHD的作用靶標基因Tab 2 Target genes of P.notoginseng for CHD

圖1 有效成分-作用靶標基因網絡Fig 1 Effective component-target gene network
2.4 核心靶標的篩選結果
對通過String數據庫獲得的作用靶標的相互作用網絡關系,繪制出靶標的相互作用網絡圖,結果見圖2。由圖2可見,該網絡共包括96個節點、1 187條邊線,其中圓形節點表示作用靶標,邊線表示靶標之間的相互作用關系。經“Network Analyzer”工具計算得出各作用靶標的連接度,結果見表3。由表3可見,連接度最高的5個靶標分別為蛋白激酶B(AKT)、白細胞介素6(IL-6)、血管內皮生長因子A(VEGFA)、c-JUN蛋白(c-JUN)、肝磷脂結合表皮生長因子(HB-EGF)。因此,本團隊認為,上述5個靶標在三七治療CHD中發揮了重要作用,為潛在核心靶標。結合圖2亦可看出,上述5個作用靶標可影響多個靶標,進一步證實了三七治療CHD不僅是通過作用于多個靶標而發揮多種效果,還通過靶標之間的相互作用產生了復雜的網絡調節效果。

圖2 作用靶標的相互作用網絡Fig 2 Target interaction network
將5個潛在核心靶標與三七的5個有效成分進行分子對接驗證后,結果在25種可能的對接關系中,有4種對接關系的對接評分>7.0,占16%;有9種對接關系的對接評分在7.0~5.0之間,占36%;有9種對接關系的對接評分在5.0~4.25之間,占36%;有3種對接關系的對接評分<4.25,占12%。由此可見,5個潛在核心靶標與三七的有效成分結合活性高,兩者之間具有較強的結合能力。本團隊認為,該5個靶標在實際情況中確實發揮了較大的作用,因此確定為三七治療CHD的核心靶標。
2.5 重要信號通路和分子功能的篩選結果
經KEGG通路富集分析,符合篩選條件的信號通路有20條,詳見表4;經GO分類富集分析,符合篩選條件的分子功能有20個,詳見表5。結合已有文獻及相關研究,本團隊認為,在三七治療CHD中發揮重要作用的通路有磷酯酰肌醇3激酶/蛋白激酶B(PI3K/AKT)信號通路、低氧誘導因子1(HIF-1)信號通路、絲裂原活化蛋白激酶(MAPK)信號通路;作用較大的分子功能是蛋白結合(Protein binding)。
2.6 有效成分-作用靶標-信號通路網絡構建結果
基于重要信號通路的篩選結果,構建出有效成分-作用靶標-信號通路網絡圖,詳見圖3。由圖3可見,該網絡共有49個節點,其中三角形節點為有效成分,圓形節點為作用靶標基因,六邊形節點為重要信號通路。由該網絡圖可見,三七治療CHD的機制主要是由5個有效成分作用于41個作用靶標,從而調控HIF-1、MAPK、PI3K/AKT信號通路,發揮抗炎、保護缺血損傷、減少動脈粥樣硬化的作用。

表3 作用靶標的連接度Tab 3 Target connectivity
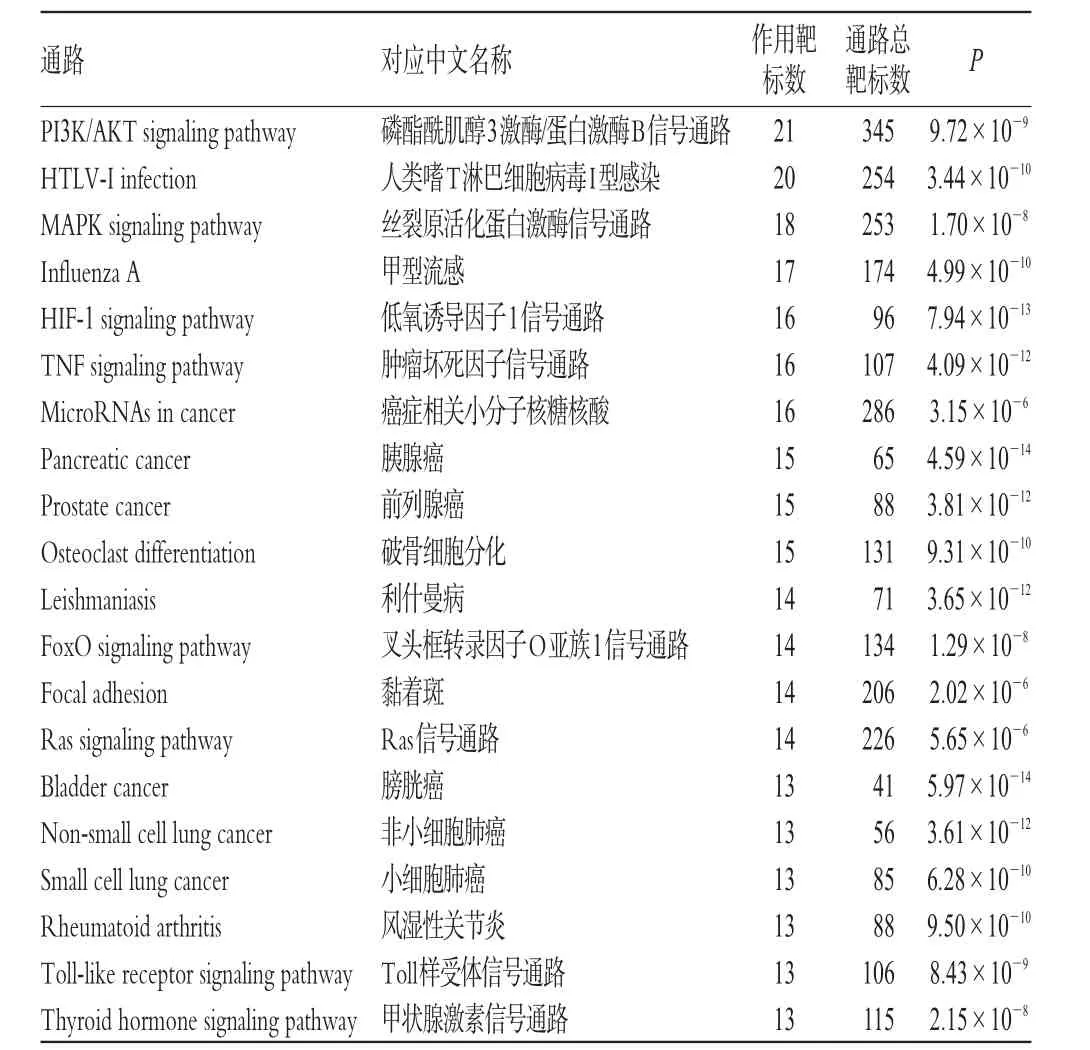
表4 作用靶標的KEGG通路富集分析結果Tab 4 Analysis results of KEGG pathway enrichment of target

表5 作用靶標的分子功能GO分類富集分析結果Tab 5 Analysis results of GO pathway enrichment for molecular function of target

圖3 有效成分-作用靶標-信號通路網絡Fig 3 Effective component-target-signaling pathway network
3 討論
中藥三七,其味甘、微苦,入足厥陰肝經,具有和營止血、通脈行瘀的功效,可用于各種血瘀證的治療[18]。現代藥理學研究發現,三七可有效治療動脈粥樣硬化,具有抗粥樣硬化斑塊形成、抗氧化、抗炎的作用,可抑制IL-1β、IL-6、腫瘤壞死因子α(TNF-α)等炎癥因子的表達[19]。
由本研究獲得的有效成分-作用靶標基因網絡圖可知,三七治療CHD的有效成分分別為豆甾醇、β-谷固醇、人參皂苷rh2、槲皮素和三七皂苷r1。這5個有效成分可作用于96個作用靶標基因從而產生對CHD的治療效果。其中,槲皮素可作用于83個靶標,可能在治療中發揮了最廣泛、最重要的作用。既有研究亦證明了槲皮素對于心血管疾病的治療確實發揮了積極的作用:其可減少肥大心肌細胞中的蛋白濃度,減輕心肌肥大程度;可提高心肌細胞ATP水平和線粒體膜電位,降低活性氧簇(ROS)含量,從而改善心肌細胞線粒體代謝,改善心肌細胞能量代謝紊亂和凋亡,對于心肌細胞具有保護作用[20]。從本研究獲得的有效成分-作用靶標基因網絡圖可知,三七可通過多成分作用于多靶標來治療CHD。
由本研究獲得的作用靶標相互作用網絡圖可知,三七治療CHD的各作用靶標之間存在復雜的相互影響,這表明其作用機制復雜多樣,不僅是某個成分作用于某個靶標產生的,還有靶標之間的相互影響。分子對接結果證實,核心靶標可與有效成分緊密結合,由此說明本研究對于核心靶標的預測與實際情況吻合度較高。結合相互作用網絡圖與分子對接結果,本研究團隊認為,AKT、IL6、VEGFA、c-JUN、HB-EGF為核心靶標,可對多個其他靶標產生影響,可發揮多方面的、綜合的治療效果。這一推論也符合既有研究成果。AKT是PI3K通路中的一個重要蛋白,可調控細胞凋亡、增殖、抗氧化等多種反應[21]。韓軍等[22]研究發現,金絲桃苷可使AKT磷酸化、激活,促使TNF-α和IL-6活性降低,減輕炎癥反應,保護缺血再灌注損傷心肌。所以,本研究團隊認為三七也可起到活化AKT、抑制炎癥反應的作用。IL-6又被稱為前炎癥因子,可調控機體炎癥發生,促進冠狀動脈粥樣硬化[23]。Scheller J等[24]研究發現,IL-6水平與冠狀動脈嚴重病變的發生率呈正相關。郭旗等[25]也通過研究發現,隨著CHD臨床癥狀的加重,IL-6水平在依次遞增。因此,本研究團隊推測三七是通過抑制IL-6的生物學功能從而減輕CHD癥狀并減緩病情的進展,從而達到治療目的。HB-EGF是表皮生長因子家族成員之一,參與多種生理病理過程,如心臟發育、心肌修復、心肌肥大等[26]。有研究證實,在動脈粥樣硬化斑塊組織中,HBEGF在主動脈血管平滑肌細胞和巨噬細胞中有明顯高表達,能促進動脈硬化,加重CHD的臨床癥狀[27]。對此,本研究團隊考慮三七可能是通過降低HB-EGF的表達來減輕CHD的臨床表現。c-JUN是激活蛋白1(AP-1)的異源二聚體形式,已有研究證實,c-JUN可誘導內皮細胞黏附因子產生、增加趨化因子表達和泡沫細胞生成,從而促進動脈粥樣硬化的形成與發展[28]。因此,三七有可能通過抑制c-JUN的表達來發揮防治CHD的作用。VEGFA是血管內皮因子家族中的一種類型,與不同受體結合后可以激活不同的下游信號通路來發揮作用[29],然而關于VEGFA在CHD治療中的作用機制尚未明確,缺少相關研究。
從本研究的GO分類富集分析結果可知,三七可通過影響蛋白結合的功能以達到治療CHD的目的。有研究發現,部分結合蛋白的大量合成可導致CHD發生率升高,例如血清視黃醇結合蛋白4(RBP4)在動脈粥樣硬化組中分泌的增多,對CHD的發生起到一定誘導作用[30];脂肪細胞型脂肪酸結合蛋白(AFABP)也是一種可誘發CHD的結合蛋白,其在巨噬細胞中是炎癥反應的關鍵調節因子,可參與到動脈粥樣硬化的過程中,是心血管疾病的炎癥性危險因素[31]。因此,本研究團隊推測三七可抑制蛋白結合功能,減少RBP4和AFABP等結合蛋白的合成分泌,達到防治CHD目的。
從本研究KEGG通路富集分析結果和有效成分-作用靶標-信號通路網絡圖可知,三七治療CHD主要是通過調控PI3K/AKT信號通路、HIF-1信號通路和MAPK信號通路從而發揮作用。其中,PI3K/AKT信號通路在心肌細胞的凋亡、炎癥反應、抗氧化反應中發揮著至關重要的作用[21]。研究表明,當心肌細胞受到損害時,PI3K/AKT信號通路可抑制心肌炎癥反應的發生,限制內源性負反饋調節因子和代償機制的產生,從而減少惡性病變的發生,保護受損心肌[32-33]。HIF-1是HIF-1信號通路中的重要因子,廣泛存在于多細胞動物體內,在低氧狀態下,機體可通過調節HIF-1信號通路來上調HIF-1的表達,從而維持內環境的氧穩態[34]。目前越來越多的研究致力于利用HIF-1α來調控多種血管生成因子的表達,由此對缺血缺氧的心肌組織進行基因治療,達到促進新生血管的生成、改變靶組織代謝情況從而減輕心肌缺血損傷的目的[35]。p38絲裂原活化蛋白激酶(p38 MAPK)是MAPK通路中的重要下游蛋白,作為細胞內信號傳導酶,在心肌缺血再灌注損傷信號傳導通路中發揮了重要作用[36]。張成哲等[37]研究發現,脾虛型CHD模型動物的p38 MAPK蛋白表達明顯升高,猜測其可能通過激活核轉錄因子κB(NF-κB),進而誘導IL-6、TNF-α的釋放,參與動脈粥樣硬化的形成,導致CHD的發生。
綜上所述,三七治療CHD的過程涉及多個活性成分、作用靶標及通路,這與中醫藥治療疾病“多成分、多靶標、多通路”的作用特點相符合。本研究所得結論大部分與現有研究報道相一致,但也有部分結論并無足夠的既有相關研究支持,這可能是對數據進行多次交互分析產生的誤差,但從另一個角度看也可為研究者提供該領域新的研究切入點。本文僅從理論層面研究了三七治療CHD的作用機制,實際應用中還需要更多的臨床試驗和相關細胞、分子實驗等對本結論進行驗證。

