氯氟醚菌唑合成方法述評
張志剛,張奎祚,鄭曉迪,何喜紅,孔令樂,林 楠
(海利爾藥業集團股份有限公司,山東青島 266109)
氯氟醚菌唑(mefentrifluconazole)是巴斯夫研發、上市的第1個新型異丙醇三唑類殺菌劑,填補了三唑類殺菌劑10余年無新品上市的空白。氯氟醚菌唑化學名稱 (2RS)-2-[4-(4-氯苯氧基)-α,α,α-三氟-鄰甲基] -1-(1H-1,2,4-三唑-1-基)丙-2-醇;商品名Revysol;CAS登錄號為[1417782-03-6];分子式為C18H15ClF3N3O2;相對分子質量為397.8。其化學結構式見圖1。
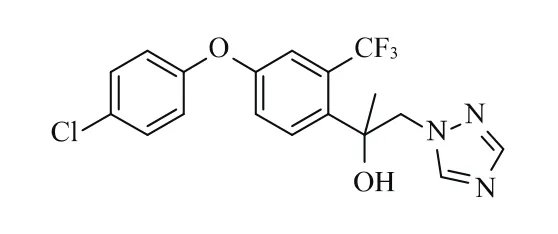
圖1 氯氟醚菌唑結構式
與其他三唑類殺菌劑一樣,氯氟醚菌唑亦為甾醇生物合成中C14-脫甲基化抑制劑。氯氟醚菌唑分子中獨特的異丙醇基團,使其能夠非常靈活地從游離態自由旋轉與靶標結合成為結合態,抑制殼針孢菌的轉移,減少病菌突變,延緩抗性的產生和發展。靈活多變的空間形態使得氯氟醚菌唑對多種抗性菌株始終保持高效,是優秀的抗性管理工具。
氯氟醚菌唑表現出優異的生物性能,其廣譜、高效,具有內吸傳導性,兼具保護、治療、鏟除作用,速效、持效。其還可防控許多難以防治的真菌性病害,如銹病及殼針孢菌引起的病害等。氯氟醚菌唑適用于大田作物、經濟作物和特種作物等世界范圍內的60多種作物,如玉米、谷物、大豆、水稻等大田作物,以及青椒、葡萄等經濟作物,并將應用于草坪和觀賞植物等。氯氟醚菌唑將幫助全球種植戶提升作物活力,提高作物產量和品質。氯氟醚菌唑既可葉面噴霧,也能用于種子處理。相對于其他唑類殺菌劑,氯氟醚菌唑不僅活性更高,而且擁有較好的環境特性,其對哺乳動物、蜜蜂等毒性較低,安全性較高。
2016年起,巴斯夫陸續向歐盟、美國、加拿大、墨西哥、巴西等國家和地區申請登記氯氟醚菌唑。2018年,氯氟醚菌唑在韓國取得登記,并率先上市。
1 工藝路線
文獻報道的氯氟醚菌唑的合成路線主要有3條,具體如下。
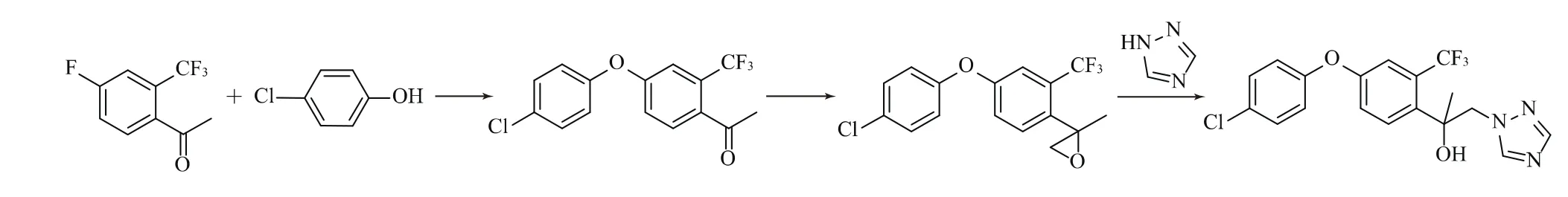
路線1:由4-氟-2-三氟甲基苯乙酮與4-氯苯酚在堿性條件下發生取代反應生成1-[4-(4-氯苯氧基)-2-三氟甲基苯基] 乙酮,再與三甲基锍碘化物或三甲基锍甲基硫酸鹽反應環氧化反應,生成2-[4-(4-氯苯氧基)-2-三氟甲基苯基] -2-甲基環氧乙烷,與1,2,4-三氮唑在堿性條件下發生開環反應得到氯氟醚菌唑[1-5]。
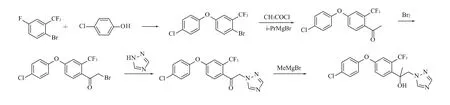
路線2:由1-溴-4-氟-2-三氟甲基苯在堿性條件下與4-氯苯酚發生取代反應,生成1-溴-4-(4-氯苯氧基)-2-三氟甲基苯,在異丙基氯化鎂或氯化鋰作用下,與乙酰氯發生反應,生成1-[4-(4-氯苯氧基)-2-三氟甲基苯基] 乙酮,再與液溴發生取代反應,生成2-溴-1-[4-(4-氯苯氧基)-2-三氟甲基苯基] 乙酮,然后與1,2,4-三氮唑在氫化鈉作用下發生取代反應,生成1-[4-(4-氯苯氧基)-2-三氟甲基苯基] -2-[1,2,4] -三唑-1-基乙酮,再與甲基溴化鎂發生格氏反應,得到氯氟醚菌唑[1-5]。
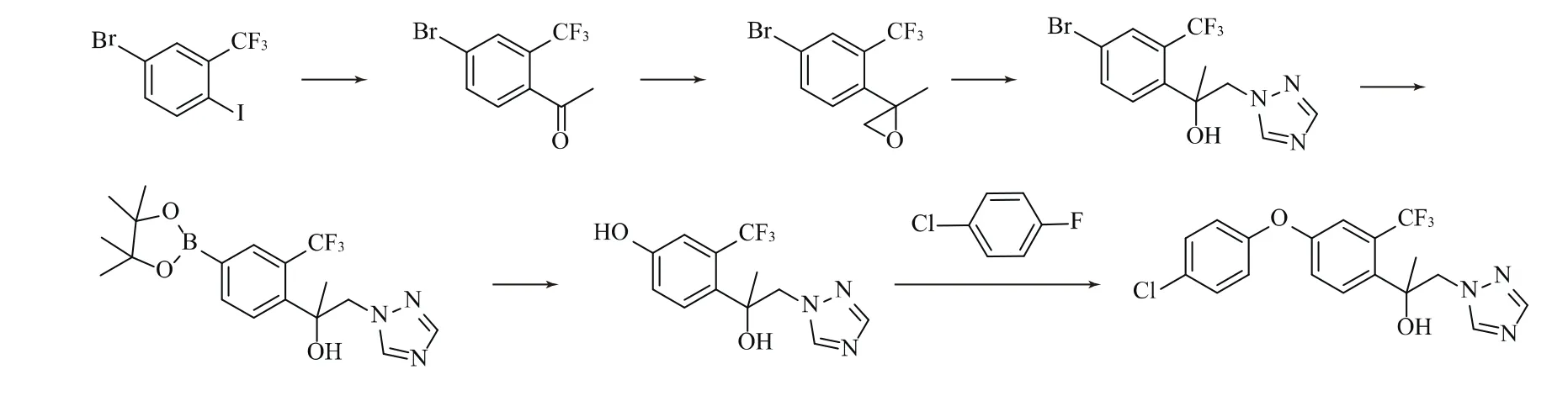
路線3:由4-溴-2-三氟甲基碘苯與異丙基氯化鎂生成格氏試劑,與乙酰氯反應生成4-溴-2-三氟甲基苯乙酮,再與三甲基锍碘化物反應生成2-(4-溴-2-三氟甲基苯基)-2-甲基環氧乙烷,與1,2,4-三氮唑在堿性條件下發生開環反應,生成1-(4-溴-2-三氟甲基苯基)-1-甲基-2-(1,2,4-三唑-1-基)乙醇,再與雙(頻哪醇合)二硼發生反應得到1-[2-氯-4-(4,4,5,5-四甲基-1,3,2-二氧雜硼雜戊環)-2-基] -1-甲基-2-(1,2,4-三唑-1-基)乙醇,加入雙氧水氧化得到3-三氟甲基-4-[1-甲基-1-羥基-2-(1,2,4-三唑-1-基)乙基] 苯酚,最后在堿性條件下與4-氯氟苯發生醚化反應,生成氯氟醚菌唑[6]。
2 合成方法
2.1 合成方法1
將4-氟-2-三氟甲基苯乙酮622.0 g(3.02 mol)、4-氯苯酚426.7 g(3.32 mol)、碳酸鉀542.1 g(3.92 mol)和DMF 2 365 mL混合,120℃下攪拌5 h,140℃下攪拌5 h。冷卻后將該混合物加入鹽水溶液中并用MTBE萃取3次。將有機相合并,用10%LiCl水溶液洗滌2次并干燥。蒸發溶劑得到中間體1-[4-(4-氯苯氧基)-2-三氟甲基苯基] 乙酮884.7 g,收率88%。
1H NMR(400 MHz,CDCl3)δ:2.60(s,3H)、6.98(d,2H)、7.10(d,1H)、7.30(s,1H)、7.35(d,2H)、7.50(d,1H)[1]。
將DMSO 140 mL(1.97 mol)加入氫化鈉0.831 g(33 mmol)和THF 53 g的混合物中,冷卻至約5℃。然后滴加DMSO 80 mL與三甲基锍碘化物6.42 g(31.5 mmol)的混合物,并將該混合物在5℃下攪拌1 h。然后滴加含中間體1-[4-(4-氯苯氧基)-2-三氟甲基苯基] 乙酮5.0 g(14.3 mol)的40 mL DMSO溶液,5 min內滴完。攪拌15 min,用飽和氯化銨溶液(150 mL)淬滅,并用MTBE萃取3次。將有機相合并,用水洗滌并干燥。蒸發溶劑,得到黃色油狀物2-[4-(4-氯苯氧基)-2-三氟甲基苯基] -2-甲基環氧乙烷4.4 g,收率為89%。
1H NMR(400 MHz,CDCl3)δ:1.65(s,3H)、2.95-3.05(d,2H)、6.95(d,2H)、7.10(d,1H)、7.25(s,1H)、7.35(d,2H)、7.65(d,1H)[1,5]。
將2-[4-(4-氯苯氧基)-2-三氟甲基苯基] -2-甲基環氧乙烷1.92 g(4.96 mmol)、1,2,4-三氮唑1.715 g(24.8 mmol)、NaOH 0.496 g(12.41 mmol)和N-甲基吡咯烷酮48 mL的混合物在110℃下攪拌1 h,130℃下攪拌4 h。冷卻至室溫后,加入飽和氯化銨溶液,并將有機相用MTBE萃取3次。將有機相合并,用10%LiCl溶液洗滌2次并干燥。蒸發溶劑,加入二異丙醚后出現沉淀物,得到白色固體終產物2-[4-(4-氯苯氧基)-2-三氟甲基苯基] -1-[1,2,4] 三唑-1-基丙-2-醇1.55 g,收率為75%[1,5]。
2.2 合成方法2
使1-溴-4-氟-2-三氟甲基苯2.04 g與碳酸鉀4.18 g在二甲基甲酰胺中混合,并將反應混合物加熱至110℃。然后加入4-氯苯酚3.68 g(15.14 mmol),并將所得混合物在110℃下攪拌5 h。冷卻,并用水/DCM萃取,將有機層用氯化鋰水溶液洗滌,然后用氫氧化鈉水溶液洗滌,干燥,過濾并蒸餾,得到油狀物1-溴-4-(4-氯苯氧基)-2-三氟甲基苯3.14 g。
1H NMR(400 MHz,CDCl3)δ:6.80(d,1H)、6.95(d,2H)、7.35(d,2H)、7.55(d,1H)、7.80(s,1H)[1]。
在室溫下,將1-溴-4-(4-氯苯氧基)-2-三氟甲基苯100.0 g(0.28 mol)溶于500 mL THF溶液中,再滴加異丙基氯化鎂/氯化鋰配合物284 mL(1.3 mol/L),攪拌2 h。將該混合物滴加到乙酰氯29.0 g(0.37 mmol)在500 mL THF中的溶液中。將所得反應混合物攪拌150 min,并用飽和氯化銨溶液淬滅。再用水/MTBE萃取后,將有機溶劑干燥并蒸發,得到黃色油狀物1-[4-(4-氯苯氧基)-2-三氟甲基苯基] 乙酮96.6 g。
1H NMR(400 MHz,CDCl3)δ:2.6(s,3H)、7.0(d,2H)、7.10(d,1H)、7.30(s,1H)、7.37(d,2H)、7.50(d,1H)[1]。
將溴29.6 g(185 mmol)滴加到1-[4-(4-氯苯氧基)-2-三氟甲基苯基] 乙酮61.4 g(185 mmol)在700 mL乙醚溶液中,3 min內加完。將該混合物在室溫攪拌90 min,然后在攪拌下緩慢加入1 L冰冷水和300 mL飽和碳酸氫鈉溶液混合物,至pH值為7~8。將有機相用MTBE萃取2次,并用LiCl溶液洗滌。干燥并蒸發溶劑,得到褐色油狀物2-溴-1-[4-(4-氯苯氧基)-2-三氟甲基苯基] 乙酮76 g,收率為83%。
1H NMR (400 MHz,CDCl3)δ:4.35 (s,2H)、7.0(d,2H)、7.12(d,1H)、7.34(s,1H)、7.38(d,2H)、7.55(d,1H)[1]。
將1,2,4-三唑3.76 g(53 mmol)緩慢分批加入氫化鈉1.28 g(53 mmol)與150 mL THF混合物中,室溫下攪拌30 min。向該溶液中滴加溶解在100 mL THF的2-溴-1-[4-(4-氯苯氧基)-2-三氟甲基苯基] 乙酮20.0 g(40.7 mmol),室溫下攪拌約150 min。將反應混合物冷卻至10℃,并緩慢滴加至冰冷水和氯化銨混合溶液中,將有機層用乙酸乙酯萃取3次。將有機相合并,干燥并蒸發溶劑。由二異丙醚重結晶得到白色固體中間體1-[4-(4-氯苯氧基)-2-三氟甲基苯基] -2-[1,2,4] 三唑-1-基-乙酮14.5 g,收率為84%。
1H NMR(400 MHz,CDCl3)δ:5.42(s,2H)、7.05(d,2H)、7.15(d,1H)、7.38(s,1H)、7.42(d,2H)、7.60(d,1H)、8.0(s,1H)、8.25(s,1H)[1]。
將2.4 mL LaCl3·2LiCl的THF溶液0.6 mol/L與1-[4-(4-氯苯氧基)-2-三氟甲基苯基] -2-[1,2,4] 三唑-1-基-乙酮0.5 g(1.31 mmol)溶于5.0 mL混合溶液中,并在室溫下攪拌30 min。在室溫下將所得溶液滴加到1-丙炔基溴化鎂1.5 mL(0.5 mol/L)和THF混合溶液中,攪拌30 min,將所得混合物用10%HCl水溶液淬滅,并用MTBE萃取。有機相用鹽水洗滌,干燥,蒸餾,在反相色譜柱上提純之后,得到固體2-[4-(4-氯苯氧基)-2-三氟甲基苯基] -1-(1,2,4-三唑-1-基)戊-3-炔-2-醇25 mg,熔點為137℃。
按照類似方法,將1-[4-(4-氯苯氧基)-2-三氟甲基苯基] -2-[1,2,4] 三唑-1-基-乙酮的THF溶劑滴加到甲基溴化鎂中,得到2-[4-(4-氯苯氧基)-2-三氟甲基苯基] -1-[1,2,4] 三唑-1-基丙-2-醇,熔點為121~122℃[1]。
2.3 合成方法3
3-三氟甲基-4-[1-甲基-1-羥基-2-(1,2,4-三唑-1-基)乙基] 苯酚的合成方法,參照WO2015/185708中類似物的合成方法,以4-溴-2-三氟甲基-1-碘苯為起始原料經過格氏反應,環氧化,開環,硼化和脫酯化5步反應得到[6]。
參照WO2015/185708中類似物的合成,以3-三氟甲基-4-[1-甲基-1-羥基-2-(1,2,4-三唑-1-基)乙基] 苯酚和4-氯氟苯為原料,在堿性條件下進行醚化反
3 小結
總結了氯氟醚菌唑經文獻報道的3條合成路線,路線2和路線3路線相對較長,多步涉及到如格氏反應等危險工藝,產生“三廢”量大,總收率相對較低。路線1所用原料易得,反應條件溫和,路線短,收率高,合成成本低,是相對比較適宜的工業化路線。

