大鼠paralemmin-3基因重組慢病毒載體構建及其在肺泡巨噬細胞中的表達
唐儉,陳旭昕,樊重陽,韓志海,△
肺泡巨噬細胞是體內重要的吞噬和抗原提呈細胞,其作為固有免疫系統中的“第一道防線”參與了多種肺部疾病包括急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)的發病過程[1-2]。目前依據極化狀態的不同,巨噬細胞可分為M1和M2兩個亞群,調控巨噬細胞極化方向是治療ARDS等多種炎癥失控疾病的潛在策略[3]。Paralemmin-3(PALM3)屬于Paralemmin蛋白家族,本課題組前期研究表明,下調PALM3的表達可以抑制脂多糖(lipopolysaccharide,LPS)誘導的巨噬細胞炎性反應[4],但上調PALM3的表達對巨噬細胞極化方向是否存在影響尚少見報道。因此,本研究擬通過以慢病毒為介導,構建含大鼠PALM3基因的重組慢病毒載體,并測定PALM3在肺泡巨噬細胞中的表達情況,以期為后續實驗奠定基礎。
1 材料與方法
1.1 材料 大腸桿菌感受態細胞(DH5α)及293T細胞由武漢普諾賽生命科技有限公司提供;大鼠肺泡巨噬細胞(NR8383)購自美國模式培養物集存庫;pCV186載體及慢病毒空載體pCV186-Cherry購自上海吉凱基因化學技術有限公司;DMEM培養基、Ham’s F12培養基和胎牛血清均為GIBCO公司產品。Lipofectamine 2000脂質體轉染試劑盒及Trizol購自Invitrogen公司;質粒抽提試劑盒膠購自Qiagen公司;DNA回收、純化試劑盒、聚合酶鏈反應技術(PCR)試劑、DNA連接試劑盒、BamHⅠ和AgeⅠ限制性內切酶購自TaKaRa公司;抗鼠PALM3多克隆抗體購自Sigma公司;抗GAPDH及二抗購自Santa Cruz公司;蛋白定量和細胞蛋白提取試劑盒購自江蘇碧云天公司;ECL-PLUS發光試劑盒及蛋白Marker均購自Thermo Fisher公司。
1.2 方法
1.2.1 細胞培養 293T細胞所用培養液為含10%胎牛血清的DMEM培養基,置于37℃、5%CO2及95%濕度培養箱中培養,每隔1 d換液1次,2~3 d傳代1次。NR8383細胞所用培養液為含10%胎牛血清的Ham’s F12培養基,置于37℃、5%CO2恒溫培養箱中培養,每隔2 d換液1次,3~4 d傳代1次,實驗所用細胞均處于對數生長期。
1.2.2 鼠PALM3基因擴增 在GenBank中查閱大鼠PALM3的mRNA序列(XM-002728582),采用premier 5.0設計特異性引物,上游引物:5′-AGGTCGACTCTAGAGGATCCCGCCACCATGGCTCTGCAGACCCCGGTG-3′;下游引物5′-TCCTTGTAGTCCATACCGGTCATGACCACACAACACTGGCACG-3′,BamHⅠ酶切位點為GGATCC,AgeⅠ的酶切位點為ACCGGT。引物的設計和合成由上海吉凱基因化學技術有限公司完成。反應條件如下:依次98℃5 min;98℃10 s,55℃10 s,72℃90 s,以上循環30次,取10μL PCR產物進行1%瓊脂糖凝膠電泳分析。
1.2.3 重組質粒pCV186-cherry-PALM3的構建與鑒定 用BamHⅠ和AgeⅠ酶切質粒pCV186-cherry及鼠PALM3基因擴增產物,酶切產物純化后,用DNA連接酶連接線性化的pCV186-cherry及rat-PALM3基因片段,轉化至DH5α,在含有氨芐青霉素抗性的LB瓊脂培養平板上培養過夜,挑選單克隆擴大培養,行PCR鑒定,PCR反應的上游引物:5′-AAAAGCTTGGGGCAGAGCTG-3′;下 游 引 物 :5′-CCTTATAGTCCTTATCATCGTC-3′。此引物由上海吉凱基因化學技術有限公司合成,反應條件如下:94℃3 min;94℃30 s,55℃ 30 s,72℃ 90 s,共22次循環。取10μL PCR產物進行1%瓊脂糖凝膠電泳分析,對PCR鑒定正確的陽性克隆小提質粒并送檢測序。
1.2.4 重組慢病毒lenti-CV186-Cherry-PALM3的包裝與滴度測定 采用Qiagen公司的質粒抽提試劑盒對重組質粒及輔助包裝質粒pHelper 1.0和pHelper 2.0進行高純度無內毒素抽提,按Lipofectamine 2000脂質體說明書將重組質粒及輔助包裝質粒pHelper 1.0和pHelper 2.0共轉染293T細胞,轉染8 h后更換為完全培養基繼續培養48 h,收集細胞培養上清液,4℃,4 000 r/min離心10 min,隨后將上清液過濾到40 mL超速離心管中,25 000 r/min、4℃離心2 h,此時收集到的即為病毒濃縮液,病毒液保存于-70℃冰箱中備用。將293T細胞以5×104個/孔接種于96孔板中,37 ℃、5%CO2培養箱內培養過夜。分別加入逐孔稀釋的病毒液(1×10-1~1×10-6),12 h后去除含慢病毒的培養基,換為新鮮完全培養基繼續培養48 h,然后采用熒光標記法在熒光倒置相差顯微鏡下觀察并計算各孔中表達熒光的細胞數。
1.2.5 最佳感染復數(multiple of infection,MOI)篩選 將對數生長期的NR8383細胞制成細胞懸液,以1×105/孔的密度接種到96孔板中,當細胞融合度達80%時,以不同MOI值(0、1、10、20、50)的重組慢病毒lenti-CV186-Cherry-PALM3感染細胞,轉染方法同1.2.4。根據以下公式計算轉染效率:轉染效率=Cherry陽性細胞數/總細胞數×100%。轉染效率90%以上的最低MOI值為最佳MOI值。
1.2.6 Western blot檢測慢病毒感染NR8383細胞內PALM3的表達 同1.2.5接種NR8383細胞到6孔板中,接種密度為1×106/孔,分為以下3組:空載體組、空白對照組及慢病毒lenti-CV186-Cherry-PALM3感染組(MOI=20),同1.2.4轉染NR8383細胞。轉染48 h后用蛋白提取試劑盒提取細胞的總蛋白,測定蛋白濃度后,以GAPDH為內參,取20μg樣品依次行SDS-PAGE電泳、電轉至PVDF膜,經過脫脂牛奶封閉后,依次加入山羊抗大鼠PALM3多克隆抗體(1∶500)、辣根過氧化物酶標記的兔抗山羊二抗(1∶2 500),ECL發光液中顯色。放入GBOX-HR凝膠成像分析系統中進行攝像分析。以GAPDH作為內參照,以PALM3的灰度值/GAPDH的灰度值代表PALM3蛋白的相對表達水平。
1.3 統計學方法 采用SPSS 16.0統計軟件進行分析。所有數據以均數±標準差(±s)表示,多組間比較采用單因素方差分析,組間多重比較采用SNK-q檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 目的基因PALM3的擴增 PCR擴增PALM3基因片段,預期條帶大小為2 246 bp,經1%瓊脂糖凝膠電泳后,擴增出的條帶位于2 000~3 000 bp之間,片段大小與預期結果一致,見圖1。
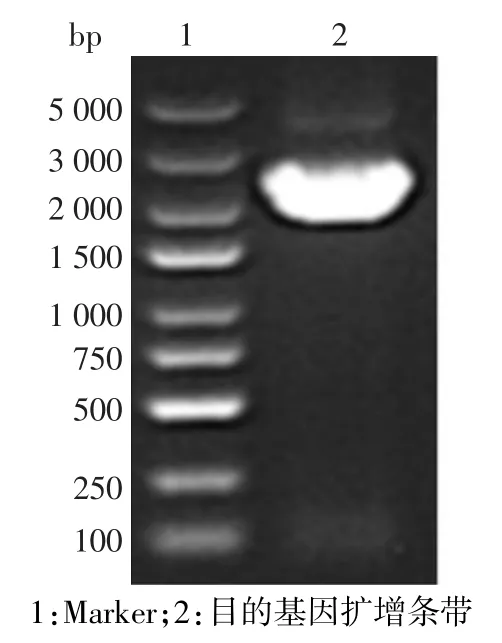
Fig.1 Electrophoresis of PALM3 gene segment by PCR amplification圖1 PCR擴增PALM3基因片段電泳結果
2.2 重組載體pCV186-Cherry-PALM3的PCR鑒定 重組質粒pCV186-Cherry-PALM3的陽性克隆PCR產物大小為1 045 bp,設立內參GAPDH片段作為陽性對照,其對應的產物大小為1 000 bp,同時設立ddH2O作為空白對照、空載體作為陰性對照,見圖2。
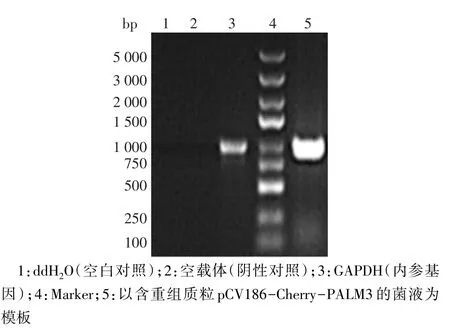
Fig.2 Electrophoresis identification of recombinant plasmid vector pCV186-Cherry-PALM3 by PCR圖2 重組質粒pCV186-Cherry-PALM3的PCR電泳鑒定
2.3 重組載體pCV186-Cherry-PALM3的測序鑒定 挑選經PCR鑒定成功的陽性克隆送檢測序,測序結果證實rat-PALM3基因序列正確,無突變或缺失,與GenBank信息庫中rat-PALM3基因mRNA一致,表明重組質粒pCV186-Cherry-PALM3已成功構建,見圖3。
2.4 慢病毒顆粒包裝及滴度測定 重組質粒pCV186-Cherry-PALM3、輔助質粒(pHelper 1.0、pHelper 2.0)共轉染293T細胞,轉染48 h后在熒光顯微鏡下可觀察到特異性紅色熒光,見圖4,證明此重組慢病毒包裝成功。轉染293T細胞后,重組慢病毒lenti-CV186-Cherry-PALM3感染滴度為3×108TU/mL。
2.5 轉染NR8383細胞最佳MOI篩選及轉染效率測定 轉染48 h后,肺泡巨噬細胞NR8383開始出現少量紅色熒光,隨著轉染時間延長,各組熒光強度逐漸增強,96 h后達到穩態,見圖5。MOI值為0、1、10、20、50時,轉染效率分別為 0、(11.33±1.86)%、(40.0±2.89)%、(92.33±1.45)%、(80.33±2.60)%,差異有統計學意義(n=3,F=387.600,P<0.05),最佳MOI值為20。
Fig.3 DNA sequencing analysis of recombinant plasmid vector pCV186-Cherry-PALM3圖3 重組質粒pCV186-Cherry-PALM3的測序結果
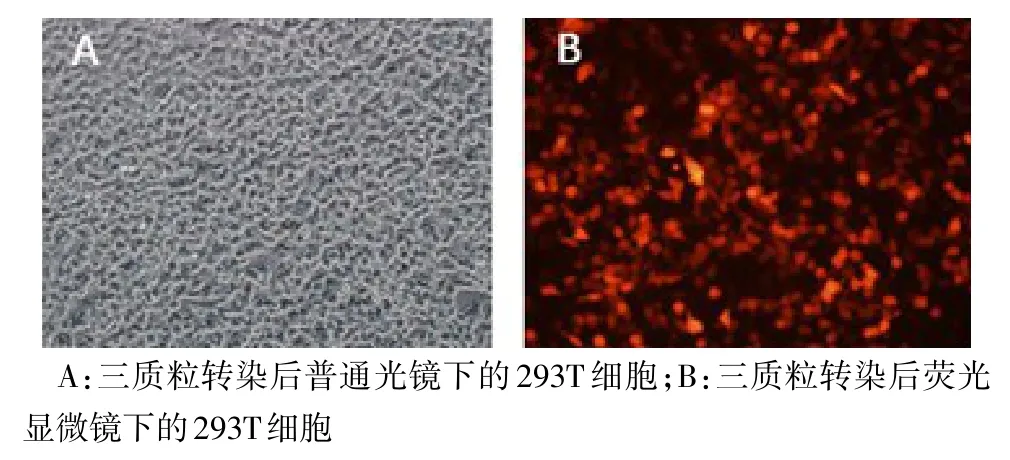
Fig.4 The morphology of 293T cells at 48 h after plasmid transfection under phase contrast and fluorescence microscopy(×200)圖4 三質粒共轉染48 h后293T細胞在普通光學顯微鏡及熒光顯微鏡下的觀察(×200)
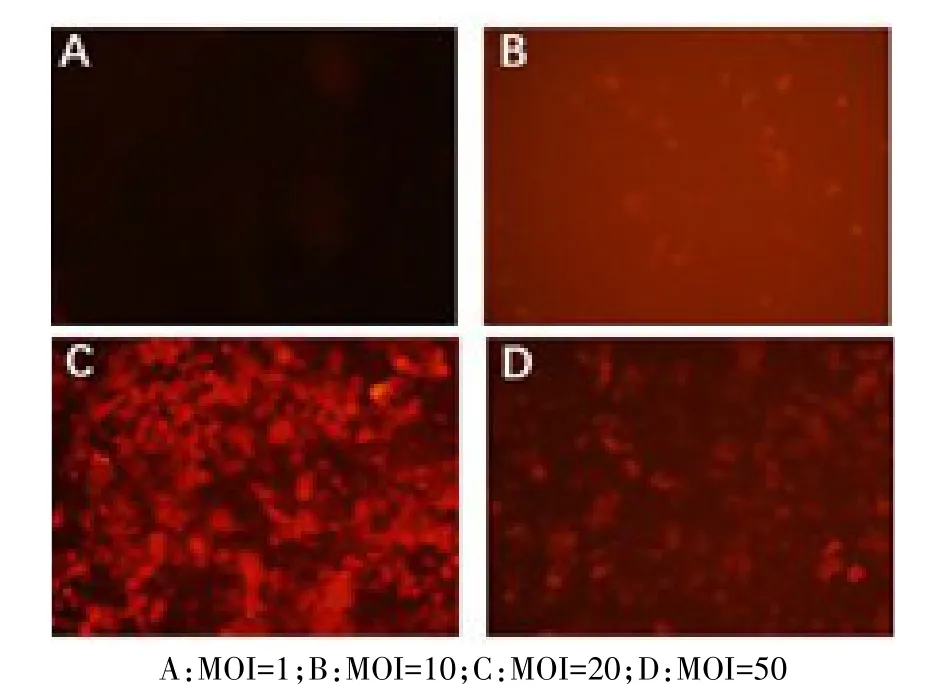
Fig.5 The fluorescence expression in NR8383 cells after transfection with lenti-CV186-Cherry-PALM3(×200)圖5 重組慢病毒lenti-CV186-Cherry-PALM3轉染NR8383細胞96 h后熒光表達情況(×200)
2.6 Western blot檢測PALM3蛋白表達情況 重組慢病毒lenti-CV186-Cherry-PALM3按MOI=20轉染NR8383細胞96 h后,lenti-CV186-Cherry-PALM3轉染組PALM3蛋白表達較空白對照組和空載體組顯著增強,差異有統計學意義(n=3,F=43.670,P<0.05);而空載體組與空白對照組PALM3蛋白表達差異無統計學意義(P>0.05),見圖6。
3 討論
成熟的巨噬細胞在各種因素下出現表型及形態分化,即巨噬細胞的極化現象[5]。極化后的巨噬細胞亞型可以細致調節及回應各種不同的刺激,在機體宿主防御、免疫應答、維持內環境穩定中扮演著重要角色[6]。巨噬細胞極化的機制是刺激信號通過膜受體啟動胞內信號轉導通路,通過激活轉錄因子啟動不同基因表達以實現表型特征。巨噬細胞極化受多種信號分子調控,目前比較明確具有調節巨噬細胞極化作用的轉錄因子包括:核因子-κB、轉錄激活蛋白1、信號轉導子和轉錄激動子、細胞因子信號抑制因子及過氧化物酶體增殖物激活受體等[7]。
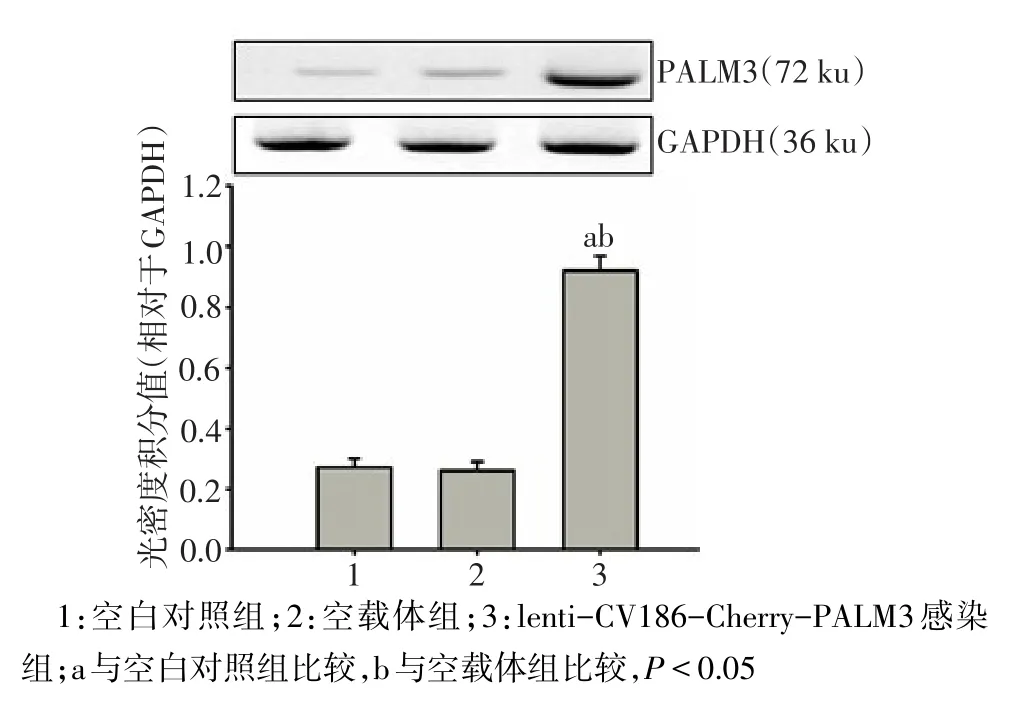
Fig.6 Western blot analysis of PALM3 protein expression in NR8383 cells圖6 NR8383細胞中PALM3 Western blot分析
PALM3是一種異戊二烯/棕櫚酰錨定的磷蛋白。最早于1992年為Cornish等[8]在非洲爪蛙中被發現,并將其稱為Xlgv7/Xlcaax-1。PALM3主要參與細胞膜動力學、細胞的運動性、細胞形狀控制及腫瘤淋巴管形成等[9]。前期研究發現,PALM3在肺泡上皮中參與了脂多糖(LPS)誘導的炎癥反應,下調PALM3的表達可以減輕LPS誘導的炎癥反應及改善內毒素性急性肺損傷的程度[10-11]。本課題組近期研究發現,PALM3在肺泡巨噬細胞NR8383中有表達,下調PALM3的表達同樣能抑制LPS誘導的炎癥反應,而且下調PALM3后可抑制NR8383細胞中Toll樣受體/白細胞介素-1受體信號(Toll like receptor/Interleukin-1 receptor,TIR)通路中復合物的形成[4]。這些結果提示PALM3可能作為“接頭”分子,參與TIR信號的轉導,而TIR信號通路又參與了巨噬細胞的極化,因此筆者推測PALM3除了在巨噬細胞中參與調控LPS誘導的炎癥以外,可能還參與了巨噬細胞極化的調控。調控巨噬細胞中PALM3的表達水平可能影響巨噬細胞極化的方向,從而改善炎癥和免疫相關疾病的預后。
慢病毒是逆轉錄病毒的一個亞類,其優勢是具有同時感染分裂細胞與非分裂細胞的獨特能力,而其他逆轉錄病毒僅可感染分裂細胞[12]。對于原代細胞、干細胞等一些較難轉染的細胞,應用慢病毒載體可以大大提高靶基因轉導效率,使目的基因整合到宿主細胞基因組中的可能性大大增加,能夠較方便快捷地實現目的基因長期、穩定表達[13]。本研究采用三質粒表達系統,包括2個輔助包裝質粒和1個表達質粒,3個質粒共轉染1個細胞系,使序列重疊的機會減少,減少載體重組過程中產生有復制能力病毒的可能性[14]。表達質粒主要表達目的基因、報告基因及目的基因啟動子等,而輔助包裝質粒表達病毒包裝所需的結構蛋白。表達載體和包裝質粒載體互補,共轉染包裝293T細胞后成功制備出重組慢病毒lenti-CV186-Cherry-PALM3,采用熒光標記法測定病毒滴度為3×108TU/mL。轉染巨噬細胞后可以觀察到報告基因Cherry表達,最佳MOI為20。后期經Western blot法檢測目的基因PALM3表達,證實制備的重組慢病毒lenti-CV186-Cherry-PALM3對肺泡巨噬細胞系NR8383細胞具有較高的感染效率。
綜上所述,本研究利用基因工程技術成功構建了含鼠PALM3基因的重組慢病毒載體lenti-CV186-Cherry-PALM3,其滴度為 3×108TU/mL,感染NR8383細胞的最佳MOI值為20。該重組慢病毒載體不僅能夠在真核細胞中實現PALM3的過表達,還可利用標簽Cherry實現目的基因的示蹤定位,為下一步研究PALM3對肺泡巨噬細胞極化的影響奠定了前期基礎。

