腎移植急性排斥受者外周血OX40 mRNA和Th1的變化及意義
左婭薇,莫春柏,李光,耿潔,王玉亮△
器官移植已成為治療多種器官終末期疾病的最有效手段。盡管近年來隨著器官保存、組織配型技術的發展,以及新型免疫抑制劑的廣泛應用,腎移植患者所移植腎臟短期存活率獲得很大的提高,但遠期效果并沒有得到相應的改善。急性排斥是導致移植腎功能喪失的最主要的因素之一[1]。腫瘤壞死因子受體超家族成員-OX40(CD134)作為一種共刺激分子,對于維持CD4+T細胞的活化、增殖、存活以及記憶T細胞的形成起到關鍵作用[2]。本研究探討腎移植急性排斥患者外周血單個核細胞(PBMCs)中OX40 mRNA表達水平以及外周血CD3+CD8-T輔助細胞(Th)1、Th2在預測腎移植急性排斥反應中的應用價值。
1 對象與方法
1.1 研究對象 收集2016年1月—2017年1月在天津市第一中心醫院器官移植中心接受腎移植手術的急性排斥受者20例,男14例,女6例,平均年齡(43±10)歲。急性排斥反應診斷標準:尿量減少,發熱(體溫可>38℃),血壓升高,實驗室檢查肌酐升高、蛋白尿、尿比重下降,尿脫落細胞檢查發現集合小管、核殘余細胞碎片及纖維蛋白原沉著增多,彩超顯示移植腎體積增大、血流減少、血管阻力增加。另選取同期術后腎功能穩定受者20例為腎功能穩定組,男13例,女7例,平均年齡(40±12)歲。腎功能穩定判斷依據:術后7 d內移植腎功能恢復正常,B型超聲檢查顯示移植腎體積、結構和血流均正常。以20例本院健康志愿者作為對照組,男15例,女5例,平均年齡(44±11)歲。所有研究對象均簽訂知情同意書。
1.2 主要試劑與儀器 聚蔗糖-泛影葡胺淋巴細胞分離液(天津市灝洋生物制品科技有限責任公司),TRIzol RNA提取試劑(美國Invitrogen公司),引物及TaqMan熒光探針(美國Applied Biosystems公司),抗人CD3-PE-Cy5、CD8-FITC、IFN-γ-PE和IL-4-PE單克隆抗體(美國eBioscience公司),FACS溶血素、FACS通透液(美國BD公司),佛波酯、離子霉素、莫能酶素(美國Sigma公司),RPMI 1640培養液、胎牛血清(美國Gibco公司),ABI 7500實時熒光定量PCR擴增儀(美國Applied Biosystems公司),FACS Calibur流式細胞儀(美國BD公司)。
1.3 方法
1.3.1 OX40 mRNA水平檢測 清晨采集研究對象的空腹外周靜脈血5 mL,乙二胺四乙酸抗凝。用淋巴細胞分離液密度梯度離心法常規分離PBMCs。TRIzol法提取細胞總RNA。按逆轉錄酶說明書操作合成cDNA,產物于-80℃保存。OX40引物上游 5′-ACGACGTGGTCAGCTCCAA-3′,下游5′-TCCGCTCACTCCCACTTCTG-3′,探針序列:5′-FAMAAGCCCTGCACGTGGTGTAACC-TAMRA-3′;內參基因βactin 引物上游 5′-GATGGCCACGGCTGCTT-3′,下游 5′-ACCGCTCATTGCCAATGGT-3′,探針序列:5′-FAMCTACGAGCTGCCTGACGGCCAGG-TAMRA-3′。熒光定量PCR反應條件:50℃ 2 min;95℃ 5 min;95℃ 20 s,55℃ 30 s,72℃1 min,共35個循環。在PCR反應結束后,設定基線水平和閾值,儀器自動繪制標準曲線,并根據標準曲線計算各樣本基因拷貝數[3]。
1.3.2 Th1、Th2細胞因子檢測 將1 mL肝素抗凝血加入含10%胎牛血清的RPMI 1640培養基1 mL混勻,然后加入佛波酯(25 ng/mL)、離子霉素(1μmol/L)刺激劑,及蛋白質轉運抑制劑莫能酶素(2μmol/L),將培養瓶置于培養箱,37℃、5%CO2培養4 h。將刺激好的標本加入Falcon管中,200μL/管。加入20μL胞外抗體CD3-PE-Cy5和CD8-FITC混勻,室溫避光15 min,經洗滌、固定、通透細胞后樣品管加入胞內染色的抗體(IFN-γ-PE和IL-4-PE)10μL,對照管中加入相應的同型對照10μL,混勻,室溫避光30 min并洗滌后,以1%多聚甲醛懸浮細胞,流式細胞儀分析測定CD3+CD8-T淋巴細胞中IFN-γ(Th1)和IL-4(Th2)表達率。
1.4 統計學方法 采用SPSS 16.0統計軟件分析數據,計量資料以均數±標準差(±s)表示,多組間比較采用單因素方差分析,組間多重比較采用LSD-t檢驗,繪制受試者工作特征(ROC)曲線評價OX40及Th1的預測價值并計算ROC曲線下面積(AUC),以P<0.05為差異有統計學意義。
2 結果
2.1 PBMCs中OX40 mRNA表達水平 腎移植術后急性排斥組PBMCs中OX40 mRNA表達水平明顯高于腎功能穩定組和健康對照組,差異有統計學意義(F=27.005,P<0.01),腎功能穩定組 PBMCs中OX40 mRNA水平與健康對照組之間差異無統計學意義(P>0.05);見圖1。TaqMan實時熒光RT-PCR檢測樣本OX40擴增曲線見圖2。
2.2 Th1、Th2表達率 急性排斥組Th1表達率(14.6%±7.3%)明顯高于腎功能穩定組(8.5%±4.1%)和健康對照組(9.8%±4.2%),差異有統計學意義(F=7.026,P<0.01)。3組患者Th2表達率差異無統計學意義(F=1.207,P>0.05);見圖3。Th細胞流式結果見圖4。
Fig.2 PCR positive amplification curve of OX40圖2 OX40 PCR陽性標本擴增曲線
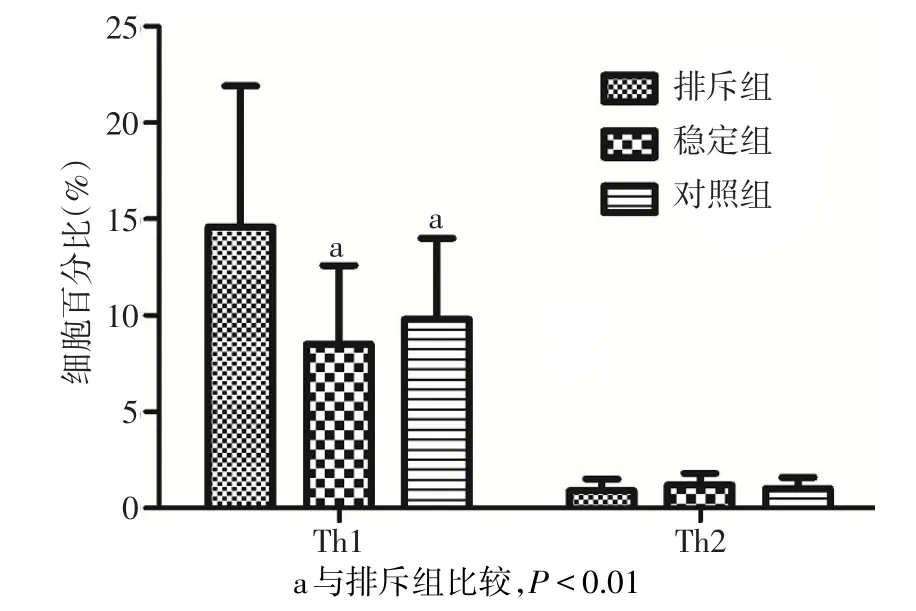
Fig.3 The expression percentage of Th1 and Th2 in three groups圖3 各組Th1、Th2細胞表達率
2.3 ROC曲線分析 OX40 mRNA診斷急性排斥反應的 ROC 曲線下面積(AUC)為 0.903(95%CI:0.825~0.980);Th1診斷急性排斥反應的ROC曲線下面積(AUC)為 0.731(95%CI:0.587~0.874);OX40 mRNA聯合Th1診斷急性排斥反應的ROC曲線下面積(AUC)為0.930(95%CI:0.859~1.001);見圖5。
3 討論
3.1 OX40生物學特性 移植排斥反應的本質是體內免疫系統對外來抗原的免疫應答,受體T細胞作為同種異體免疫排斥反應的主要效應細胞,其活化需要“雙信號”刺激。第一信號包括T細胞接受抗原遞呈細胞提供的外來抗原,第二信號則是共刺激信號通路。OX40作為促進T淋巴細胞活化、增殖和細胞因子分泌的共刺激信號之一,主要在活化的CD4+T細胞表面表達,對于維持CD4+T細胞的活化、增殖、遷移,促進生發中心的形成和樹突狀細胞(DC)的分化成熟起到關鍵作用。在小鼠中OX40在調節性T細胞(Treg)上表達,然而,在人類中OX40表達在外周血Treg上低表達或不表達,但在從炎癥部位(例如惡性腫瘤)分離的Treg中表達較高。OX40配體(OX40L)主要存在于活化的抗原呈遞細胞(例如樹突細胞、B細胞、巨噬細胞和內皮細胞)上,但也可以表達在活化的T細胞表面。OX40/OX40L共刺激信號通路主要在免疫應答的后期起維持和調節共刺激信號的作用,上調IL-2的表達,促進T細胞的活化、增殖和細胞因子分泌,能打破外周免疫耐受,延長T細胞的存活時間[4-5]。本研究結果顯示,急性排斥受者PBMCs中OX40 mRNA表達水平明顯高于腎功能穩定受者,腎移植受者術后服用免疫抑制劑可使機體免疫力受到抑制,OX40分子的低表達抑制淋巴細胞活化,而OX40分子的高表達可促進Bcl-2、Bcl-xL等一系列抗凋亡分子高表達,從而減少T細胞凋亡并維持CD4+T細胞的存活,進一步促進CD4+T細胞穿過血管內皮在炎癥位點的募集[6],因此,腎移植術后PBMCs中OX40 mRNA表達水平在一定程度上可以反映受者當前的免疫狀態。
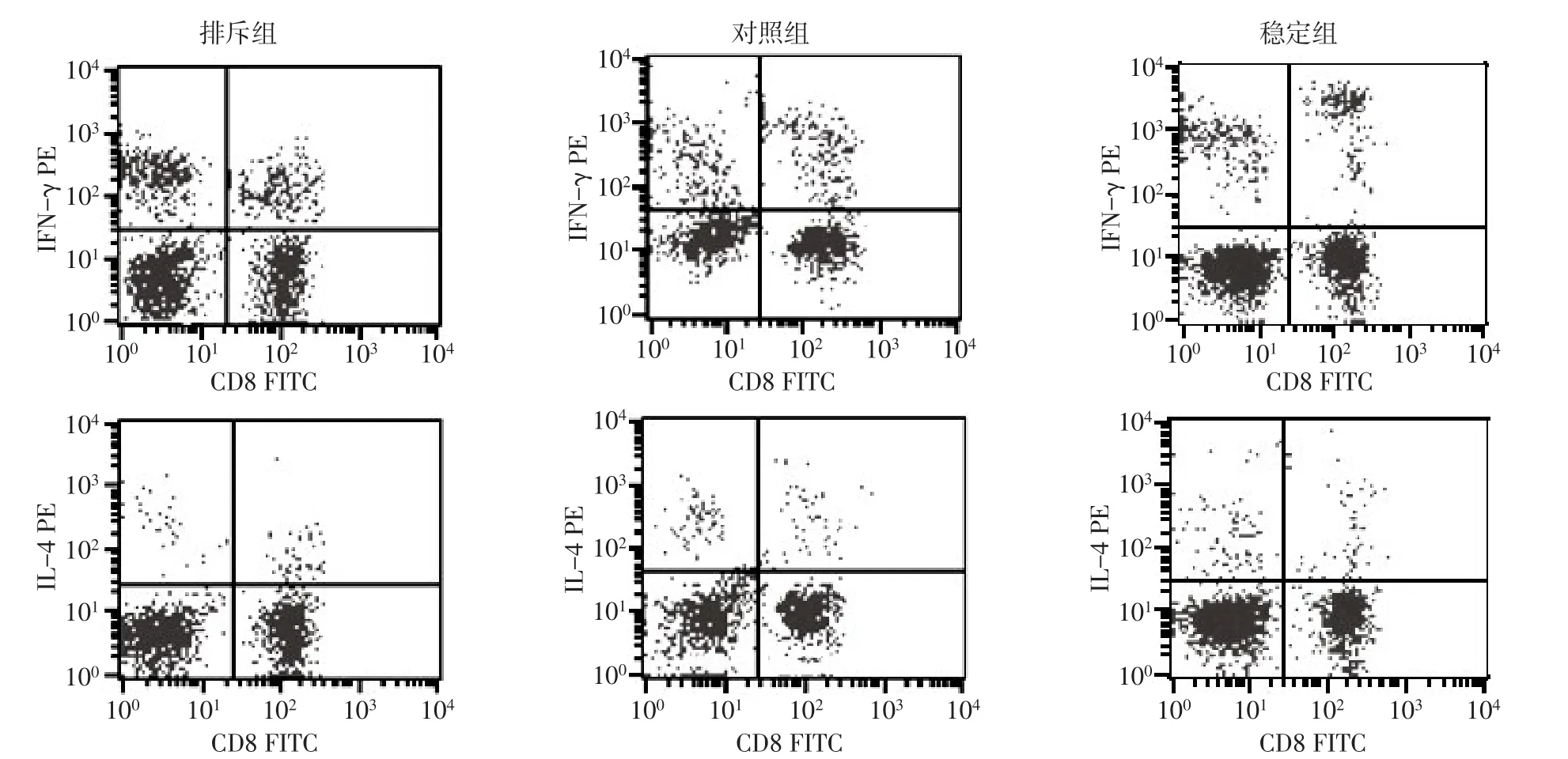
Fig.4 Flow cytometry of Th cells圖4 Th細胞流式細胞圖
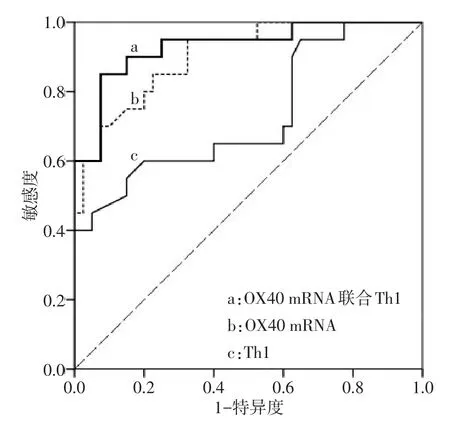
Fig.5 ROC curves of OX40 mRNA and Th1 for predicting acute rejection圖5 OX40 mRNA及Th1預測急性排斥的ROC曲線
3.2 Th細胞亞群 細胞因子作為T細胞分泌的具有生物活性的成分,具有通過結合相應受體來調節T細胞分化、調控免疫應答等多種作用。研究證實,腎移植術后發生細胞介導的急性排斥反應是一種Th1型細胞因子占優勢的免疫反應,而Th2型細胞因子可以誘導移植物形成免疫耐受,利于移植物長期存活。大量研究證實,檢測移植術后Th細胞對于了解移植受者術后免疫功能狀態以及免疫抑制劑合理應用具有一定意義[7-8]。本研究結果顯示,腎移植術后急性排斥受者外周血中CD3+CD8-T淋巴細胞中IFN-γ表達率較腎功能穩定受者顯著升高,而CD3+CD8-T淋巴細胞中IL-4表達率與腎功能穩定受者相比差異無統計學意義。IFN-γ主要由活化的T細胞和自然殺傷(NK)細胞產生,能促進Th0細胞分化為Th1細胞,并抑制Th2細胞增生,激活中性粒細胞功能和NK細胞、巨噬細胞殺傷活性,同時激活的T細胞還可誘導抗原呈遞細胞(APC)產生IL-12,進一步上調IFN-γ[9],是急性排斥反應的重要介質,其促炎功能提示Th1而不是Th2細胞在排斥反應發生發展中發揮重要作用[10]。
3.3 OX40 mRNA、Th1細胞聯合檢測 目前在腎移植領域及時、準確地預測急性排斥反應仍是移植中心的重要研究方向。本研究進一步對檢測指標行ROC分析,結果表明OX40 mRNA、Th1細胞對預測診斷急性排斥反應的AUC值分別為0.903和0.731,兩者聯合預測急性排斥反應的AUC值提升至0.930,這提示聯合檢測這兩個指標對預測腎移植術后急性排斥反應診斷價值較高。進一步特異性阻斷該OX40/OX40L共刺激信號通路將有利于誘導免疫耐受[11]。
綜上所述,腎移植術后急性排斥患者共刺激分子OX40水平上調同時引起Th1增加,監測腎移植受者外周血OX40 mRNA及Th1可以預測急性排斥反應。

