鎖孔清除術與穿刺抽吸術治療基底核區高血壓腦出血的療效及對患者血清NSE水平的影響
魏小兵
(惠州市第三人民醫院,惠州516000)
高血壓腦出血是臨床常見的腦血管疾病,占自發性腦出血的70%~80%;以基底核區最為常見,占50%~60%。目前關于基核節區高血壓腦出血既往采用大骨瓣開顱血腫清除,但手術創傷大,從而影響預后。近年來,隨著微創技術的日趨成熟,微創手術越來越廣泛地應用于臨床。穿刺抽吸術及鎖孔清除術是臨床常用的微創術式,本研究中通過資料回顧性分析,探討基底核區高血壓腦出血采取不同微創術式治療的療效。內容如下:
1 資料與方法
1.1 一般資料
選取我院接收的68例基底核區高血壓腦出血患者,時間為2016年5月至2017年5月期間。納入標準:患者均符合高血壓性顱內出血的相關診斷標準;血腫位置經頭顱CT證實位于基底核區;出血未破入腦室;血腫量不少于30ml,但不超過60ml;血腫位于單側;術前無腦疝形成;患者均于發病后7~24小時內進行手術治療;本研究經醫院倫理委員會批準,患者均知情同意。排除標準:其他原因,如動靜脈畸形、腦血管淀粉樣疾病等造成的腦出血;有嚴重的系統疾病史;既往有顱內出血病史;腫瘤患者。將入選者隨機分為穿刺組(n=34)與鎖孔組(n=34)。鎖孔組中,女14例、男20例,年齡為42~68歲,平均為(54.52±11.55)歲,出血側別左側19例、右側15例,格拉斯哥昏迷評分(GCS)為(6.51±1.23)分,舒張壓為(95.22±10.62)mmHg,收縮壓為(180.31±16.95)mmHg,高血壓病程為(8.26±1.11)年,血腫量為(44.36±6.52)ml;穿刺組中,女13例、男21例,年齡為43~70歲,平均為(54.53±11.58)歲,出血側別左側20例、右側14例,GCS評分為(6.48±1.25)分,舒張壓為(95.26±9.47)mmHg,收縮壓為(180.35±16.55)mmHg,高血壓病程為(8.28±1.05)年,血腫量為(44.38±5.98)ml。在年齡、性別、入院時血壓等資料上,兩組腦出血患者比較無明顯差異(P>0.05),具有可比性。
1.2 方法
鎖孔組:采用全麻,在耳前發跡后做縱行直切口,長5~6cm。切口用撐開器撐開,使顱骨暴露,分離顳肌,用咬骨鉗及銑刀將骨窗擴大,直徑為3~4cm,十字法切開硬膜,使側裂池暴露,將手術顯微鏡置入。對于顱內壓較高者,可先抽吸血腫待顱內壓下降后,選擇顳上回上緣血管分布較少的部位行腦穿刺定位血腫區域,將大腦皮質切開,進入血腫腔。血腫以吸引器吸除,吸引器頭端不可與血腫腔壁腦組織接觸,應放置于血腫腔中央,同時應注意對血腫腔周圍腦組織的保護。為防止引起新的出血,應避免清除與血腫壁粘連緊密的血腫塊。采用明膠海綿壓迫可防止滲血,電凝有活動性出血的血管進行止血。止血徹底后血腫腔留置引流管,待血腫基本吸收后可將引流管拔除。穿刺組:穿刺點應選擇距離血腫位置最近且無大血管經過的頭皮處。2%利多卡因局部麻醉,將頭皮切開后于顱骨上鉆孔,硬腦膜以尖刀十字法切開,應用穿刺針緩慢刺入血腫靶點,若流出暗紅色血腫則表明已進入血腫腔。部分液態血腫以5ml注射器負壓緩慢吸出,為血腫的30%~40%,之后血腫腔以少量生理鹽水沖洗。當沖洗液變較為清亮后對頭皮進行縫合并接引流管。術后試具體情況可將北京托畢西藥業有限公司生產的尿激酶(國藥準字H20046252)2萬U注入血腫腔內,夾閉引流管1小時,再行開放,待術后顱腦CT證實血腫基本吸收后,將引流管拔除。
1.3 觀察指標
根據CT測定術前、術后24小時內的血腫量,統計血腫清除率。血腫清除率=(術前血腫量與術后血腫量的差值/術前血腫量)×100%[1]。腦血腫量采用多田公式計算,即血腫最大層面長(cm)×層高(cm)×寬×π/6[2]。觀察兩組的手術時間、并發癥、引流管留置時間、術中出血量等圍手術期指標。觀察兩組治療前后的卒中量表(NIHSS)評分變化[3],總分為42分,分值與神經受損程度呈正相關。于治療前后清晨空腹狀態下采集患者5ml肘靜脈血,用于測定神經元特異性烯醇化酶(NSE)水平,測定方法為電化學發光法。術后28天時進行Barthel指數量表評定,以評估患者的日常生活能力。
1.4 數據處理方法
采用SPSS 18.0軟件分析及處理數據。以百分比(%)表示計數資料,組間比較采用卡方檢驗,當P<0.05時具有統計學意義;以()表示計量資料,組間比較采用t檢驗。
2 結果
2.1 手術相關指標對比
鎖孔組的手術時間、術中出血量高于穿刺組,但其血腫清除率、ADL評分高于穿刺組,引流管拔除時間較穿刺組明顯要短(P<0.05)。見表1。
2.2 手術前后的NIHSS評分及血清NSE水平比較
術后14天時,鎖孔組的NIHSS評分及血清NSE水平均較穿刺組明顯要低(P<0.05)。見表2。
2.3 病死率及并發癥對比
穿刺組2例死于再出血腦疝、2例死于多器官衰竭,鎖孔組2例死于再出血腦疝,兩組的病死率及術后并發癥發生率比較無明顯差異(P>0.05)。見表3。
3 討論
高血壓腦出血好發于基底核區,多見于40~70歲的中老年人群,由于神經細胞難以再生的特性,因而其致殘率、病死率較高。

表1 手術相關指標對比
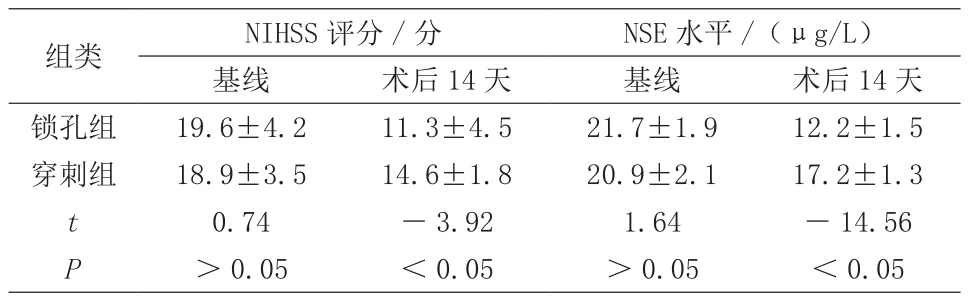
表2 手術前后的NIHSS評分及血清NSE水平比較
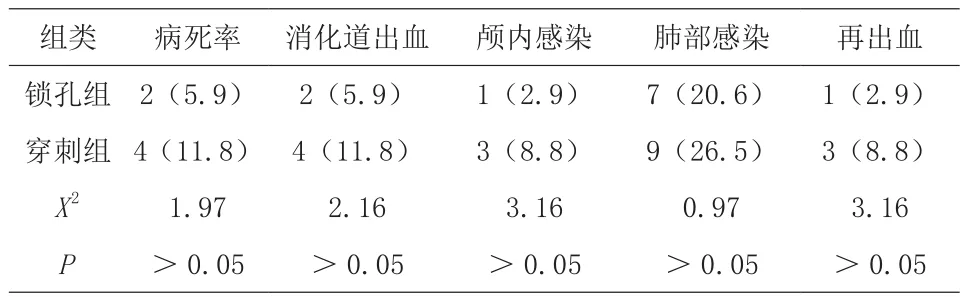
表3 病死率及并發癥對比(n=34,%)
鎖孔清除術與穿刺抽吸術均為治療高血壓腦出血的微創術式。鎖孔血腫清除術在直視下進行確切止血,能盡早地一次性清除血腫,術后的血腫殘留量少,血腫對腦組織的刺激性與損傷減少,繼發性損害較輕,從而改善患者的預后,神經功能恢復較快,同時且使應激反應水平減輕,從而降低相關并發癥的發生。穿刺抽吸術操作簡單,局麻下便可進行,手術創傷小,適用于不能耐受全麻的患者。但手術不能在直視下進入血腫腔內確切止血,穿刺時可能造成穿刺道血管損傷,易形成新的出血。手術難以一次性清除大部血腫,術后的血腫殘留量多,其釋放的細胞毒性產物對周圍腦組織的損傷程度較重,預后往往較差,以及術后尿激酶的反復引流也會增加再出血及顱內感染的概率[4]。NSE屬于非種屬特異性蛋白,其對于保持神經系統的生理功能、維持細胞活性相當重要。現代研究認為[5],在腦組織損傷時,NSE通過血腦屏障,最易從壞死的細胞中釋放入血,導致血中的含量明顯升高,這為腦組織損傷后早期檢測NSE水平以判斷腦損傷程度提供理論依據。研究認為[6-8],在高血壓腦出血患者中血清NSE水平明顯升高,早期檢測NSE水平能較為敏感地反映腦出血后的腦組織損傷程度,有利于評判患者的短期預后和遠期神經功能的恢復程度。
本研究中結果顯示,鎖孔組的手術時間、術中出血量高于穿刺組,但其血腫清除率高于穿刺組,引流管拔除時間較穿刺組明顯要短(P<0.05),提示鎖孔血腫清除術一次性能清除大部分血腫,從而縮短引流管拔除時間。而穿刺組的血腫清除效果稍差,需要尿激酶反復灌注清除血腫,導致引流時間較長。穿刺組的引流管留置時間較長,也增加經引流管途徑發生顱內感染的概率。兩組病的死率及并發癥發生率比較無明顯差異,但鎖孔組的發生率低于穿刺組。此外,本研究中結果顯示,治療后鎖孔組的NIHSS評分及NSE評分低于穿刺組,原因可能是鎖孔組的血腫清除率高,殘余血腫對腦組織的刺激性和損傷減少,從而減輕腦組織損傷程度,促進神經功能恢復,提高短期預后,故鎖孔組患者的ADL評分較穿刺組明顯要高(P<0.05)。
綜上所述,基底核區高血壓腦出血患者采取鎖孔清除術早期血腫清除率高,患者的預后更好,值得推廣。

