聽覺研究中NKCC1與Na+-K+-ATPase 在耳蝸K+循環中的作用研究
錢 迪 鄭偉昌 陳翠霞 敬光懷 湯國棟 黃俊煊
(深圳市龍華區人民醫院耳鼻咽喉科,廣東 深圳 518109)
耳聾是臨床常見的聽力損傷類型,近年來隨著臨床醫學對該病病理機制研究的不斷深入,諸多文獻研究報道從遺傳、環境、病理及藥物等因素探討了其發病機制。據最新的研究報道顯示,血管紋是轉運K+進入耳蝸內淋巴致高鉀環境形成,并促使耳蝸內電位(EP)產生的主要部位[1];而相關動物實驗研究顯示,在大鼠耳蝸中鈉鉀氯協同轉運蛋白1(NKCC1)、Na+-K+-ATP酶(Na+-K+-ATPase) 主要于血管紋邊緣細胞基礎膜側分布,在維持內耳聽力中發揮了重要的參與作用機制[2]。且NKCC1及Na+-K+-ATPase 離子轉運體活動建立起的耳蝸K+循環是EP產生的重要條件。C57BL/6J小鼠是已經證實的具有典型特征的聽力損傷動物模型,本研究主要分析NKCC1與Na+-K+-ATPase 在耳蝸K+循環及中的作用,現報道如下。
1 材料與方法
1.1 動物材料:選擇由動物中心提供的36只健康C57BL/6J小鼠為研究對象,小鼠經近交自行繁殖培育,可保持長時間穩定的聽力,均系小鼠12周齡,體質量12~18 g,平均(15.32±4.26)g。所有試驗小鼠均放置低噪聲環境下進行普通飼養。
1.2 方法:①聽覺腦干反應(ABR)檢測。取實驗鼠12只,予以三溴乙醇腹腔注射麻醉,用量0.53 mg/g;采用銀針電極,于頭頂正中皮下插入正極,于左耳皮下插入參考電極,于右耳皮下插入地極電極,ABR檢測儀器采用美國產ABR儀,刺激參數設置由電腦產生設定的短聲、短純音的8、16、32 kHz為刺激聲。實驗中以能分辨出ABR I波的最低刺激強度作為ABR閥值,ABR檢測3次,取平均值,作正常對照組[3]。②NKCC1抑制劑實驗及恢復實驗。取實驗鼠12只,予以腹腔內注射麻醉后,給予NKCC1抑制劑呋塞米注射,注射30 min后再予以ABR檢測,作為呋塞米實驗組。12只小鼠停藥3 d,后再次行ABR檢測,作為呋塞米恢復組。③Na+-K+-ATPase抑制劑實驗。取實驗鼠12只,予以腹腔內注射麻醉后,給予Na+-K+-ATPase抑制劑哇巴因注射,1次/天,連續注射5 d。第5天注射30 min后再予以ABR檢測,作為哇巴因實驗組。12只小鼠停藥3 d,后再次行ABR檢測,作為哇巴因恢復組。
1.3 觀察指標:通過1.2檢測結果,對比分析對照組、呋塞米實驗組、呋塞米恢復組、哇巴因實驗組、哇巴因恢復組小鼠ABR閥值。
1.4 統計學方法:統計學軟件版本號為SPSS20.0,用(±s)的形式對計量檢測數據進行表示,數據之間的比較用t對其進行檢驗,P<0.05提示數據之間的差異有統計學意義。
2 結 果
2.1 對照組與實驗組小鼠ABR閥值比較:從表1可以看出,在平均ABR閥值指標值上,給藥前,對照組、呋塞米實驗組、哇巴因實驗組比較,差異均無統計學意義(P>0.05);給藥后,呋塞米實驗組、哇巴因實驗組平均ABR閥值均高于給藥前(P<0.05),與正常對照組接近。
表1 對照組與實驗組小鼠ABR閥值比較(±s)
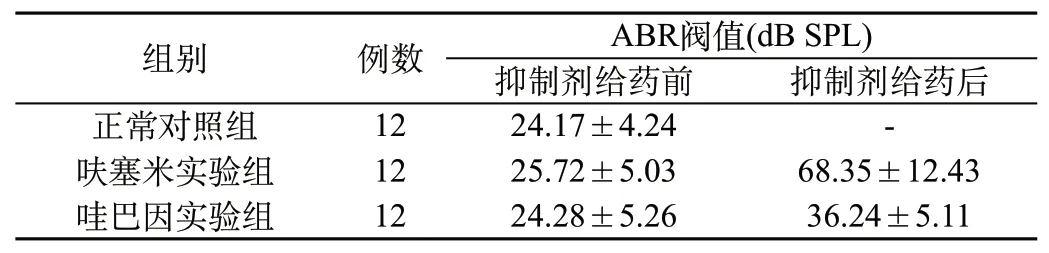
表1 對照組與實驗組小鼠ABR閥值比較(±s)
?
2.2 實驗組小鼠給藥前后ABR閥值比較:從表2可以看出,停止給藥恢復后,呋塞米實驗組、哇巴因實驗組平均ABR閥值均低于給藥后(P<0.05),與給藥前接近。
表2 實驗組小鼠給藥前后ABR閥值比較(±s)
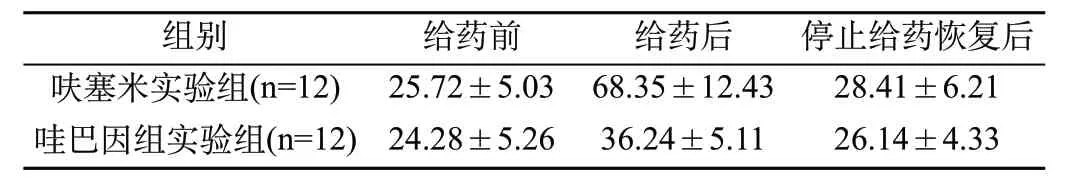
表2 實驗組小鼠給藥前后ABR閥值比較(±s)
?
3 討 論
本研究主要研究聽覺實驗中NKCC1與Na+-K+-ATPase 在耳蝸K+循環中的作用,其中NKCC1是參與耳蝸K+循環生理機制,對聽覺生理功能進行維護的重要功能通道[4];Na+-K+-ATPase會引發細胞內外的Na+濃度差,當Na+經該濃度差于細胞進入時,可經本體蛋白質運載體以共同運輸的方式將通過細胞膜不易的物質帶進細胞。如前文所述,血管紋是轉運K+進入耳蝸內淋巴致高鉀環境形成,并促使耳蝸內電位(EP)產生的主要部位,而在血管紋邊緣細胞底側膜的NKCC1與Na+-K+-ATPase在耳蝸K+循環中則發揮著重要的作用機制[5]。其中Na+-K+-ATPase通過3 Na+的泵出,以交換2K+轉運至邊緣細胞,促使Na+濃度梯度的形成;NKCC1則可通過對內向性Na+濃度梯度的利用以1 Na+:1K+:2Cl-的比例將離子轉運至邊緣細胞。而經邊緣細胞頂膜上的KCNQ1通道將K+分泌至淋巴,進而形成EP,對聽覺功能進行維持[6]。與此同時,分泌至耳蝸內淋巴中的K+經基底膜毛細胞與螺旋韌帶間的通道進行轉運,再次進入邊緣細胞,以此循環,構成耳蝸K+循環機制。因此,血管紋邊緣細胞底側膜的NKCC1與Na+-K+-ATPase對K+的轉運具有限制與促進作用[7]。
本研究通過構建動物聽覺試驗,以健康C57BL/6J小鼠為研究對象,分別設置正常對照組,NKCC1抑制劑呋塞米實驗組、恢復組,Na+-K+-ATPase抑制劑哇巴因實驗組、恢復組。結果顯示:①在平均ABR閥值指標值上,給藥后,呋塞米實驗組、哇巴因實驗組平均ABR閥值均高于給藥前(P<0.05),與正常對照組接近。即通過對NKCC1與Na+-K+-ATPase活性的抑制,小鼠ABR閥值顯著升高。②停止給藥恢復后,呋塞米實驗組、哇巴因實驗組平均ABR閥值均低于給藥后(P<0.05),又與給藥前接近。提示,通過對NKCC1與Na+-K+-ATPase活性的恢復,小鼠ABR閥值顯著降低,且接近正常。上述兩項研究結果證實NKCC1與Na+-K+-ATPase作為離子轉運蛋白,其活性與小鼠聽覺功能密切相關。當小鼠被注入NKCC1抑制劑呋塞米后,耳蝸血管紋邊緣細胞底側膜上分布的NKCC1活性被阻斷,其在耳蝸K+循環中所發揮的作用降低,對K+由邊緣細胞轉運至淋巴,再由淋巴轉運至邊緣細胞的循環路徑進行阻斷,致高鉀環境破壞,EP建立受阻,從而導致聽覺功能障礙,ABR閥值升高[8]。同時,當小鼠被注入Na+-K+-ATPase抑制劑哇巴因后,耳蝸側壁螺旋韌帶纖維細胞膜上分布的Na+-K+-ATPase活性被阻斷,其在耳蝸K+循環中所發揮的作用降低,K+不能泵入,進入邊緣細胞受阻,造成進入淋巴的K+大量減少,EP建立受抑制,同樣引發聽覺功能障礙,ABR閥值升高。另一方面,據相關研究報道證實,NKCC1與Na+-K+-ATPase活性與耳蝸神經變性密切相關。即NKCC1與Na+-K+-ATPase活性的降低,損傷耳蝸微血管內皮細胞功能,使血管基底膜厚度增加,造成微血管供應區神經缺氧、缺血、神經脫髓鞘及髓鞘空泡樣改變,這是誘發耳蝸和耳蝸神經變性的重要因素,不僅可造成聽覺功能受損,同時也是引起耳聾的主要原因。綜上,NKCC1與Na+-K+-ATPase作為離子轉運蛋白,其開展的離子轉運體活動是建立耳蝸K+循環,產生EP及維持聽覺功能的重要因子。

